프리클리닉 이미징
Preclinical imaging프리클리닉 영상(Preclinical imaging)은 약물 개발 [1]등 연구 목적으로 살아있는 동물을 시각화하는 것이다. 영상 양식은 장기, 조직, 세포 또는 분자 수준에서 생리학적 또는 환경적 변화에 반응하는 동물에서 변화를 관찰하는 데 있어 연구자에게 오랫동안 결정적이었다. 비침습적이고 생체내에서의 영상 촬영 양식은 특히 동물 모델을 종방향으로 연구하는데 중요해졌다. 일반적으로 말해서, 이러한 영상 시스템은 주로 형태학/원자학 및 분자영상 기법으로 분류될 수 있다.[2] 고주파 마이크로초음파, 자기공명영상(MRI), 컴퓨터단층촬영(CT) 등의 기법이 해부학적 영상촬영에 주로 사용되며 광학영상(불광학 및 생체발광), 양전자 방출단층촬영(PET), 단일광자방사선 컴퓨터단층촬영(SPEPUP) 등이 분자시각화에 주로 사용된다..[2]
요즘 많은 제조업체들이 CT, MR과 같은 해부학적 양식의 장점을 PET와 SPECT의 기능성 영상과 결합한 멀티모달 시스템을 제공하고 있다. 임상 시장에서와 마찬가지로 공통적인 조합은 SPECT/CT, PET/CT, PET/MR이다.[3][4]
마이크로초음파
원칙: 고주파 마이크로 초초음파(high-prequency micro-ultrashound)는 변환기에서 생명체 시스템으로 무해한 음파의 발생을 통해 작동한다. 음파가 조직을 통해 전파되면서 다시 반사되어 변환기에 의해 집어들어 2D, 3D 영상으로 변환할 수 있다. 마이크로초음속은 15MHz에서 80MHz의 주파수를 가진 소규모 동물 연구를 위해 특별히 개발되었다.[5]
장점: 마이크로 초고속은 초당 최대 1000프레임으로 데이터를 캡처하는 유일한 실시간 영상 촬영 기능이다. 이는 체내 혈류를 시각화할 수 있을 뿐만 아니라, 심지어 생쥐의 혈류나 심장 기능 같은 고속 사건을 연구하는 데까지 사용될 수 있다는 것을 의미한다. 초소형 초소형 시스템은 휴대성이 뛰어나고 전용 설비가 필요 없으며 다른 시스템에 비해 비용 효율이 매우 높다. 또한 방사선의 부작용을 통해 결과를 교란시킬 위험도 발생하지 않는다. 현재 30µm까지 촬영이 가능해 암 혈관신생에 미세한 혈관조영술을 시각화할 수 있다.[5] 모세혈관을 영상화하기 위해 이 분해능은 마이크로 버블 콘트라스트제를 주입하면 3–5 µm까지 증가시킬 수 있다. 또한 분자 시각화를 제공하기 위해 혈소판 및 응고물의 활성 당단백질 IIb/IIIa(GPIB/IIIa) 수용체,[6] αβv3 통합체, 혈관 내피 성장 계수 수용체(VEGFR) 등의 마커에 마이크로버블을 결합할 수 있다. 따라서 마이크로-MRI/PET와 같은 듀얼 영상화 모달리티를 통해서만 얻을 수 있는 폭넓은 어플리케이션이 가능하다. 마이크로초음파 장치는 초음파 연구 인터페이스와 관련된 고유한 속성을 가지고 있는데, 이 장치의 사용자는 대부분의 상업용 초음파(마이크로 및 비마이크로) 시스템에서 일반적으로 사용할 수 없는 원시 데이터에 접근할 수 있다.
약점: 마이크로-MRI, 마이크로-CT, 마이크로-PET, 마이크로-SPECT와 달리 마이크로-초음속은 침투 깊이가 제한적이다. 주파수가 증가함에 따라(해상도 증가), 최대 영상 깊이는 감소한다. 전형적으로 마이크로초음파(micro-ultrashound)는 피부 아래 약 3cm의 영상조직을 촬영할 수 있으며, 이는 쥐와 같은 작은 동물에게는 충분하다. 초음파 이미징의 성능은 운용자의 경험과 기술과 연계된 것으로 인식되는 경우가 많다. 그러나 이는 시스템이 재현성이 높은 결과를 내는 사용자 친화적 장치로 설계되면서 급변하고 있다. 마이크로 초소형 극초음파에서 발생할 수 있는 또 다른 잠재적인 단점은 표적형 미세 버블 조영제가 심지어 종양에서도 혈관 구조 밖으로 확산될 수 없다는 것이다. 그러나 이는 종양 관류 및 혈관신생술 영상과 같은 응용에 실제로 유리할 수 있다.
암 연구: 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 예를 들어, 연구자들은 종양 크기를 2차원과 3차원으로 쉽게 정량화할 수 있다. 뿐만 아니라 초음파를 통해 혈류 속도와 방향도 관찰할 수 있다. 게다가 마이크로 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 영상 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 초소형 조영제를 동물에 주입해 실시간 종양관류 및 바이오마커의 표적 분자 이미징과 정량화를 수행할 수 있다. 최근에는[when?] 마이크로초음파까지 유전자 전달의 효과적인 방법임이 밝혀졌다.[7]
기능성 초음파 뇌영상
혈류 민감도가 제한된 기존 마이크로초음파 장치와 달리 적절한 시퀀스와 처리를 갖춘 전용 실시간 초고속 초음파 스캐너는 작은 동물의 뇌에서 매우 미묘한 혈류역학적 변화를 실시간으로 포착할 수 있는 것으로 나타났다. 그런 다음 이 데이터를 사용하여 신경 혈관 결합을 통한 신경 활동을 유추할 수 있다. 기능성 초음파 영상촬영(fUS) 기법은 아날로그-기능 자기공명영상(fMRI)으로 볼 수 있으며, fUS는 뇌혈관조영술, 뇌기능활동 매핑, 쥐에서 깨어있는 동물을 포함한 영장류까지 뇌기능 연결에 사용할 수 있다.
마이크로-PAT
원칙: 광음단층촬영(PAT)은 짧은 레이저 펄스 등 외부에서 가해진 전자기파로 자극을 받으면 조직이 열적으로 팽창하는 자연현상에 대해 연구한다. 이것은 초음파 파동을 이 조직에서 방출하게 하고, 초음파 변환기에 의해 포착될 수 있다. 열가소성 팽창과 그에 따른 초음파 파장은 사용되는 빛의 파장에 따라 달라진다. PAT는 동물을 이미징할 때 완전한 비침습성을 허용한다. 이것은 특히 연구하기 힘들기로 악명 높은 [8]뇌종양 모델을 다룰 때 중요하다.
장점: Micro-PAT는 다양한 기능에 적용할 수 있는 이미징 모달리티라고 설명할 수 있다. 광학 이미징의 높은 민감도와 초음파 이미징의 높은 공간 해상도를 결합한 것이다. 이 때문에 영상 구조뿐만 아니라 서로 다른 조직 유형 간에 분리, 혈류역학적 반응을 연구할 수 있으며 특정 생물학적 분자에 작용하는 분자 조영제까지 추적할 수 있다. 나아가 비침습적이며 신속하게 수행할 수 있어 같은 동물의 종적 연구에 이상적이다.
약점: 마이크로-PAT는 여전히 빛과 소리의 침투 강도에 의해 제한되기 때문에 무한한 침투 깊이를 가지지 못한다. 그러나 쥐의 두개골을 통과해 몇 센티미터까지 이미지를 내려면 충분해 대부분의 동물 연구에 충분하고도 남는다. 마이크로-PAT의 또 다른 단점은 피드백을 받기 위해 조직의 광학적 흡광도에 의존해 전립선 등 혈관화된 조직이 잘 보이지 않는다는 점이다.[9] 현재까지 시중에서 구할 수 있는 3가지 시스템, 즉 VisualSonics, iThera, Endra가 출시되어 있으며, 마지막 시스템은 실제 3D 이미지 획득을 수행하는 유일한 기계는 VisualSonics, iThera, Endra 입니다.
암 연구: 뇌암에 대한 연구는 동물을 체내에서 연구할 수 있는 쉬운 영상 촬영 방식이 부족했기 때문에 현저하게 저해되어 왔다. 그러기 위해서는 종종 마취 시간, 기계적 인공호흡 등 실험 매개변수를 크게 바꾸는 개두술이 필요하다. 이 때문에 많은 연구자들이 각기 다른 시기에 동물을 희생시키고 전통적인 역사학적 방법으로 뇌조직을 연구하는 데 만족해 왔다. 생체내 종적 연구와 비교하여 유의미한 결과를 얻기 위해서는 더 많은 동물이 필요하며, 전체 실험의 민감성은 의심의 눈초리로 던져진다. 앞서 언급했듯이, 문제는 연구자들이 생체내 영상 촬영 양식의 사용을 꺼리는 것이 아니라, 오히려 적절한 영상 촬영 양식의 부족이다. 예를 들어, 광학 영상촬영은 빠른 기능 데이터와 옥시 및 디옥시헤모글로빈 분석을 제공하지만, 두개골절제술은 필요하며 침투 깊이는 수백 마이크로미터에 불과하다.[9] 나아가 뇌의 한 부분에 초점을 맞추고 있는 반면, 연구 결과 뇌 기능이 전체적으로 상호 연관되어 있는 것이 분명해졌다. 반면 micro-fMRI는 매우 비싸며, 뇌 전체를 스캔할 때 음울한 분해능과 이미지 획득 시간을 제공한다. 그것은 또한 약간의 혈관 구조 정보를 제공한다. Micro-PAT는 기존의 생체내 신경영상 장치에 비해 상당히 향상된 것으로 입증되었다. 그것은 빠르고, 비침습적이며, 많은 양의 데이터 출력을 제공한다. 마이크로-PAT는 높은 공간 분해능으로 뇌를 영상화하고 분자 표적 조영제를 검출하며 SO2와 HbT와 같은 기능 파라미터를 동시에 정량화하고, 종양 정량화와 세포 중심 치료 분석에 매우 유용한 기능 및 분자 영상으로부터 보완적인 정보를 제공할 수 있다.[8]
마이크로-MRI
원리:자기공명영상(MRI)은 자기장 내부의 서로 다른 원자의 핵자기 정렬을 이용하여 영상을 생성한다. MRI 기계는 분석 대상 주변의 자기장을 생성하는 큰 자석으로 구성되어 있다.[10] 이러한 자기장은 수소, 가돌리늄, 망간 등 0이 아닌 스핀 양자수를 가진 원자가 자기장을 따라 자석 쌍극자와 정렬하게 한다. 대상 핵의 Larmor precession 주파수와 근접하게 일치하는 무선 주파수(RF) 신호가 적용되어 핵의 자기장과 정렬을 혼란시킨다. RF 펄스가 끝나면 핵은 이완되어 기계에 의해 포착되는 특성 RF 신호를 방출한다. 이 데이터로 컴퓨터는 다른 조직 유형의 공명 특성에 기초하여 피사체의 이미지를 생성한다.
2012년 이후, 극저온 자석 기술의 사용은 인프라 요구 사항과 극저온 냉각제를 구하기 점점 더 어려워지는 가용성에 대한 의존성을 크게 감소시켰다.[11]
장점: 마이크로-MRI의 장점은 초고강도 자기장에서 최대 100µm, 심지어 25µm까지 공간 분해능이 좋다는 점이다. 정상조직과 병리조직을 구분할 수 있는 대비 분해능도 뛰어나다. 마이크로-MRI는 해부학적, 기능적, 분자적 이미징을 포함한 매우 다양한 용도에 사용될 수 있다. 나아가 마이크로-MRI의 메커니즘은 자기장을 기반으로 하기 때문에 마이크로-CT, 마이크로-PET와 같은 방사선 기반 영상 촬영 양식에 비해 훨씬 안전하다.
약점: 마이크로 MRI의 가장 큰 단점 중 하나는 비용이다. 자기력(해상도 결정)에 따라 자속 밀도의 1.5~14테슬라 동물영상에 사용되는 시스템은 100만~600만 달러 범위에서 사용되며 대부분의 시스템은 약 200만 달러의 비용이 든다. 게다가, 이미지 획득 시간은 분 단위와 심지어 시간 단위로 확장되어 매우 길다. 이것은 장기간 마취된 동물들에게 부정적인 영향을 미칠 수 있다. 또한 micro-MRI는 전형적으로 피사체의 스냅샷을 적시에 캡처하기 때문에 혈류 및 기타 실시간 과정을 잘 연구할 수 없다. 최근 고강도 기능 마이크로-MRI의 발전에도 불구하고 최고 신호 강도에 도달하는 데 10~15초 정도의 지연 시간이 남아 있어 혈류 속도 정량화와 같은 중요한 정보에 접근하기 어렵다.[12]
암 연구: 마이크로-MRI는 두개골을 비침습적으로 관통하는 능력 때문에 종종 뇌를 이미지화하는 데 사용된다. 마이크로 MRI는 고해상도 때문에 초기 소형 종양도 검출할 수 있다. 항체 결합 파라자성 나노입자는 분해능을 높이고 시스템 내 분자표현을 시각화하는 데도 사용할 수 있다.[2]
뇌졸중 및 외상성 뇌손상 연구: Micro-MRI는 뇌졸중과 외상성 뇌손상 연구에서 해부학적 이미징에 종종 사용된다. 분자 영상촬영은 새로운 연구 영역이다.[13][14]
마이크로-CT
원리: 컴퓨터 단층 촬영(CT) 영상은 CT 스캐너 중앙에 위치한 테스트 피사체를 중심으로 회전하는 초점 방사선 선원에서 방출되는 X선을 통해 작동한다.[2] X선은 통과하고 있는 조직의 밀도에 따라 다른 속도로 감쇠한 다음 배출원에서 CT 스캐너의 반대쪽 끝에 있는 센서에 의해 픽업된다. 기존의 2D X선과는 대조적으로 CT 스캐너의 방출원이 동물 주위를 회전하기 때문에 일련의 2D 영상이 컴퓨터에 의해 3D 구조로 결합될 수 있다.
장점: Micro-CT는 뛰어난 공간 분해능을 가질 수 있어 조영제와 결합하면 최대 6µm까지 가능하다. 그러나 이 분해능을 달성하기 위해 필요한 방사선량은 작은 동물에게 치명적이며, 50µm의 공간 분해능은 마이크로-CT의 한계를 더 잘 나타낸다. 작은 동물도 분 단위로 할 수 있는 이미지 획득 시간 면에서도 괜찮은 편이다.[10] 또한, micro-CT는 골격 이미징에 탁월하다.
약점: 마이크로-CT의 주요 단점 중 하나는 실험동물에 대한 방사선 투약량이다. 일반적으로 치명적이지는 않지만, 방사선은 면역 체계와 다른 생물학적 경로에 영향을 미칠 정도로 높으며, 이는 궁극적으로 실험 결과를 바꿀 수 있다.[15] 또한 방사선은 방사선 치료를 모방하기 때문에 암 모델의 종양 크기에 영향을 미칠 수 있으며, 따라서 이러한 잠재적 교란 변수를 설명하기 위해 추가적인 대조군이 필요할 수 있다. 또한 마이크로-CT의 대조도 분해능이 상당히 불량하여 정상조직과 병든 조직 등 유사한 조직 유형을 구분하는데 부적합하다.
암 연구: Micro-CT는 앞에서 언급된 이점 때문에 동물 연구에서 해부학적 영상 시스템으로 가장 많이 사용된다. 조영제 또한 혈류를 연구하기 위해 주입될 수 있다. 그러나 요오드와 같은 마이크로-CT용 조영제는 분자 표적1과 결합하기 어려워 분자 영상 기법에는 거의 사용되지 않는다. 이와 같이, 마이크로-CT는 종종 연구에서 해부학 및 분자 이미징을 위한 마이크로-PET/SPECT와 결합된다.[16]
마이크로-PET
원리: 양전자 방출 단층촬영(PET)은 피험자 내에서 방출되는 고에너지 recording선을 기록함으로써 생활 시스템을 이미지화한다.[17] 방사선의 출처는 시험 대상에 주입되는 18F-FDG(fludeoxyglucose)와 같은 양전자 방출 결합 생물 분자에서 나온다. 방사성 동위원소가 붕괴하면서 그들은 체내에서 자연적으로 발견되는 전자로 섬멸하는 양전자를 방출한다. 이를 통해 약 180° 간격으로 2 ㎥의 광선이 생성되며, PET 기계 반대쪽 끝의 센서가 이를 포착한다. 이를 통해 개별 배출 이벤트를 체내에서 국부화시킬 수 있으며, 데이터 세트를 재구성하여 영상을 제작한다.
장점: 마이크로-PET의 강점은 방사선원이 동물 내에 있기 때문에 사실상 무제한의 영상 깊이를 갖는다는 것이다. 획득 시간도 상당히 빠르며, 보통 분 정도 된다. 조직마다 방사선방사선 분자 탐침의 흡수율이 다르기 때문에 마이크로-PET도 분자 디테일에 극도로 민감해 영상촬영에는 나노그램의 분자 탐침만 필요하다.[17]
약점: 마이크로-PET에 사용되는 방사성 동위원소는 반감기가 매우 짧다(18F-FDG의 경우 110분). 이러한 동위원소를 생성하기 위해서는 마이크로-PET 기계와 근접하게 방사화학 실험실의 사이클로트론이 필요하다. 또한 방사선은 방사선 치료를 모방하기 때문에 암 모델의 종양 크기에 영향을 미칠 수 있으며, 따라서 이러한 잠재적 교란 변수를 설명하기 위해 추가적인 대조군이 필요할 수 있다. 마이크로-PET도 1mm 안팎의 공간 분해능이 떨어져 어려움을 겪고 있다. 분자 영상뿐만 아니라 해부학적 영상까지 포함하는 원형을 잘 갖춘 연구를 하기 위해서는 마이크로-PET를 마이크로-MRI나 마이크로-CT와 연계하여 사용할 필요가 있으며, 이는 고비용과 전문화된 시설로 인해 많은 연구자에 대한 접근성을 더욱 떨어뜨린다.
암 연구: PET는 보통 임상 종양학에서 널리 사용되기 때문에 작은 동물 연구의 결과가 쉽게 번역된다. 18F-FDG가 조직에 의해 대사되는 방식 때문에 뇌종양이나 간종양과 같은 대부분의 암에서 강렬한 방사선을 방출하게 된다. 거의 모든 생물학적 화합물은 마이크로-PET에 의해 추적될 수 있는데, 그것이 방사성 동위원소로 결합될 수 있는 한, 그것은 새로운 경로를 연구하는 데 적합하게 만든다.
마이크로-SPECT
원리: PET와 마찬가지로 단일 광자 방출 컴퓨터 단층촬영(SPECT)도 피사체 내에서 방출되는 γ선을 통해 살아있는 시스템을 촬영한다. PET와 달리 SPECT(테크네튬-99m 등)에서 사용되는 방사성 동위원소는 양전자와 전자의 소멸 사건에서 벗어나 직접 γ선을 방출한다.[10] 그런 다음 이 광선은 피사체를 중심으로 회전한 γ-카메라에 의해 포착되고 이후 영상에 렌더링된다.
장점: 이 접근방식의 이점은 핵 동위원소가 마이크로-PET 동위원소에 비해 훨씬 더 쉽게 이용할 수 있고, 저렴하며, 반감기가 더 길다는 것이다. 마이크로-PET와 마찬가지로 마이크로-SPECT도 감도가 매우 뛰어나며 분자 탐침의 나노그램만 있으면 된다.[17] 더욱이, 다른 분자 표적에 결합된 다른 에너지 방사성 동위원소를 사용함으로써, 마이크로-SPET는 여러 분자 사건을 동시에 영상화할 수 있다는 점에서 마이크로-PET에 비해 이점이 있다. 동시에 마이크로-PET와는 달리 마이크로-SPECT는 핀홀 시준 원리를 탐구함으로써 매우 높은 공간 분해능에 도달할 수 있다(Beekman 등).[18] 이 접근방식에서 물체(예: 설치류)를 핀홀의 개구부에 가깝게 배치하면 검출기 표면에서 투영의 높은 확대에 도달할 수 있고 결정의 내적 분해능을 효과적으로 보상할 수 있다.
약점: Micro-SPECT는 여전히 상당한 방사선을 가지고 있어 작은 동물들의 생리학적, 면역학적 경로에 영향을 미칠 수 있다. 또한 방사선은 방사선 치료를 모방하기 때문에 암 모델의 종양 크기에 영향을 미칠 수 있으며, 따라서 이러한 잠재적 교란 변수를 설명하기 위해 추가적인 대조군이 필요할 수 있다. 마이크로SPECT는 또한 PET보다 민감도가 낮은 최대 2배까지 될 수 있다.[2] 또한 마이크로-SPECT 동위원소를 포함한 화합물에 라벨을 부착하려면 생화학적 또는 물리적 특성을 변경할 수 있는 킬레이트 어금니가 필요하다.
암 연구: Micro-SPECT는 종종 암 특정 리간드의 분자 영상을 위해 암 연구에 사용된다. 그것은 또한 침투력 때문에 뇌를 이미지화하는 데 사용될 수 있다. 새로운 방사성 동위원소는 99mTC 라벨 철산화물 나노입자와 같은 나노입자를 포함하기 때문에 향후 약물전달 시스템과 결합될 가능성이 있다.[16]
다음과 같은 작은 동물 SPECT 시스템은 서로 다른 그룹으로 개발되었으며 상업적으로 이용할 수 있다.
| 참조 | 브랜드 | 시스템 설명 | 회전 반지름(cm) | 분해능(mm) | 감도(cps/MBq) |
|---|---|---|---|---|---|
| 사제디 외, 2014,[19] | HiReSPECT[20] | 픽셀 처리된 CsI(Tl) 결정, LEHR 병렬 구멍 콜리메이터, 랫드 및 마우스 이미징 | 25 | 1.7 | 36 |
| 마고타 외, 2011,[21] | 인본 | NaI(Tl) 결정체, 0.5mm 단일 핀홀 콜리메이터 | 25 | 0.84 | 35.3 |
| 반 데어 하브 외, 2009년, 이바쉬첸코 외,[22] 2015년 | 유스펙트 II | 고정된 NaI(Tl) 결정 3개, 5개의 링에 75개의 핀홀, 멀티플렉싱 없음 | NA | 0.25 베스트 | 340(0.25mm) 13000 best |
| Del Guerra 외, 2007,[24] | X-SPECT | 두 개의 회전 NaI(Tl) 검출기, 여러 가지 조리개 | NA | 0.62 best | 855 |
복합 PET-MR
원칙: 소형 동물영상용 PET-MR 기술은 특히 극저온 MRI 시스템과 결합했을 때 고성능 영상기술에 큰 돌파구를 제공한다. PET-MR 시스템은 뛰어난 시각화, 정량화 및 번역 연구를 위한 우수한 연조직 대비와 분자 영상화 능력을 제공한다. PET-MR 사전임상 시스템은 동시 다형 영상촬영에 사용될 수 있다. 또한 극저온 자석 기술을 사용하면 인프라 요구 사항과 극저온 냉각제를 구하기 점점 더 어려워지는 가용성에 대한 의존도를 크게 줄일 수 있다.
장점: 연구자는 독립형 PET 또는 MRI 수술을 사용하거나 다모형 영상을 사용할 수 있다. PET와 MRI 기법은 (PET 또는 MRI 시스템을 독립형 장치로 사용) 독립적으로 수행하거나(MRI 시스템의 보어 앞에 클립온 PET로 사용), 또는 (MRI 자석에 PET를 삽입한 상태에서) 동시에 수행할 수 있다. 이것은 훨씬 더 정확한 그림을 더 빨리 제공한다. PET 시스템과 MRI 시스템을 동시에 작동함으로써 실험실 내의 작업흐름을 증가시킬 수 있다. MR솔루션의 MR-PET 시스템은 실리콘 포토멀티플라이어(SiPM)의 최신 기술을 접목해 시스템 크기를 대폭 줄이고 MRI 자기장 내에서 광전자 증배기나 기타 기존 검출기 유형을 사용하는 문제를 방지한다. SiPM의 성능 특성은 기존 PMT와 유사하지만 솔리드 스테이트 기술의 실용적 장점이 있다.
약점: 이것은 이미징 시스템의 조합이기 때문에 각 이미징 촬영장비와 관련된 약점들은 상대방에 의해 대부분 보상된다. 순차적 PET-MR에서는 운영자가 PET와 MR 획득 위치 사이에서 피사체를 이전할 수 있는 시간을 약간 허용할 필요가 있다. 이것은 동시에 PET-MR에서 부정된다. 그러나 순차적으로 PET-MR 시스템에서 PET 링 자체는 클립이나 오프, 독립적으로 사용할 수 있도록 방 사이를 이동하기 쉽다. 연구자는 서로 다른 두 시스템의 영상과 데이터를 해석할 수 있는 충분한 지식이 필요하며 이에 대한 훈련을 필요로 한다.
암 연구: MR과 PET 이미징의 조합은 한 번에 하나의 기법을 사용하는 것보다 훨씬 시간 효율적이다. 순차적 PET-MR 시스템에서는 촬영장비 사이의 시간 지연이 제한되며, 동시 시스템에서는 사실상 존재하지 않기 때문에 두 촬영장비에서 나온 영상도 훨씬 더 정확하게 등록할 수 있다. 이는 인수 사이에 주체가 총체적으로 움직일 기회가 거의 없다는 것을 의미한다.
복합 SPECT-MR
원칙: 소형동물영상용 신형 SPECT-MR은 멀티핀홀 기술을 기반으로 해 고해상도, 고감도 등이 가능하다. Cryogen-free MRI와 결합할 경우 결합된 SPECT-MR 기술은 연구소의 작업흐름을 획기적으로 증가시키는 동시에 실험실 인프라 요건 및 Cryogen 공급에 대한 취약성을 감소시킨다.[25]
장점: 연구 시설은 더 이상 여러 시스템을 구입할 필요가 없으며 다른 시스템 이미징 구성 중에서 선택할 수 있다. SPECT 또는 MRI 장비는 각각 벤치에서 독립형 장치로 사용할 수 있고, MRI 시스템에 SPECT 모듈을 클리핑하여 순차적으로 영상을 촬영할 수 있다. 그 동물은 같은 축을 따라 한 모달리티에서 다른 모달리티로 자동 번역된다. MRI 자석 내부에 SPECT 모듈을 삽입하면 SPECT와 MRI 데이터를 동시에 획득할 수 있다. 실험실의 작업흐름은 한 세션에서 동일한 피험자의 복수의 촬영양식을 획득하거나 SPECT와 MRI 시스템을 별도로 운용하여 서로 다른 피험자를 동시에 영상화함으로써 증가시킬 수 있다. SPECT-MR은 축간 간 시야가 서로 다른 다양한 구성으로 사용할 수 있어 마우스에서 랫드로 영상을 촬영할 수 있다.
약점: 이것은 이미징 시스템의 조합이기 때문에 하나 또는 다른 이미징 촬영장비와 관련된 약점은 더 이상 적용되지 않는다. 순차 SPECT-MR에서는 운영자가 SPECT와 MR 획득 위치 사이에서 피사체를 이전하는 데 약간의 시간을 허용할 필요가 있다. 이는 동시 SPECT-MR에서 부정되지만 순차 SPECT-MR의 경우 SPECT 모듈이 클립으로 고정되어 있을 때 클립이나 오프, 객실 간 이송이 용이하다. 연구자는 두 가지 다른 시스템 출력을 해석할 수 있는 충분한 지식을 가지고 있어야 하며, 이에 대한 교육이 필요할 것이다.
암 연구: 비침습 영상 기법으로 사용되는 MRI와 SPECT의 조합은 한 번에 한 기법을 사용하는 것에 비해 훨씬 빠른 결과를 제공한다. 순차적 SPECT-MR 시스템에서는 촬영장비 사이의 시간 지연이 제한되며, 동시 시스템에서는 사실상 존재하지 않기 때문에 두 촬영장비에서 나오는 영상도 훨씬 더 정확하게 등록할 수 있다. 이는 인수 사이에 주체가 총체적으로 움직일 기회가 거의 없다는 것을 의미한다. MRI와 SPECT 시스템 워크플로를 분리하여 독립적으로 작동하면 쉽게 늘릴 수 있다.
광학 영상화
- 형광 영상촬영은 외부 광원에 의해 흥분되고 반응에 따라 다른 파장의 빛을 발산하는 피사체 내부의 형광색소를 기반으로 작동한다. 전통적인 플루오로크롬은 GFP, RFP, 그리고 그들의 많은 돌연변이를 포함한다. 그러나 700nm 이하의 파장에서 조직의 자동 폐색 때문에 체내에는 상당한 난제가 나타난다. 이로 인해 근적외선염료와 적외선 형광 단백질(700nm–800nm)로 전환되었으며, 이는 조직의 자가투과율이 훨씬 낮으며 이러한 파장의 조직 침투 깊이로 인해 생체내 이미징에 훨씬 더 많은 가능성을 보였다.[26][27][28][29]
- 반면에 생물 발광 영상은 화학적 효소 반응에 의해 생성된 빛을 기반으로 한다. 형광과 생체 발광 영상 모두에서 광 신호는 -150 °C까지 냉각된 충전식 커플링 장치(CCD) 카메라에 포착돼 극도로 빛에 민감하다.[2] 더 많은 빛이 생성되는 이벤트에서는 덜 민감한 카메라나 심지어 육안으로도 영상을 시각화할 수 있다.
장점: 광학 이미징은 빠르고 수행이 용이하며, 다른 많은 영상 촬영 양식에 비해 상대적으로 저렴하다. 게다가 10-15M 범위에서 분자 사건을 감지할 수 있어 극도로 민감하다. 또한 생물 발광 영상촬영은 신고자의 흥분은 필요치 않고 오히려 촉매 반응 자체가 필요하기 때문에 생물학적/분자적 과정을 나타내며 배경 잡음이 거의 없다.[10]
약점: 광학 이미징의 주요 약점은 침투 깊이로, 눈에 보이는 염료의 경우 몇 밀리미터에 불과하다. 근적외선 형광은 수 센티미터의 깊이를 실현 가능하게 했다.[26][27] 적외선 부위의 빛이 침투 깊이가 가장 좋기 때문에, 수많은 형광색소가 이 부위에서 최적으로 흥분하도록 특별히 설계되었다.[28] 광학 이미징, 형광은 ~270nm의 빛의 회절에 한정된 분해능을 가지며, 생물 발광은 100µm의 MRI, 30µm의 마이크로초음파운드에 비해 획득 시간에 따라 분해능이 ~1~10mm이다.
암 연구: 침투 깊이가 약하기 때문에 광학 영상촬영은 일반적으로 해부학적 이미징이 아닌 분자 목적으로만 사용된다. 가시 파장의 침투 깊이가 낮아 피하모델 암에 사용되지만 근적외선 형광으로 인해 정형화된 모델이 가능해졌다.[30] 종종, 암에서의 특정 단백질 발현과 이러한 발현에 대한 약물 효과에 대한 연구는 유전공학적으로 설계된 발광 리포터 유전자로 체내 연구된다.[2] 이것은 또한 암과 그 이상에서 조직 선택적 유전자를 목표로 하는 메커니즘의 식별을 가능하게 한다.[31]
결합된 PET 광학 이미징, 형광 투시
원리: 디옥사보롤레인 화학은 항체나[32] 적혈구의 방사성 불소(18F) 표지를 가능하게 하여 [33]양전자 방출 단층촬영(PET)과 암과[34][35] 출혈의 형광 촬영이 각각 가능하다.[33] AHuman-Derived, 유전, Positron-emitting과 형광(HD-GPF)기자 시스템이다. 인간 단백질, PSMA과non-immunogenic, 그리고 이중 양식 PET과 게놈 수정된 세포의 형광 촬영, 예를 들어(붕소 18F를 묶었다)및 형광 positron-emitting 있는 작은 분자는 전체 쥐에 암, CRISPR/Cas9, 또는 CAR 위하여 T세포를 사용하고 있다.[34] 이러한 영상 양식의 조합은 2008년 노벨상 수상자인 로저 Y에 의해 예측되었다. Tsien, 단일 영상 기법의 약점을 보완하기 위해.[36]
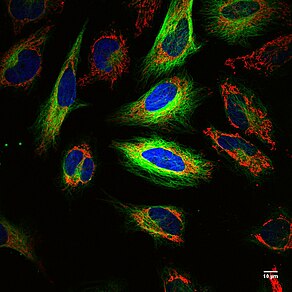
장점: PET와 광학 이미징, 형광의 장점을 결합한다. PET는 방사선과 F가 거의 무제한의 침투 깊이를 위해 동물이나 인간 내에 있기 때문에 전체 동물이나 인간에서 라벨이 표시된 세포의 위치를 위해 해부학적 이미징을 허용한다. 18F는 반감기가 110분이며 동물이나 인간에 대한 방사능 노출을 제한한다. 광학 이미징은 단세포의 영상화 및 세포막, 엔도솜, 세포질, 세포질 또는 핵의 세포 위치의 국소화를 허용하기 위해 ~270nm 이하의 세포 분해능 또는 빛의 회절 한계로 고해상도를 허용한다(다색체 Hela cellells의 FIgure 참조). 이 기술은 작은 분자,[34][37][38] 항체,[32] 세포(암과[32][34] 적혈구[33]), 뇌척수액,[39] 출혈,[33] 전립선암 제거,[34][40] 유전자 암호화 인간 단백질인 PSMA를 발현하는 게놈 편집 세포에 크리스퍼/Cas9 편집 및 CAR T-세포의 이미지를 표시할 수 있다.[34]
약점: PET와 광학 이미징을 결합하면 다른 사람의 약점을 보완하는 영상제 2개가 가능하다. 18F의 반감기는 110분이고 PET 신호는 영구적이지 않다. 형광성 작은 분자는 어두운 곳에 보관하고 광택이 나지 않을 때 영구적인 신호를 허용한다. 현재 PET 신호와 영상 형광을 세포 이하의 분해능으로 영상화할 수 있는 기기는 단 한 개도 없다(다색체 Hela cells 그림 참조). PET, 전체 장기 형광 및 단일 세포 형광을 세포 이하의 분해능으로 영상화하려면 여러 개의 기기가 필요하다.
참조
- ^ Kiessling F, Pichler BJ (2011). Small Animal Imaging: Basics and Practical Guide (1st ed.). Springer. ISBN 978-3-642-12944-5.
- ^ a b c d e f g Willmann JK, van Bruggen N, Dinkelborg LM, Gambhir SS (July 2008). "Molecular imaging in drug development". Nature Reviews. Drug Discovery. 7 (7): 591–607. doi:10.1038/nrd2290. PMID 18591980. S2CID 37571813.
- ^ "Pre-Clinical Imaging Market to Boost by Pharmaceutical & Biotechnological Companies". RnRMarketResearch.com.
- ^ '사전 임상 기술 발전 질병 이해 – MRI 장비의 발전은 실험실에서의 임상 전 연구의 품질과 범위를 증가시키고 있다.'
- ^ a b Foster FS, Mehi J, Lukacs M, Hirson D, White C, Chaggares C, Needles A (October 2009). "A new 15–50 MHz array-based micro-ultrasound scanner for preclinical imaging". Ultrasound in Medicine & Biology. 35 (10): 1700–8. doi:10.1016/j.ultrasmedbio.2009.04.012. PMID 19647922.
- ^ Wang X, Hagemeyer CE, Hohmann JD, Leitner E, Armstrong PC, Jia F, Olschewski M, Needles A, Peter K, Ahrens I (June 2012). "Novel single-chain antibody-targeted microbubbles for molecular ultrasound imaging of thrombosis: validation of a unique noninvasive method for rapid and sensitive detection of thrombi and monitoring of success or failure of thrombolysis in mice". Circulation. 125 (25): 3117–26. doi:10.1161/CIRCULATIONAHA.111.030312. PMID 22647975.
- ^ Deng CX, Sieling F, Pan H, Cui J (April 2004). "Ultrasound-induced cell membrane porosity". Ultrasound in Medicine & Biology. 30 (4): 519–26. doi:10.1016/j.ultrasmedbio.2004.01.005. PMID 15121254.
- ^ a b Li ML, Oh JT, Xie X, Ku G, Wang W, Li C, Lungu G, Stoica G, Wang LV (March 2008). "Simultaneous molecular and hypoxia imaging of brain tumors in vivo using spectroscopic photoacoustic tomography" (PDF). Proc IEEE. 96 (3): 481–9. doi:10.1109/JPROC.2007.913515. S2CID 1815688.
- ^ a b Wang X, Fowlkes JB, Carson PL (2008). "Experimental evaluation of a high-speed photoacoustic tomography system based on a commercial ultrasound unit". Proc IEEE Ultrasonics Symp: 1234–7. doi:10.1109/ULTSYM.2008.0298. ISBN 978-1-4244-2428-3. S2CID 42410198.
- ^ a b c d Koo V, Hamilton PW, Williamson K (2006). "Non-invasive in vivo imaging in small animal research". Cellular Oncology. 28 (4): 127–39. doi:10.1155/2006/245619. PMC 4617494. PMID 16988468.
- ^ '여보, 내가 자석을 줄였어: 7T 전 MRI는 냉동건조증이 없어'
- ^ van der Zwaag W, Francis S, Head K, Peters A, Gowland P, Morris P, Bowtell R (October 2009). "fMRI at 1.5, 3 and 7 T: characterising BOLD signal changes". NeuroImage. 47 (4): 1425–34. doi:10.1016/j.neuroimage.2009.05.015. PMID 19446641. S2CID 20246002.
- ^ Wang M, Hong X, Chang CF, Li Q, Ma B, Zhang H, et al. (July 2015). "Simultaneous detection and separation of hyperacute intracerebral hemorrhage and cerebral ischemia using amide proton transfer MRI". Magnetic Resonance in Medicine. 74 (1): 42–50. doi:10.1002/mrm.25690. PMC 4608848. PMID 25879165.
- ^ Wang W, Zhang H, Lee DH, Yu J, Cheng T, Hong M, Jiang S, Fan H, Huang X, Zhou J, Wang J (August 2017). "Using functional and molecular MRI techniques to detect neuroinflammation and neuroprotection after traumatic brain injury". Brain, Behavior, and Immunity. 64: 344–353. doi:10.1016/j.bbi.2017.04.019. PMC 5572149. PMID 28455264.
- ^ Boone JM, Velazquez O, Cherry SR (July 2004). "Small-animal X-ray dose from micro-CT". Molecular Imaging. 3 (3): 149–58. doi:10.1162/1535350042380326. PMID 15530250.
- ^ a b Schober O, Rahbar K, Riemann B (February 2009). "Multimodality molecular imaging—from target description to clinical studies". European Journal of Nuclear Medicine and Molecular Imaging. 36 (2): 302–14. doi:10.1007/s00259-008-1042-4. PMID 19130054. S2CID 25389532.
- ^ a b c Massoud TF, Gambhir SS (March 2003). "Molecular imaging in living subjects: seeing fundamental biological processes in a new light". Genes & Development. 17 (5): 545–80. doi:10.1101/gad.1047403. PMID 12629038.
- ^ Beekman F, van der Have F (February 2007). "The pinhole: gateway to ultra-high-resolution three-dimensional radionuclide imaging". European Journal of Nuclear Medicine and Molecular Imaging. 34 (2): 151–61. doi:10.1007/s00259-006-0248-6. PMID 17143647. S2CID 32330635.
- ^ Sajedi S, Zeraatkar N, Moji V, Farahani MH, Sarkar S, Arabi H, et al. (March 2014). "Design and development of a high resolution animal SPECT scanner dedicated for rat and mouse imaging". Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 741: 169–76. Bibcode:2014NIMPA.741..169S. doi:10.1016/j.nima.2014.01.001.
- ^ "Medical imaging systems". Design & Development of Medical Imaging Systems. Parto Negar Persia.
- ^ Magota K, Kubo N, Kuge Y, Nishijima K, Zhao S, Tamaki N (April 2011). "Performance characterization of the Inveon preclinical small-animal PET/SPECT/CT system for multimodality imaging". European Journal of Nuclear Medicine and Molecular Imaging. 38 (4): 742–52. doi:10.1007/s00259-010-1683-y. hdl:2115/48719. PMID 21153410. S2CID 19890309.
- ^ van der Have F, Vastenhouw B, Ramakers RM, Branderhorst W, Krah JO, Ji C, Staelens SG, Beekman FJ (April 2009). "U-SPECT-II: An Ultra-High-Resolution Device for Molecular Small-Animal Imaging". Journal of Nuclear Medicine. 50 (4): 599–605. doi:10.2967/jnumed.108.056606. PMID 19289425.
- ^ Ivashchenko O, van der Have F, Goorden MC, Ramakers RM, Beekman FJ (March 2015). "Ultra-high-sensitivity submillimeter mouse SPECT". Journal of Nuclear Medicine. 56 (3): 470–5. doi:10.2967/jnumed.114.147140. PMID 25678487.
- ^ Del Guerra A, Belcari N (December 2007). "State-of-the-art of PET, SPECT and CT for small animal imaging". Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 583 (1): 119–24. Bibcode:2007NIMPA.583..119D. doi:10.1016/j.nima.2007.08.187.
- ^ '확대 결과: 임상 전 기술 발전 질병 이해'
- ^ a b Weissleder R, Mahmood U (May 2001). "Molecular imaging". Radiology. 219 (2): 316–33. doi:10.1148/radiology.219.2.r01ma19316. PMID 11323453.
- ^ a b Kovar JL, Simpson MA, Schutz-Geschwender A, Olive DM (August 2007). "A systematic approach to the development of fluorescent contrast agents for optical imaging of mouse cancer models". Analytical Biochemistry. 367 (1): 1–12. doi:10.1016/j.ab.2007.04.011. PMID 17521598.
- ^ a b Adams KE, Ke S, Kwon S, Liang F, Fan Z, Lu Y, Hirschi K, Mawad ME, Barry MA, Sevick-Muraca EM (2007). "Comparison of visible and near-infrared wavelength-excitable fluorescent dyes for molecular imaging of cancer". Journal of Biomedical Optics. 12 (2): 024017. Bibcode:2007JBO....12b4017A. doi:10.1117/1.2717137. PMID 17477732.
- ^ Shu X, Royant A, Lin MZ, Aguilera TA, Lev-Ram V, Steinbach PA, Tsien RY (May 2009). "Mammalian expression of infrared fluorescent proteins engineered from a bacterial phytochrome". Science. 324 (5928): 804–7. Bibcode:2009Sci...324..804S. doi:10.1126/science.1168683. PMC 2763207. PMID 19423828.
- ^ Kovar JL, Johnson MA, Volcheck WM, Chen J, Simpson MA (October 2006). "Hyaluronidase expression induces prostate tumor metastasis in an orthotopic mouse model". The American Journal of Pathology. 169 (4): 1415–26. doi:10.2353/ajpath.2006.060324. PMC 1698854. PMID 17003496.
- ^ Nourse J, Tokalov S, Kohkhar S, Khan E, Schott LK, Hinz L, Eder L, Arnold-Schild D, Probst HC, Danckwardt S (2021). "Non-invasive imaging of gene expression and protein secretion dynamics in living mice". bioRxiv 10.1101/2021.07.08.451623.
- ^ a b c Rodriguez EA, Wang Y, Crisp JL, Vera DR, Tsien RY, Ting R (May 2016). "New Dioxaborolane Chemistry Enables [(18)F]-Positron-Emitting, Fluorescent [(18)F]-Multimodality Biomolecule Generation from the Solid Phase". Bioconjugate Chemistry. 27 (5): 1390–1399. doi:10.1021/acs.bioconjchem.6b00164. PMC 4916912. PMID 27064381.
- ^ a b c d Wang Y, An FF, Chan M, Friedman B, Rodriguez EA, Tsien RY, Aras O, Ting R (March 2017). "18F-positron-emitting/fluorescent labeled erythrocytes allow imaging of internal hemorrhage in a murine intracranial hemorrhage model". Journal of Cerebral Blood Flow and Metabolism. 37 (3): 776–786. doi:10.1177/0271678X16682510. PMC 5363488. PMID 28054494.
- ^ a b c d e f Guo H, Harikrishna K, Vedvyas Y, McCloskey JE, Zhang W, Chen N, Nurili F, Wu AP, Sayman HB, Akin O, Rodriguez EA, Aras O, Jin MM, Ting R (May 2019). "18F]-positron-emitting agent for imaging PMSA allows genetic reporting in adoptively-transferred, genetically-modified cells". ACS Chemical Biology. 14 (7): 1449–1459. doi:10.1021/acschembio.9b00160. PMC 6775626. PMID 31120734.
- ^ Kommidi H, Guo H, Nurili F, Vedvyas Y, Jin MM, McClure TD, et al. (May 2018). "18F-Positron Emitting/Trimethine Cyanine-Fluorescent Contrast for Image-Guided Prostate Cancer Management". Journal of Medicinal Chemistry. 61 (9): 4256–4262. doi:10.1021/acs.jmedchem.8b00240. PMC 6263152. PMID 29676909.
- ^ Tsien RY (September 2003). "Imagining imaging's future". Nature Reviews. Molecular Cell Biology. Suppl: SS16-21. PMID 14587522.
- ^ Kommidi H, Tosi U, Maachani UB, Guo H, Marnell CS, Law B, Souweidane MM, Ting R (February 2018). "18F-Radiolabeled Panobinostat Allows for Positron Emission Tomography Guided Delivery of a Histone Deacetylase Inhibitor". ACS Medicinal Chemistry Letters. 9 (2): 114–119. doi:10.1021/acsmedchemlett.7b00471. PMC 5807872. PMID 29456798.
- ^ Wang M, Kommidi H, Tosi U, Guo H, Zhou Z, Schweitzer ME, Wu LY, Singh R, Hou S, Law B, Ting R, Souweidane MM (December 2017). "18[F]-Positron Emitting, Fluorescent Derivative of Dasatinib". Molecular Cancer Therapeutics. 16 (12): 2902–2912. doi:10.1158/1535-7163.MCT-17-0423. PMC 6287766. PMID 28978723.
- ^ Kommidi H, Guo H, Chen N, Kim D, He B, Wu AP, Aras O, Ting R (2017). "18F]-Positron-Emitting, Fluorescent, Cerebrospinal Fluid Probe for Imaging Damage to the Brain and Spine". Theranostics. 7 (9): 2377–2391. doi:10.7150/thno.19408. PMC 5525743. PMID 28744321.
- ^ Kommidi H, Guo H, Nurili F, Vedvyas Y, Jin MM, McClure TD, Ehdaie B, Sayman HB, Akin O, Aras O, Ting R (May 2018). "18F-Positron Emitting/Trimethine Cyanine-Fluorescent Contrast for Image-Guided Prostate Cancer Management". Journal of Medicinal Chemistry. 61 (9): 4256–4262. doi:10.1021/acs.jmedchem.8b00240. PMC 6263152. PMID 29676909.