탄소-불소결합
Carbon–fluorine bond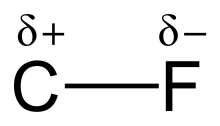
탄소-불소 결합은 탄소와 불소 사이의 극성 공유 결합으로 모든 유기 불소 화합물의 구성 요소입니다. B-F 단일 결합, Si-F 단일 결합, H-F 단일 결합 다음으로 화학에서 가장 강한 단일 결합 중 하나이며, 부분 이온 특성 때문에 상대적으로 짧습니다. 또한 화학 화합물의 동일한 탄소에 더 많은 불소가 첨가됨에 따라 결합이 강화되고 짧아집니다. 이와 같이, 테트라플루오로메탄(테트라플루오라이드 탄소)과 같은 플루오로알칸은 가장 반응성이 없는 유기 화합물 중 일부입니다.
전기음성도 및 결합강도
불소의 높은 전기음성도(불소의 경우 4.0 대 탄소의 경우 2.5)는 탄소-불소 결합에 상당한 극성 또는 쌍극자 모멘트를 제공합니다. 불소 주변에 전자 밀도가 집중되어 탄소가 상대적으로 전자 밀도가 떨어집니다. 이것은 부분 전하(C-Fδ+δ−)를 통해 결합에 이온성을 도입합니다. 불소와 탄소의 부분 전하가 매력적이어서 탄소-불소 결합의 특이한 결합 강도에 기여합니다. 이 결합은 불소가 탄소와 가장 강한 단일 [1]결합을 형성하기 때문에 "유기 화학에서 가장 강한 결합"이라고 표시됩니다. 탄소-불소 결합은 최대 130kcal/mol의 결합 해리 에너지(BDE)를 가질 수 있습니다.[2] C-F의 BDE(결합의 강도)는 다른 탄소-할로겐 및 탄소-수소 결합보다 높습니다. 예를 들어, CH-X 분자 내에서 C-X 결합의 BDE는 X = 불소, 수소, 염소, 브롬 및 요오드에 대해 각각 115, 104.9, 83.7, 72.1 및 57.6 kcal/mol입니다.
본드길이
탄소-불소 결합 길이는 일반적으로 약 1.35 Ångström(플루오로메탄에서 1.39 Å)입니다.[1] 다른 어떤 탄소-할로겐 결합보다 짧고, 단일 탄소-질소 및 탄소-산소 결합보다 짧습니다. 결합의 짧은 길이는 결합의 이온적 특성(탄소와 불소의 부분 전하 사이의 정전기적 인력)에 기인할 수도 있습니다. 탄소-불소 결합 길이는 탄소 원자의 혼성화와 탄소 또는 심지어 더 멀리 떨어진 원자에 다른 치환기가 존재하는지에 따라 수백 분의 1 옹스트롬의 차이가 있습니다. 이러한 변동은 미묘한 혼성화 변화와 스테레오 전자 상호 작용의 표시로 사용될 수 있습니다. 아래 표는 서로 다른 결합 환경에서 평균 결합 길이가 어떻게 변하는지를 보여줍니다(sp2 또는 방향족 탄소에 대해 달리 표시되지 않는 한 탄소 원자는 sp-hybridized3).
유대 평균결합길이(Å)[4] CCH2F, C2CHF 1.399 C3CF 1.428 C2CF2, H2CF2, CCHF2 1.349 CCF3 1.346 FCNO2 1.320 FCCF 1.371 Csp2F 1.340 CarF 1.363 FCarCarF 1.340
불소와 다른 원소 간의 결합에 대해서도 결합 길이의 변동성 및 부분 이온 특성에 의한 불소로의 결합 단축이 관찰되며, 불소의 공유 반경에 대한 적절한 값의 선택에 어려움을 초래해 왔습니다. Linus Pauling은 원래 64 pm을 제안했지만, 그 값은 결국 불소-불소 결합 길이의 절반인 72 pm으로 대체되었습니다. 그러나 72 pm은 불소와 다른 원소 사이의 결합 길이를 대표하기에는 너무 길기 때문에 다른 저자들에 의해 54 pm과 60 pm 사이의 값이 제안되었습니다.[5][6][7][8]
원색채의 결합강도 효과
같은 탄소에 불소 원자의 수가 증가함에 따라 다른 결합은 점점 더 강해지고 짧아집니다. 이는 아래 표와 같이 플루오로메탄 계열에 대한 결합 길이 및 강도(BDE)의 변화를 통해 확인할 수 있으며, 또한 계열 내에서 원자에 대한 부분 전하(qC 및F q)가 변화합니다.[2] 탄소의 부분 전하는 불소가 첨가됨에 따라 더 양이 되어 불소와 탄소 사이의 정전기적 상호작용과 이온 특성이 증가합니다.
컴파운드 C-F 본드 길이(Å) BDE (kcal/mol) qC qF CH3F 1.385 109.9 ± 1 0.01 −0.23 CH2F2 1.357 119.5 0.40 −0.23 CHF3 1.332 127.5 0.56 −0.21 CF4 1.319 130.5 ± 3 0.72 −0.18
가우슈 효과

2개의 불소 원자가 1,2-디플루오로에탄(HFCCFH22)에서와 같이 인접한 탄소에 있을 때, 가우슈 컨포머는 안티 컨포머보다 더 안정적입니다. 이는 일반적으로 예상되는 것과 대부분의 1,2-치환된 에탄에서 관찰되는 것과 반대입니다. 이 현상을 가우슈 효과라고 합니다.[9] 1,2-디플루오로에탄에서는 기체상에서 2.4~3.4 kJ/mole 정도의 항응고제보다 가슈 구조가 더 안정적입니다. 그러나 이 효과는 할로겐 플루오린에만 있는 것은 아닙니다. 1,2-디메톡시에탄에 대해서도 가체 효과가 관찰됩니다. 이와 관련된 효과는 알켄시스 효과입니다. 예를 들어, 1,2-디플루오로에틸렌의 시스 이성질체는 트랜스 이성질체보다 더 안정적입니다.[10]
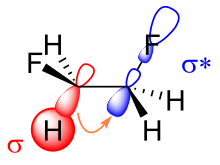
가슈 효과에 대한 설명은 크게 두 가지, 즉 초접합과 구부러진 결합입니다. 과접합 모델에서 탄소-수소 σ 결합 오비탈에서 탄소-불소 σ 결합 오비탈로의 전자 밀도의 공여는 가우슈 이성질체의 안정화의 원천으로 간주됩니다. 불소의 전기음성도가 더 크기 때문에 탄소-수소 σ 오비탈은 탄소-불소 σ 오비탈보다 더 나은 전자 공여체인 반면, 탄소-불소 σ 오비탈은 탄소-수소 σ 오비탈보다 더 나은 전자 수용체입니다. 오직 가체 형태만이 더 나은 기증자와 더 나은 수용체 사이에 좋은 겹침을 허용합니다.[11]
디플루오로에탄에서의 가슈 효과에 대한 굽은 결합 설명의 핵심은 불소의 큰 전기 음성도로 인해 탄소-불소 결합 모두의 증가된 p 오비탈 특성입니다. 그 결과 전자 밀도가 중앙의 탄소-탄소 결합의 좌우 양쪽에 쌓이게 됩니다. 결과적으로 감소된 궤도 중첩은 가슈 형태를 가정할 때 부분적으로 보상되어 구부러진 결합을 형성할 수 있습니다. 이 두 가지 모델 중에서, 과접합은 일반적으로 디플루오로에탄의 가슈 효과 뒤에 있는 주요 원인으로 간주됩니다.[1][12]
분광학
탄소-불소 결합 신장은 적외선 스펙트럼에서 1000~1360cm−1 사이에 나타납니다. 넓은 범위는 분자의 다른 치환기에 대한 신장 주파수의 민감성 때문입니다. 모노플루오르화 화합물은 1000cm에서 1110cm−1 사이의 강한 밴드를 가지며, 불소 원자가 1개 이상인 밴드는 대칭 모드용 밴드와 비대칭 모드용 밴드로 분리됩니다.[13] 탄소-불소 밴드는 너무 강해서 존재할 수 있는 탄소-수소 밴드를 가릴 수 있습니다.[14]
유기 플루오르 화합물은 또한 NMR 분광법을 사용하여 탄소-13, 불소-19(유일한 천연 플루오르 동위 원소) 또는 수소-1(존재하는 경우)을 사용하여 특성화할 수 있습니다. FNMR의 화학적 이동은 치환 정도와 작용기에 따라 매우 넓은 범위에서 나타납니다. 아래 표는 일부 전공수업의 범위를 나타낸 것입니다.[15]
화합물의 종류 깔끔한 CFCl에3 대한 화학적 이동 범위(ppm) F–C=O -70 ~ -20 CF3 +40 ~ +80 CF2 +80 ~ +140 CF +140 ~ +250 ArF +80 ~ +170
C-F 결합 깨짐
C-F 결합을 깨는 것은 PFOA와 과불화화합물(PFCs)과 같은 유기불소 "영원한 화학물질"을 분해하고 파괴하는 방법으로 관심을 끌고 있습니다. 후보 방법으로는 백금 원자와 같은 촉매;[16] 광촉매; UV, 요오드화물 및 아황산염,[17] 라디칼 등이 있습니다.
참고 항목
참고문헌
- ^ a b c O'Hagan D (February 2008). "Understanding organofluorine chemistry. An introduction to the C–F bond". Chem Soc Rev. 37 (2): 308–19. doi:10.1039/b711844a. PMID 18197347.
- ^ a b Lemal, David M (2004). "Perspective on Fluorocarbon Chemistry". J Org Chem. 69 (1): 1–11. doi:10.1021/jo0302556. PMID 14703372.
- ^ Blanksby SJ, Ellison GB (April 2003). "Bond dissociation energies of organic molecules". Acc. Chem. Res. 36 (4): 255–63. CiteSeerX 10.1.1.616.3043. doi:10.1021/ar020230d. PMID 12693923.
- ^ F. H. Allen, O. Kennard, D. G. Watson, L. Brammer, A. G. Orpen. X선 및 중성자 회절에 의해 결정된 결합 길이 표. 1부. 유기 화합물에서의 결합 길이. J. 켐. Soc. Perkin Trans. II 1987, S1–S19.
- ^ Gillespie Ronald; Robinson Edward (1992). "Bond Lengths in Covalent Fluorides. A New Value for the Covalent Radius of Fluorine". Inorganic Chemistry. 31 (10): 1960–1963. doi:10.1021/ic00036a045.
- ^ Robinson Edward; Johnson Samuel; Tang Ting-Hua; Gillespie Ronald (1997). "Reinterpretation of the Lengths of Bonds to Fluorine in Terms of an Almost Ionic Model". Inorganic Chemistry. 36 (14): 3022–3030. doi:10.1021/ic961315b. PMID 11669953.
- ^ Cordero Beatriz; Gómez Verónica; Platero-Prats Ana E; Revés Marc; Echeverría Jorge; Cremades Eduard; Barragán Flavia; Alvarez Santiago (2008). "Covalent radii revisited". Dalton Trans. 2008 (21): 2832–2838. doi:10.1039/b801115j. PMID 18478144. S2CID 244110.
- ^ Pyykkö P.; Atsumi M. (2009). "Molecular Single-Bond Covalent Radii for Elements 1-118". Chemistry: A European Journal. 15 (1): 186–197. doi:10.1002/chem.200800987. PMID 19058281.
- ^ Craig, Norman C.; Chen, Anthony; Suh, Ki Hwan; Klee, Stefan; Mellau, Georg C.; Winnewisser, Brenda P.; Winnewisser, Manfred (1997). "Contribution to the Study of the Gauche Effect. The Complete Structure of the Anti Rotamer of 1,2-Difluoroethane". J. Am. Chem. Soc. 119 (20): 4789–4790. doi:10.1021/ja963819e.
- ^ Bingham, Richard C. (1976). "The stereochemical consequences of electron delocalization in extended .pi. systems. An interpretation of the cis effect exhibited by 1,2-disubstituted ethylenes and related phenomena". J. Am. Chem. Soc. 98 (2): 535–540. doi:10.1021/ja00418a036.
- ^ Alabugin, IV 스테레오일렉트로닉 효과: 구조와 반응성 사이의 다리 John Wiley & Sons Ltd, Chichster, 2016
- ^ Goodman, L.; Gu, H.; Pophristic, V (2005). "Gauche Effect in 1,2-Difluoroethane. Hyperconjugation, Bent Bonds, Steric Repulsion". J. Phys. Chem. A. 109 (6): 1223–1229. Bibcode:2005JPCA..109.1223G. doi:10.1021/jp046290d. PMID 16833433.
- ^ George Socrates; Socrates (2001). Infrared and Raman characteristic group frequencies: tables and charts. John Wiley and Sons. p. 198. ISBN 978-0-470-09307-8.
- ^ Barbara H. Stuart (2004). Infrared Spectroscopy: Fundamentals and Applications. John Wiley and Sons. p. 82. ISBN 978-0-470-85428-0.
- ^ "19F Chemical Shifts and Coupling Constants". April 2, 1998. Archived from the original on 2010-06-25. Retrieved 2008-11-09.
- ^ "Single atoms break carbon's strongest bond". ScienceDaily.
- ^ "Just 3 ingredients can quickly destroy widely used PFAS 'forever chemicals'". Science News. 3 June 2022.


