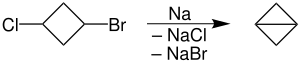바이클로부탄
Bicyclobutane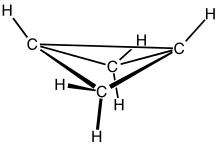 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 자전거[1.1.0]부탄 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
펍켐 CID | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C4H6 | |
| 어금질량 | 54.092 g·192−1 |
| 외관 | 무색 기체 |
| 비등점 | 8.3 ± 0.2 °C |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
자전거클로부탄은 CH라는46 공식을 가진 유기 화합물이다. 시스 퓨즈 사이클로프로판 고리 2개로 구성된 자전거 분자로 무색하고 쉽게 응축되는 기체다.[1] 자전거클로부탄은 대규모로 분리 가능한 가장 변형된 화합물 중 하나로 알려져 있다. 자전거의 변형 에너지는 63.9 kcal mol로−1 추정된다. 그것은 비 평면 분자로, 두 사이클로프로판 고리 사이에 123°[2]의 다이헤드 각도를 가지고 있다.
가장 먼저 보고된 바이클로부탄은 카복시틸 파생상품인 CHCOEt로452, 해당 브로모시클로부타네카르복실산 에스테르와 하이드라이드 나트륨을 함유한 탈수소화에 의해 준비되었다.[2] 모탄화수소는 브로모시클로부타네카르복실산 에스테르 변환에 의해 1브로모-3-클로로시클로부탄으로부터 준비되었고,[1] 녹은 나트륨을 이용한 분자내 우르츠 결합이 그 뒤를 이었다.[3] 중간 1-브로모-3-클로로시클로부탄은 또한 수은 산화물 및 브롬인을 사용한 3-클로로시클로부타네카르복실산으로부터의 변형된 훈스디커 반응을 통해 준비될 수 있다.[4]
자전거로부탄 유도체에 대한 합성 접근법은 THF에서 마그네슘으로 적절히 대체된 2-브로모-1-(클로로메틸)사이클로프로판의 링을 폐쇄하는 것을 포함한다.[5]
스테레오 화학적 증거는 바이클로부탄이 열분해를 거쳐 결합된 순환 순환 메커니즘(사이클로 엘리미네이션, [ [2s+σ2a])[6]을 통해 41kcal mol의−1 활성화 에너지를 지닌 1,3-부타디엔을 형성한다는 것을 나타낸다.
생물합성
여러 연구 그룹이 살아있는 세포의 효소를 이용하여 자전거로부탄 함유 분자를 합성하는 데 성공했다고 보고했다. 한 그룹은 리놀렌산이 시아노박테리움 아나베나 sp.(스트레인 PCC 7120)의 변종에 의해 생성된 단백질을 통해 리놀렌산이 사이클로부탄 지방산으로 변질되었다고 보고했다.[7] 다른 그룹은 인공 헴 단백질을 대장균으로 표현하고 대체 자전거클로부탄 유도체의 생합성률과 수율을 증가시키도록 성공적으로 최적화하는 방향 진화 접근법을 보고했다.[8]
참고 항목
- 프로팔렌 (비시클로부타디엔)
- 바이클로펜탄
- 1.1.1-프로펠레인
참조
- ^ a b Wiberg, K. B.; Lampman, G. M.; Ciula, R. P.; Connor, D. S.; Schertler, P.; Lavanish, J. (1965). "Bicyclo[1.1.0]butane". Tetrahedron. 21 (10): 2749–2769. doi:10.1016/S0040-4020(01)98361-9.
- ^ a b Wiberg, K. B. (1968). "Small Ring Bicyclo[n.m.0]alkanes". In Hart, H.; Karabatsos, G. J. (eds.). Advances in Alicyclic Chemistry. Vol. 2. Academic Press. pp. 185–254. ISBN 9781483224213.
- ^ Lampman, Gary M.; Aumiller, James C. (1971). "Bicyclo[1.1.0]butane". Org. Synth. 51: 55. doi:10.15227/orgsyn.051.0055.; Coll. Vol., vol. 6, p. 133
- ^ Lampman, Gary M.; Aumiller, James C. (1971). "Mercury(II) oxide-modified Hunsdiecker reaction: 1-Bromo-3-chlorocyclobutane". Org. Synth. 51: 106. doi:10.15227/orgsyn.051.0106.; Coll. Vol., vol. 6, p. 179
- ^ D'yachenko, A. I.; Abramova, N. M.; Zotova, S. V.; Nesmeyanova, O. A.; Bragin, O. V. (1985). "New synthesis of bicyclo[1.1.0]butane hydrocarbons". Bulletin of the Academy of Sciences of the USSR. 34 (9): 1885–1889. doi:10.1007/BF00953929. S2CID 96988412.
- ^ Woodward, Robert B.; Hoffmann, Roald (1969). "The Conservation of Orbital Symmetry". Angewandte Chemie International Edition. 8 (11): 781–853. doi:10.1002/anie.196907811.
- ^ Schneider, Claus; Niisuke, Katrin; Boeglin, William E.; Voehler, Markus; Stec, Donald F.; Porter, Ned A.; Brash, Alan R. (2007-11-27). "Enzymatic synthesis of a bicyclobutane fatty acid by a hemoprotein lipoxygenase fusion protein from the cyanobacterium Anabaena PCC 7120". Proceedings of the National Academy of Sciences of the United States of America. 104 (48): 18941–18945. Bibcode:2007PNAS..10418941S. doi:10.1073/pnas.0707148104. ISSN 1091-6490. PMC 2141887. PMID 18025466.
- ^ Chen, Kai; Huang, Xiongyi; Kan, S. B. Jennifer; Zhang, Ruijie K.; Arnold, Frances H. (6 April 2018). "Enzymatic construction of highly strained carbocycles". Science. 360 (6384): 71–75. Bibcode:2018Sci...360...71C. doi:10.1126/science.aar4239. ISSN 1095-9203. PMC 6104391. PMID 29622650.