나무제비
Tree swallow| 나무제비 | |
|---|---|
 | |
| 뉴욕 퀸즈 자메이카 베이 야생동물 보호구역의 성인 | |
| 과학적 분류 | |
| 킹덤: | 애니멀리아 |
| 망울: | 코다타 |
| 클래스: | 아베스 |
| 순서: | 행인목 |
| 패밀리: | 히룬디누스과 |
| 속: | 타치시네타 |
| 종: | T. 바이콜러 |
| 이항식 이름 | |
| 타치시네타 바이콜러 (빌롯, 1808) | |
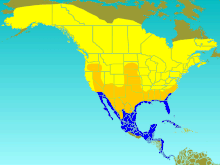 | |
| T. 바이콜러 범위 번식 여름 방문자 이주 방문자 겨울 방문자 | |
| 동의어 | |
| 히룬도 바이콜러 비에일로1808번길 | |
제비(Tachycineta bicolor)는 히룬디네과(Hirundinae)과의 철새다.아메리카 대륙에서 발견된 이 나무 제비는 1807년 프랑스의 조류학자 루이 비요트에 의해 히룬도 바이콜로르로 처음 묘사되었다.그 후 그것은 현재의 속인 타치시네타로 옮겨졌고, 그 안에서 계통생성학적 배치가 논의되고 있다.나무 제비는 검게 그을린 날개와 꼬리를 제외하고 광택이 나는 청록색, 그리고 흰색을 가지고 있다.지폐는 검은색, 눈은 짙은 갈색, 다리와 발은 옅은 갈색이다.암컷은 일반적으로 수컷보다 더 둔하고, 1학년 암컷은 대부분 갈색 윗부분을 가지고 있으며, 약간의 푸른 깃털을 가지고 있다.청소년들은 갈색 윗부분과 회색갈색의 가슴 부분이 있다.나무 제비는 미국과 캐나다에서 번식한다.겨울은 미국 남부 해안 남쪽, 걸프 해안을 따라 파나마와 남아메리카의 북서 해안, 그리고 서인도 제도에서 겨울을 난다.
나무는 분리된 쌍으로 둥지를 삼켜 버리거나 느슨한 그룹으로, 자연적 충치와 인공적 충치 둘 다에 둥지를 삼킨다.기후 변화로 인해 이 날짜가 앞당겨지고 있지만 번식은 빠르면 5월 초에 시작될 수 있고, 7월 늦게 끝날 수 있다.이 새는 일반적으로 사회적으로 일부일처제(남성의 약 8%가 다처제지만)이며, 외조부(外祖父)의 수치가 높다.이것은 남성에게 이득이 될 수 있지만, 여성이 결합을 통제하기 때문에, 이러한 행동이 여성들에게 어떤 혜택을 주는지에 대한 해결책이 부족하기 때문에, 높은 수준의 과도한 육아 퍼즐을 만들고 있다.암컷은 약 14~15일 동안 순백색 달걀 2개에서 8개(그러나 보통 4~7개)의 클러치를 배양한다.병아리는 약간 비동기적으로 부화하여, 암컷이 식량 부족 시 어떤 병아리를 먹일 것인지 우선순위를 정할 수 있게 한다.그들은 일반적으로 부화 후 약 18일에서 22일 후에 싹이 튼다.나무 제비는 많은 양의 연구가 이루어졌기 때문에 때때로 모범적인 유기체로 여겨지기도 한다.
공중제비인 나무는 연체동물, 거미, 과일 외에 대부분 곤충을 먹으며 혼자 그리고 무리를 지어 먹이를 찾는다.그 둥지들은 어른과 마찬가지로 주로 양성이 먹이를 주는 곤충을 먹는다.이 제비는 기생충에 취약하지만, 둥지에 있을 때는 거의 피해를 주지 않는다.나무 제비가 늙어갈수록 질병의 효과는 더욱 강해질 수 있는데, 나이가 들수록 면역체계의 일부가 쇠퇴하기 때문이다.예를 들어, 후천성 T세포 매개 면역은 나이가 들수록 감소하는 반면 선천성 및 후천성 후천성 후천성 면역은 감소하지 않는다.이 제비는 사거리가 넓고 개체수가 안정되어 있어 국제자연보전연맹의 최소한의 관심사로 여겨진다.미국은 1918년 철새조약법으로, 캐나다는 철새협약법으로 보호받고 있다.이 제비는 숲의 개간과 같은 인간의 활동에 부정적인 영향을 받는다; 산성화된 호수는 새끼들에게 먹일 칼슘이 풍부한 음식을 찾기 위해 번식 나무 제비에게 먼 거리를 가도록 강요할 수 있다.
분류법과 어원
이 나무 제비는 1807년에 출판된 그의 히스토아르 자연에서 루이스 피에르 비에요트에 의해 히룬도 바이콜로로 묘사되었다.[2]이후 1850년 장 카바니스가 설립하면서 현재의 타치시네타 속주에 놓였다.[3]1878년 엘리엇 쿠에스는 제비에게 최소한 제비에게 흰날개제비, 칠레산 제비, 흰줄벌 제비, 망그로브 제비와 함께 그 깃털을 기초로 하여 자신의 하위 유전자인 이리도프로센에 넣으라고 제안했다.[4]1882년까지, 그는 이것을 완전한 속주로 업그레이드했다.[5]일부 저자들은 텀블스 제비가 추가되면서 이 분류를 계속 사용했지만, 유전적 증거는 타치시네타라는 단일 속종의 존재를 뒷받침하고 있다.[6]나무 제비는 흰 밑부분으로 흰배 제비라고도 불린다.[7]
일반적으로 통용되는 속명은 고대 그리스 타키키네토스(takhykinetos)에서 유래한 것으로, "빨리 움직인다"는 뜻이며, 특정 바이콜로는 라틴어로 "두 가지 색깔"[8]을 의미한다.다른 속 이름인 이리도프로센은 무지개를 뜻하는 그리스 홍채와 제비로 변한 것으로 추정되는 프로크네에서 유래했다.[5]
나무 제비가 타치시네타의 다른 구성원들과 얼마나 정확히 관련이 있는지는 아직 밝혀지지 않았다.미토콘드리아 DNA에 기반한 연구에서, 그것은 보랏빛 녹색 제비, 황금 제비, 바하마 제비로 구성된 북미 카리브 해의 쇄골 안에 기초(종목에서 첫 번째 발사라는 의미)를 두었다.[9][10]미토콘드리아 DNA는 빠르게 진화하기 때문에 진화적 변화의 더 나은 지표로 주창되지만, 이를 바탕으로 한 분석은 산모에게서만 유전되기 때문에 전체 집단의 기형성을 나타내는 복수의 로키에서 나온 핵 DNA보다 더 악화되기 때문에 어려움을 겪을 수 있다.[11]그러한 핵 DNA에 기초한 연구는 타치시네타 전체에서 나무 제비를 가장 기초적인 위치에 놓았다(다른 속과의 자매 집단으로서).[12]
설명
나무 제비는 길이가 약 12-14cm(4.7- 5.5인치)이고 무게는 약 17-25.5g(0.60-0.90온스)이다.날개 폭은 11.8인치에서 13.8인치(30-35cm)이다.[13]수컷은 대부분 광택이 나는 청록색을 가지고 있고, 날개와 꼬리는 검게 그을려 있다.겉옷은 회갈색이지만,[7] 안감과 볼 패치는 흰색이다.[14]지폐는 검은색, 눈은 짙은 갈색, 다리와 발은 옅은 갈색이다.[7]암컷은 수컷보다 색깔이 더 둔하고, 때로는 갈색 이마를 가지고 있다.[14]2학년[note 1] 암컷은 갈색 윗부분을 가지고 있고, 파란 깃털의 수가 가변적이다; 3학년 암컷은 또한 이 아성체 깃털의 일부를 가지고 있다.[15]1987년 연구에 따르면, 이것은 어린 암컷이 둥지 탐험을 할 수 있게 하는데, 이것은 거주하고 있는 수컷이 보통 성인 암컷에게 덜 공격적이기 때문이다.[16]2013년 한 연구에서는 거주하고 있는 여성이 2학년 여성 모델과 나이 든 모델들을 구분해 발표했을 때 덜 공격적인 것으로 나타났다.왜 암컷이 수컷의 깃털을 대체하는지는 알려지지 않았다; 그것은 수컷이 깃털의 밝기를 기준으로 짝짓기를 하기 때문에 암컷의 질을 평가하게 할 수 있다.[17]제비는 갈색 윗부분과 회색 갈색의 가슴으로 구별할 수 있다.[14]
음성
나무 제비의 노래는 세 부분으로 구성되어 있다: 지저귀는 소리, 우는 소리, 웅웅거리는 소리.이 구간은 반복되거나 생략될 수 있으며, 모두 단독으로 서 있을 수 있다.첫 번째, 짹짹거리는 울음소리(때로는 연락소리와 간청소음으로 나뉜다)는 것은 암컷이 교미할[18] 때, 그리고 남녀 모두 짝짓기를 할 때 둥지를 자극하여 구걸하게[19] 하거나, (일부 집단에서는) 짝짓기를 하거나 다음 충치에 들어갈 때 (일부 집단에서는) 하는 것이다.일반적으로 빈도수의 하향 이동과 상향 이동으로 구성되는 징징대는, 때때로 특정한 포식자에 대한 반응으로 이루어지는 불안의 호출로 혼자 주어질 수 있다.[18][20]구르륵은 노래 끝에 나타날 때와 같이 보통 두 번 내뱉는다.그것은 아마도 짝을 이루는 것과 관련이 있을 것이다.수다 전화는 둥지 사이트를 광고하는 데 사용되며("둥지 사이트 광고 전화"라고도 알려져 있다) 침입하는 동의어에게도 주어진다.짧은 고음의 복종 전화는 다른 나무 제비와 공격적으로 만난 후 때때로 내뱉는다.신체적으로 절제되거나 고통스러운 동안, 조난 전화를 받을 수 있다.수컷은 짝짓기 도중 똑딱거리는(혹은 난폭한) 공격성 호출을 자주 내뱉고, 남녀 모두 폭도 다이빙 끝에 이를 사용한다.이 경보음은 포식자와 다른 침입자에 대한 반응으로 주어지며,[18] 나이든 둥지 새끼들이 포식자가 근처에 있을 때 웅크리고 구걸을 멈추도록 유도하는 역할을 할 수 있다.[21]
부모와 자손 사이의 의사소통은 인간이 발생시키는 소음으로 인해 중단될 수 있다.예를 들어, 2014년의 한 연구는 백색 소음을 연주한 새끼들이 경보음에 응답하여 웅크리거나 구걸하는 것을 멈출 가능성이 낮다는 것을 발견했다.부모들은 보상 요구를 변경하지 않았고, 포식 위험이 증가할 가능성이 있다.[22]소음은 또한 부모들이 구걸에 응답하는지를 방해할 수 있지만, 이것은 둥지가 구걸에 노출되었을 때 더 큰 소리로 들려주는 전화에 의해 균형을 이룰 수 있다.그러나 구걸 노력의 증가는 더 큰 수준의 소음에 효과적이지 않거나 비용이 많이 들 수 있다.[23]
분포 및 서식지
제비는 북아메리카에서 번식한다.그것의 범위는 알래스카 북부와 캐나다의 나무 선까지 뻗어 있다.그것은 산맥의 동쪽에 있는 테네시 주, 서쪽에 있는 캘리포니아와 뉴멕시코 주, 그리고 중앙에 있는 캔자스 주까지 남쪽으로 발견된다.그것은 때때로 미국에서 더 남쪽으로 번식하고,[7] 부랑자들은 때때로 북극권, 북태평양, 그린란드, 유럽에서 발견된다.[14]윈터링 산맥은 걸프만 연안을 따라 서부의 캘리포니아와 남서부의 애리조나 주와 동부의 버지니아 주 남동부에서 서인도 제도, 파나마, 서북부의 남미 연안에 이르기까지이다.[7]이 제비는 이동 중에 종종 경유지를 이용하는데, 가을 동안 이 지역에서 평균 57일을 보낸다.겨울왕국까지 가기 위해, 그것은 종종 세 개의 플라이웨이 중 하나를 이용한다: 로키 산맥의 서쪽인 서부 플라이웨이, 로키 산맥과 그레이트 호수 사이의 중앙 플라이웨이, 그리고 동부 멕시코로 남쪽으로 뻗어 있는 동부 플라이웨이.[24]제비가 둥지로 돌아왔을 때, 제비는 보통 번식지를 바꾸지 않는다.[25]
이 새의 번식 서식지는 주로 개방되고 나무가 우거진 지역, 특히 물 근처에 있다.[7]비육종철에는 매일 밤 보금자리를 맴돌며, 물보다 지팡이나 갈대밭에서 쉬는 것을 선호하지만, 육지와 나무와 전선에서도 발견된다.로스팅 사이트는 일반적으로 100~150km(62~93mi) 떨어져 있다.[26]
행동
제비꽃에 대한 많은 연구와 어떻게 제비꽃이 둥지 박스에서 기꺼이 번식하는지 때문에 생물학자인 제이슨 존스는 제비꽃을 모범생물로 여겨야 한다고 권고했다.[27]번식기에는 공격적이지만, 이 제비는 밖에서 사교적이어서 때로는 수천 마리의 새를 낳기도 한다.[7]
사육
나무는 자연과 인공 둘 다, 이미 존재하는 구멍이 있는 구조물에 둥지를 삼킨다.이것들은 한때 숲이 우거진 지역에서만 발견되었지만, 둥지 상자를 짓는 것으로 이 새가 개방된 서식지로 확장될 수 있게 되었다.[7]이 제비는 보통 작년에 번식한 지역에 둥지를 튼다; 암컷의 14%와 수컷의 4%만이 매년 새로운 장소에서 번식하기 위해 흩어진다.대부분은 멀리 가지 않으며, 대개 원래 땅에서 10킬로미터(6.2 mi) 미만의 지역에서 번식한다.산란기는 번식 성공에 영향을 받는다; 병아리를 낳지 못한 성인 암컷의 경우, 성공적인 사육자의 5%에 비해 약 28%가 산란한다.[25]나탈 분산(새 한 마리가 번식하기 위해 태어난 곳으로 돌아가지 않을 때)은 나무 제비에서 흔하며 번식보다 더 자주 발생한다.[28]그것은 느슨한 집단과 고립된 쌍으로 둥지를 튼다.느슨한 그룹으로 둥지를 틀 때 둥지는 보통 최소 10~15m(33~49ft)의 간격을 두고 있고,[14] 거리가 더 가까운 둥지는 보통 안치 날짜 면에서 더 멀리 떨어져 있다.[29]천연 충치에서, 그 나무는 이웃과 약 27미터 떨어진 곳에 둥지를 튼다.이러한 상황에서 둥지 구멍은 평균적으로 지상 3.4m(11ft) 위에 있지만, 약 45%는 지상 2m(6.6ft) 미만이다.충치가 높으면 포식성이 감소하기 때문에 선호될 가능성이 높은 반면, 낮은 구멍은 경쟁을 피하기 위해 선택될 수 있다.입구 폭은 종종 4에서 5 센티미터(1.6에서 2.0인치) 사이인 반면, 입구 높이는 더 가변적이다. 1989년의 한 연구에서 3.5에서 26 센티미터(1.4에서 10.2인치) 사이의 개구부가 발견되었다.공동 부피는 일반적으로 1,000 입방 센티미터(61 cu in) 미만이다.[30]수컷은 둥지를 틀 만한 적당한 장소를 찾은 뒤 그 근처에 움푹 패여 자주 부른다.부지가 부족하면 새들 간에 싸움이 일어나기도 하고, 때로는 죽음을 초래하기도 한다.이 제비는 보통 약 4.6미터의 반지름으로 둥지 주변 지역을 방어하고,[14] [7]둥지로 들어가는 입구를 막고 침입자를 쫓아서 둥지 안의 여분의 둥지를 방어한다.[7]둥지컵 자체는 주로 암컷이 채집한 풀, 이끼, 솔잎, 수생식물로 만들어졌으며,[14] 싸움에서 수컷이 주로 채집한 깃털이 줄지어 있다.[31]깃털은 둥지를 단열하는 기능을 할 수 있으며, 잠복 시간을[32] 줄이고 병아리의 저체온증을 예방할 가능성이 있다.알은 병아리의 성장이 빠를 뿐만 아니라 깃털이 있는 둥지에서 무연고보다 더 느리게 식는다.[31][33]그러나 2018년 발표된 연구에서는 인공적으로 따뜻해진 둥지의 깃털 수와 그렇지 않은 깃털의 수가 유의미한 상관관계를 발견하지 못했다.게다가, 그것은 세인트루이스에 둥지가 있다는 것을 발견했다. 사스캐처원주 데니스(Denis)는 아나폴리스 계곡에 있는 깃털보다 훨씬 적은 깃털을 사용했지만, 전자가 더 북쪽에 있음에도 불구하고 깃털을 사용했다.그러나 노바스코샤(애나폴리스 밸리가 있는 곳)의 기온은 대체로 사스카체완의 기온보다 낮아 예상 밖의 결과를 설명할 수 있을 것이다.[34]
구애하는 동안, 수컷 제비가 알려지지 않은 암컷을 공격한다.이것은 암컷이 날개를 퍼덕이는 비행을 통해 자극을 받을 수 있는데, 이것은 법정에 초대하는 것일 수도 있다.그러면 수컷은 수직 자세를 취하게 되는데, 그 자세는 위로 치켜올리고 약간 벌린 꼬리와 날개가 깜박이고 약간 축 늘어진다.이것은 암컷이 수컷의 등에 착륙을 시도하도록 자극하지만 수컷은 이를 막기 위해 날아간다. 이것은 반복된다.암컷에게 구애한 후 수컷은 암컷이 검사하는 자신이 선택한 둥지 사이트로 날아간다.짝짓기를 하는 동안, 수컷은 암컷 위에 올라가서 똑딱거리는 소리를 내면서 그녀를 올라탄다.그리고 나서 그는 암컷의 목 깃털을 그의 지폐에 쥐고 약간 뻗은 날개 위에 서서 암컷과 함께 만든다.교합은 여러 번 일어난다.[7]
달걀은 5월 초부터 6월 중순까지 낳으며(기후변화로[35] 인해 더 일찍 발생하고 있지만), 병아리는 6월 중순에서 7월 사이에 싹이 튼다.[14]위도는 배치 날짜와 긍정적으로 상관되는 반면,[14] 여성 나이와 날개 길이(날개가 길수록 포획[36] 효율이 높아짐)는 부정적으로 상관된다.[37]나무 제비는 산란기 동안 풍부한 음식과 온도를 바탕으로 번식하기 때문에 소득을 창출할 가능성이 높다.[36]이 종은 일반적으로 사회적으로 일부일처제지만 번식하는 수컷의 8%까지 다처제다.[14]폴리기는 영토의 영향을 받는다. 즉, 네스트 박스가 있는 지역을 가진 수컷은 적어도 5미터(16피트) 떨어져 있는 다성체일 가능성이 더 높다.[38]이 다육은 산란기의 조건에 따라 달라지는 것이 제안된다: 풍부한 식량과 같은 더 좋은 조건들은, 다육의 암컷들이 더 많은 알을 낳도록 도움을 받지 못하는 것을 허용한다.[39]
제비는 잉어부육 비율이 높고, 둥지의 38~69%가 잉어부육의 산물이며, 잉어부복의 결과인 적어도 한 마리의 둥지를 가진 새끼의 50~87%가 잉어부육의 산물이다.[14]이것의 원인이 될 수 있는 한 가지 요인은 여성들이 교미에 대한 통제권을 가지고 있어서 친자보호자들을 비효율적으로 만든다는 것이다.[40]2009년 한 연구에 따르면, 알을 낳기 직전에 알을 낳기 직전 더 빈번한 교배에 의해 이러한 현상이 완화될 수 있으며, 이 기간 동안 알을 낳기 3일에서 1일 전에 배아내 교배 시도가 최고조에 달했고, 이 기간 동안 더 많은 성공적인 시도는 어린 수컷들이 가졌던 배아내 교배율의 비율을 증가시켰다.이 후자의 발견은 1993년과 1994년의 연구와 상반된다.[41]외아들은 수컷이 나무 제비에서 기여하는 부모의 보살핌의 수준을 바꾸지 않는다.[42]상당한 수의 외양간 아버지는 부유층일 수 있다.2001년 한 연구에 따르면 35마리의 잉어 둥지 중 25마리는 지역 주민이, 3마리는 인근 지역 주민이, 7마리는 남성 부유층이 임신을 했다.나무 제비에서, 이렇게 떠다니는 것은 좋은 상태의 수컷이 더 많은 새끼를 낳을 수 있도록 돕는 반면, 나쁜 상태의 수컷은 부모의 보살핌에 투자함으로써 성공할 수 있게 해준다.[43]또한 상당한 수의 여성 부유층도 있다; 1985년의 한 연구는 여성의 약 23%에서 27%가 부유층이고, 그 중 47%에서 79%가 아성체라고 추정했다.[44]
암컷이 왜 외공 교배작용을 하는지, 외공 짝을 어떻게 선택하는지가 논란이 되고 있다.유전적합성 가설이라 불리는 한 이론은 자손의 건강 증가는 이질성이 증가함에 따라 발생하며, 따라서 암나무 제비는 유전적으로 자신과 덜 비슷한 수컷과 짝짓기를 선호한다고 말한다.암컷은 또한 호환되는 짝을 보장하기 위해 교미 후 정자를 선택할 수도 있다.이 이론을 뒷받침하기 위해, 2007년의 한 연구는 외양자식이 외양자식보다 이질자식이라는 것을 발견했다.[45]그러나 2005년 한 논문은 한 쌍의 유전적 유사성과 그들의 둥지에 있는 잉어 새끼의 비율 사이에 약간의 부정적인 상관관계를 발견했다.[46]좋은 유전자 이론은 암컷이 그들의 유전자의 질에 따라 여분의 수컷을 선택한다고 말한다.이것은 왜 어떤 나무 제비들은 여분의 새끼를 가지고 있지 않은지, 반면에 다른 제비들은 여분의 새끼를 가지고 있지 않은 새끼를 가지고 있다.[40]그러나 대부분의 연구는 외양간 수컷과 외양간 수컷 사이의 표현력 차이를 발견하지 못했다(2007년 연구에서는 깃털이 밝은 나이든 수컷이 쌍체 결합 밖에서 교미할 가능성이 더 높다는 것을 밝혀냈지만).[47]또한, 2017년 한 논문에 따르면, 외양자식은 외양자식보다 더 나태한 개체군에 합류할 가능성이 없다.또 다른 이론은 잉태자녀가 상황에 따라 다르며, 잉태자녀는 특정 상황에서 잉태자녀보다 더 많이, 그리고 다른 환경에서는 더 낮은 성과를 보인다는 것을 시사한다.예를 들어 2017년 논문에서는 잉어가 포식자 마운트에 노출되었을 때 잉어가 잉어보다 크고 무거우며 날개가 긴 반면 잉어 미만이 비프레데이터 마운트를 보여졌을 때 잉어 미만이 잉어보다 무겁다는 것을 발견했다.이 논문은 또한 변이가 적은 환경에서 자란 배지 내 새끼들이 배지 내 새끼들보다 배지 내 새끼들보다 배지 내 새끼들이 배지 내 새끼들보다 발달성 가소성을 덜 가지고 있다는 것을 시사했다.[48]2018년 한 연구는 실험적으로 확대된 부랑아에서 외양자식이 외양자식보다 외양자식 출몰 가능성이 더 높다는 것을 밝혀내면서 이 맥락에 의존하는 가설을 약하게 지지했다. 그러나, 말단자식 길이(생존과 생식 성공의 상관 관계)와 부화 후 12일 후의 크기는 이들 사이에 유의하게 달랐다.g, 그리고 두 종류 사이의 유의미한 차이점은 비육종 브로우에서 발견되지 않았다.[49]
여성에 대한 외조부모의 적응성을 입증하기 위한 연구는 짝을 찾기 위한 포식 증가와 [50]같이 여성에 대한 건강관리의 감소에 대한 잠재적 비용에 비해 자녀들의 건강관리가 증가하게 될 긍정적인 효과가 없다는 이유로 비판 받아왔다.[51]따라서, 여성에 대한 외자부의 비적응성에 근거한 이론들이 가정되어 왔다.이러한 이론들은 유전적 제약에 근거하고 있는데, 이로 인해 부적응적인 행동을 초래하는 알레르기가 유지되는 이유는 또한 유익한 표현형식에 기여하기 때문이다.성간 적대적 늑막염 이론은 남성의 외육아에 대한 강한 선택(이 새에서[50] 보듯이)이 여성의 외육아에 대한 약한 선택보다 우선한다고 말한다.한편, 성내 적대적 플리오트로피 가설은 이를 조절하는 유전자가 체내 결합률과 [52]같이 여성 건강의 측면에 플리오티안 효과를 가지기 때문에 외자녀가 존재한다고 주장한다.[50]
나무 제비는 보통 4~7개, [14]순백색, 반투명하지만 알을 낳으면 약 19~14밀리미터(0.75x0.55인치)의 알을 낳는다.[53]이 알들은 대부분 14~15일 후에 부화하지만 보통 2~마지막 알이 알을 낳은 후에 [14]암컷에 의해 11~20일 동안 배양된다.[54][53]둥지의 약 88%가 적어도 하나의 둥지를 생산하지만, 이것은 나쁜 날씨와 더 어린 번식 암컷에 의해 낮아질 수 있다.[14]알은 일반적으로 알을 낳은 순서대로 부화한다.그들은 또한 약간 비동기적으로 부화하는데, 첫 번째와 마지막 둥지가 출현하는 시간 사이의 평균 28시간이다.이것은 더 일찍 부화한 병아리들이 나중에 부화한 병아리들보다 더 무게가 나가는 (특히 보금자리 초기에) 체중 위계를 초래할 수 있고, 이것은 암컷이 식량 부족 시 어떤 병아리에게 먹이를 줄 것인지를 우선순위로 할 수 있게 한다.이것은 부화 후 12일이 지나면 일반적으로 체중 차이가 크지 않기 때문에 보금자리 초기에 가장 큰 영향을 미칠 수 있다.[54]병아리와 달걀의 유아살해는 수컷이 다른 수컷으로 대체될 때 가끔 발생한다.대체 수컷이 적어도 한 개의 알을 수정하는 기회가 있기 때문에 일반적으로 클러치가 완전하지 않을 때는 영아살해가 발생하지 않는다.부화 중 수컷이 도착하면 영아살균을 유발하는 경우도 있지만, 대체 수컷에게서 일부 알을 채취했을 가능성이 있기 때문에 다른 때는 알을 채택하기도 한다.만약 대체 수컷이 병아리가 부화한 후에 도착한다면, 비록 암컷이 때때로 이것을 막을 수는 있지만, 대개 유아 살해는 자행된다.[55]
더 나은 상태의 암컷이 생산하는 둥지는 종종 고급 수컷에게 성비가 치우쳐 있다.2000년의 한 연구는 수컷이 더 가변적인 생식 성공을 가지고 있기 때문에, 따라서 고품질의 수컷이 비슷한 품질의 암컷보다 더 많은 새끼를 낳기 때문이라고 가설을 세웠다.[56]
둥지 제비의 성장과 생존은 제비의 환경에 영향을 받는다.젊은 둥지와 늙은 둥지 모두에서(각각 생후 2일과 4일 사이, 9일과 11일 사이) 성장은 특히 전자에서 더 높은 최대 온도에 의해 긍정적인 영향을 받는다.나중에 부화하는 날은 특히 어린 둥지의 성장에 부정적인 영향을 미친다.늙은 병아리들은 곤충이 풍부할 때 다소 빨리 자란다.어린 둥지의 성장은 나이가 들수록 증가하는 반면, 늙은 둥지에서는 나이가 들수록 줄어든다.[57]어린 나무 제비는 둥지를 벗어나면 평균 9.5일, 둥지에 있을 때는 4~8일(곰의 크기에 따라 다름)[58]의 나이에 어른만큼 효과적으로 적어도 75%의 체온을 조절할 수 있다.둥지들은 약 18일에서 22일 후에 싹이 텄고, 약 80%가 성공하였다.부화 성공과 마찬가지로, 이것은 좋지 않은 날씨와 젊은 여성에 의해 부정적인 영향을 받는다.[14]병아리는 뱀이나[59] 너구리의 먹잇감을 맞을 수도 있다.[60]이런 약탈은 구걸 전화에 의해 악화될 수 있다.[61]
먹이 주기

그 나무 제비는 단독으로 또는 무리를 지어 지상에서 50미터(160피트)까지 올라간다.그것의 비행은 펄럭이는 것과 미끄러지는 것의 혼합물이다.번식기에는 주로 둥지 부지에서 4km(2.5mi) 이내가 된다.그러나 둥지를 찾아다닐 때는 주로 둥지에서 200m(660ft)까지 올라가고 대부분 [14]눈에 띄며 12m(39ft) 높이까지 올라간다.[62]비행 중에 잡히는 것뿐만 아니라,[7] 곤충들은 때때로 땅, 물, 식물, 수직 표면에서 잡힌다.[14]
나무 제비는 대부분 곤충을 먹는데, 몇몇 연체동물, 거미, 그리고 과일이 있다.북아메리카에서 파리는 딱정벌레와 개미로 보충되어 식단의 약 40%를 차지한다.그렇지 않으면, 식단은 약 90% 파리다.[14]취해진 곤충들은 수생 유기체와 육지 유기체의 혼합물이다; 전자는 오메가-3 고불포화 지방산의 중요한 공급원이다.나무제비는 전구체 α-리놀렌산을 도코사헥사에노산처럼 고불포화지방산으로 전환할 수 있지만 필요한 양으로는 그렇게 할 수 없기 때문이다.[63]씨앗과 베리 음식은 주로 마이리카속(Myrica)으로 여름을 제외한 북반구 4계절에서 주로 섭취된다.갑각류 동물들도 뉴욕의 롱아일랜드에 대한 연구에서 겨울 식단에 중요한 것으로 밝혀졌다.[14]
양성은 모두 둥지를 먹이로 삼는다(수컷이 암컷보다 새끼에게 적게 먹이지만) 그 결과 시간당 10~20개 정도의 먹이를 얻는다.[14]부모들은 종종 지저귀는 소리를 이용해 둥지 새끼들이 구걸하도록 자극한다.이것은 어린 병아리들에게 더 자주 사용되는데, 이는 부모가 음식을 가지고 도착하지만 전화를 하지 않을 때 나이든 병아리들보다 덜 구걸하기 때문이다.[19]부모가 없는 상황에서 구걸할 가능성도 나이가 들수록 높아진다.[64]부화 순서는 병아리를 얼마나 먹이는가에 영향을 미친다; 마지막 부화 둥지(부화가 비동기인 경우)는 앞서 부화한 부화보다 덜 먹일 가능성이 있다.[65]둥지 입구에 더 가까이 있는 둥지 또한[66] 먼저 구걸하고 더 자주 구걸하는 사람들처럼 먹일 가능성이 더 높다.새끼가 먹이를 먹는 전체 비율도 구걸이 많아질수록 높아진다.[67]식단 자체는 대부분 곤충으로 구성되어 있으며, 식단의 대부분을 구성하는 디프테라, 헤미프테라, 오도나타 순으로 구성되어 있다.[14]이 곤충들은 크기가 대부분 10밀리미터(0.39인치)나 되지만, 때로는 길이가 60밀리미터(2.4인치)나 되는 경우도 있다.[62]인간에 의해 산성화된 호수 근처의 둥지에서는 칼슘 보충제, 주로 생선 뼈, 가재 외골격, 조개 껍질, 새알 껍질 등을 찾기가 더 어렵다.이것은 성인 나무 제비가 이 칼슘 보충제를 얻기 위해 보통 때보다 더 멀리, 때로는 둥지에서 650미터(2,130피트) 떨어진 곳으로 이동하도록 강요한다.[68]
서바이벌
제비는 평균 수명이 2.7년[69], 최대 수명은 12년이다.약 79%의 개인이 첫 해에 생존하지 못하고 있으며, 연간 사망률이 40~60%[14]에 달하는 개인도 생존하지 못하고 있다.대부분의 사망자는 추운 날씨로 인해 곤충의 이용가능성이 감소하고 기아로 이어질 가능성이 높다.[7]수명은 텔로미어 길이와 관련이 있다: (전년도 번식지로의) 수익률을 생존의 대용품으로 사용한 2005년의 연구에서는 텔로미어가 가장 긴 사람의 예상 수명은 3.5년으로 가장 짧았던 사람의 1.2년에 비해 낮았다.[70]짧은 말단소립이 체력 저하를 초래하는지 아니면 단순히 그것을 나타내는 지표인지는 알 수 없다.그럼에도 불구하고, 2016년 논문은 조건의 측정이 텔로미어 길이와 확실히 상관관계가 있다는 것을 발견했다.또한 수컷도 암컷보다 말단소립이 더 길었고, 작은 날개 새도 그랬다.말단소립이 짧은 개인은 생식력을 증가시킴으로써 체력의 잠재적인 손실을 보상할 수 있는 반면, 말단소립이 긴 개인은 말단소립이 길어진 병아리의 적은 비율에서 증명하듯, 말단소립을 가진 암컷의 투자를 감소시킬 수 있다.[71]텔로미어 길이는 유전성이 매우 높으며, 특히 산모의 길이에 의존한다.[72]
포식
나무 제비는 광범위한 포식자에 취약하다.검은 구렁이, 미국 까마귀, 미국의 황조롱이, 일반적인 grackles, 북부의 흔들린다면, 마리의 다람쥐들, deermice, 국내 고양이, weasels,[73]미국 흑인 bears,[74]과 raccoons,[75]에 다음 계란, nestlings며 어른 가을 피해자는 동안이나 앉아 있는 포식 동물이 나무 제비로 날아가는 미국의 황조롱이, black-billed magpies,[73]기계단을 포함한다.dowls,[76] 큰 h올빼미, 머린, 송골매, 날카로운 정강이를 가진 매.회피 비행은 제비들이 자유롭게 날아다니는 포식자들에 대한 일반적인 반응이지만,[73] 모빙 행동은 둥지 주변에서 흔히 볼 수 있으며, 포식자들뿐만 아니라, 포식자들 때문에 겁을 먹을 수도 있는 둥지 사이트 경쟁자들에게도 향한다.[20]이 행동에는 제비가 떼를 지어 땅 위 약 5~20m(16~66ft)에서[73] 침입자를 향해 다이빙하는 것(1.6~6.6ft)이 포함되며, 대개는 끝부분에서 약 0.5~2m(1.6~6.6ft) 이내에서 부드러운 똑딱 소리를 낸다.[20]그것은 어떤 포식자가 접근하는가에 기초하여 공격의 강도를 변화시키는 것 같다;[73] 1992년의 한 연구는 페렛이 검은 쥐 뱀보다 더 강력한 방어를 이끌어냈다는 것을 발견했고,[20] 2019년의 한 논문에서도 비슷하게 검은 쥐 뱀 모형은 최소한으로 급강하되었고 동쪽의 다람쥐 모형은 가장 많이 공격되었다는 것을 발견했다.[77]방어 행동이 뱀에 대항해 수행하기에 덜 효과적이고[20] 더 위험할 수 있기 때문에 뱀이 더 약한 반응을 유발했다고 제안된다.[77]
기생충
제비는 혈액 기생충 트라이파노소마 등 각종 기생충에 취약하다.또한 벼룩 세라토필루스 idius와 깃털 진드기 프테로니소이드 티렐리, 트루에사르티아, 그리고 (아마도) 헤미알게에 취약하다.그것은 또한 아마도 브뤼엘리아와 미르사이다의 이 때문에 고통 받을 것이다.새에 있는 벼룩의 수와 새를 돌보고 있는 새끼의 수 사이에는 상관관계가 있다.이 관계는 더 큰 클러치 때문에 벼룩의 미세 기후가 개선된 원인으로 추측된다.[78]또한 둥지벌레는 프로토칼리포라속(Protocaliphora)의 복파리와 같은 기생충에 시달리는데,[79] 이것은 둥지벌레에 의해 혈액이 손실되는 결과를 낳는다.[80]그러나 이 기생충들은 대다수의 둥지에서 발견되며 둥지에 큰 영향을 미치지는 않는 것 같다.1992년에 발표된 한 연구에 따르면 날아다니는 기생충의 영향은 둥지 덩어리 변화의 약 5.5%에 불과하다고 한다.[79]
면역학
번식용 암나무 제비에서, HIC는 산란일과 반비례적으로 상관관계가 있다.이는 평균적으로 알을 일찍 낳는 새가 나중에 낳는 새보다 항원에 더 강한 항생제 반응을 보인다는 것을 의미한다.날개가 잘리는 제비는 일반적으로 HIC가 낮다.이러한 관계는 일찍 낳은 암컷이 더 높은 HIC를 획득한다는 결론을 뒷받침하는 것으로 해석될 수 있지만, 이러한 상관관계를 발견한 연구 저자들은 번식기가 시작될 무렵의 더 추운 기온 때문에, 이 가능성은 낮다고 믿었다.그 대신 그들은 HIC가 질을 측정하는 척도가 될 수 있고, 더 높은 질의 여성이 더 일찍 누워 있을 수 있다고 생각했다.저자들은 또한 그것이 장애 조류들의 낮은 HIC에서 보여지듯이 작업량을 나타내는 지표라고 가정했다.[81]
더 높은 품질의 암컷 제비는 면역 도전에 맞서기 위해 자원을 다른 곳으로 돌리면서 생식 노력을 유지할 수 있다.질 낮은 제비들은 그렇게 할 수 없다; 2005년 뉴욕 이타카에서 실시한 한 연구는 인공적으로 커진 새끼 곰을 가진 새끼 암컷들이 비록 새끼의 질을 유지할 수는 있지만, 면역 도전에 대한 반응이 더 낮다는 것을 발견했다.[82]2005년 한 연구에서는 암컷이 자손의 질을 우선시하든 면역력을 우선시하든 생존 확률과 관련이 있을 것이다; 생존율이 낮은 알래스카에서 큰 새끼를 가진 암컷은 면역 반응이 약하지만 생식 노력은 꾸준히 유지한다는 것을 발견했다. 반면에 테네시에서는 생존율이 더 높은 암컷은 생존 확률과 관련이 있다.더 강한 반응이지만 더 낮은 품질의 자손.[83]
나무 제비에서, 면역 체계의 일부 구성 요소는 나이가 들면서 악화된다.예를 들어, T세포 매개 면역력을 획득하면 암나무 제비에서 나이가 들면서 면역력이 감소한다.그러나, 암컷의 나이는 후천적이고 선천적인 유머 면역력 모두에 영향을 미치지 않는다; 전자의 악화 부족은 헛간 제비와 암컷 제비들에 대한 연구와 대조를 이룬다.[84]이러한 면역억제(나이에 따른 면역기능 저하) 때문에 질병에 감염된 나이든 암컷은 일반적으로 둥지를 덜 방문하여 둥지가 느리게 자라게 된다.그들은 또한 감염으로 인해 체중이 감소할 가능성이 있다.[85]
상태
나무 제비는 국제자연보전연맹의 최소한의 관심사로 여겨지고 있다.이는 이 새가 약 834,000 평방 킬로미터(32만 2천 제곱 미)[1]의 넓은 범위와 2,000만 명으로 추정되는 안정적인 개체수 때문이다.[14]미국은 1918년 철새조약법에 의해,[86] 캐나다는 철새협약법에 의해 보호되고 있다.[87]미국 일부 지역에서는 이 제비의 사거리가 남쪽으로 확대되었는데, 이는 토지 이용의 변화, 비버의 재도입, 블루버드용으로 설치된 둥지 상자 때문일 것이다.제비는 숲의 개간과 습지의 감소에 의해 부정적인 영향을 받고, 제비는 겨울잠을 잘 수 있는 서식지를 감소시킨다.이 제비는 보통 별똥벌레, [14]집참새, 파랑새,[88] 그리고 집 렌과 둥지를 점령하지 않고 파괴하는 둥지를 경쟁해야 한다.[89]호수를 산성화하면 이 제비가 칼슘이 풍부한 물건을 찾기 위해 비교적 먼 거리를 가야 할 수 있고 병아리가 플라스틱을 먹게 될 수도 있다.[68]살충제나 다른 오염물질과 같은 다른 화학물질은 달걀에 고도로 농축될 수 있으며, PCB는 한 쌍의 클러치를 포기하는 것과 관련이 있다.[14]기름 모래 광산 현장에서의 오염은 둥지에서의 에톡시레소루핀-오-데틸아제(독소화 효소)의 활성도로 측정했을 때 독소의 존재를 증가시킴으로써 나무 제비에 부정적인 영향을 줄 수 있다.비록 극도의 날씨:2006년 연구는 습지의 nestlings 가장 원유 모래(oilsand)물질 처리에 의해 오염되어 10번 이상 죽을 그 컨트롤 사이트에서 동기화된 차가운 온도와 무거운 rainfall,의 시기보다 높다는 것을 알아내는 영향을 나타낸다는 것을 일반적으로 자리잡에 거의 영향을 끼치지 않고 fledging,[90]다. com날씨가 덜 극단적이었을 때 집단들 사이의 사망률의 차이가 없다는 것을 주목했다.[91]그러나 2019년 논문에 따르면 강수량 증가가 기름 모래밭 근처와 멀리 떨어진 보금자리의 부화 및 보금자리 성공률에서 비슷한 하락을 초래했다고 한다.[92]또 다른 연구에서 수은에 노출된 새들은 평균적으로 그렇지 않은 새들보다 병아리가 한 마리 적게 번식했는데, 이것은 따뜻한 날씨에 의해 증폭된 영향이다.[93]게다가, 추운 날씨 사건은 항공 곤충 먹이의 이용 가능성을 빠르게 감소시킬 수 있으며,[94] 번식이 진전되는 일부 개체군에서는 자손 생존이 감소하는 결과를 초래할 수 있다.[95]
참조
메모들
인용구
- ^ a b BirdLife International (2016). "Tachycineta bicolor". IUCN Red List of Threatened Species. 2016: e.T22712057A94316797. doi:10.2305/IUCN.UK.2016-3.RLTS.T22712057A94316797.en. Retrieved 12 November 2021.
- ^ Vieillot, Louis Pierre (1807). Histoire naturelle des oiseaux de l'Amérique Septentrionale: contenant un grand nombre d'espèces décrites ou figurées pour la première fois (in French). Vol. 1. Paris: Crapelet. p. 61.
- ^ Cabanis, Jean (1850). Museum Heineanum : Verzeichniss der ornithologischen Sammlung des Oberamtmann Ferdinand Heine auf Gut St. Burchard vor Halberstatdt (in German). Vol. 1. Halberstadt: Independently commissioned by R. Frantz. p. 48.
- ^ Coues, Elliott (1878). Birds of the Colorado Valley: a repository of scientific and popular information concerning North American ornithology. Washington, DC: Government Printing Office.
- ^ a b Coues, Elliott (1882). A check list of North American birds (2 ed.). Boston: Estes and Lauriat. p. 42.
- ^ Turner, Angela (2020). del Hoyo, Josep; Elliott, Andrew; Sargatal, Jordi; Christie, David A.; de Juana, Eduardo (eds.). "White-rumped Swallow (Tachycineta leucorrhoa)". Handbook of the Birds of the World Alive. Lynx Edicions. doi:10.2173/bow.whrswa1.01. S2CID 216180193. Retrieved 14 January 2017.
- ^ a b c d e f g h i j k l m Turner, Angela (2010). A Handbook to the Swallows and Martins of the World. London: A & C Black. pp. 97–100. ISBN 978-1-4081-3172-5.
- ^ Jobling, James A (2010). The Helm Dictionary of Scientific Bird Names. London: Christopher Helm. pp. 72, 377. ISBN 978-1-4081-2501-4.
- ^ Cerasale, David J.; Dor, Roi; Winkler, David W.; Lovette, Irby J. (2012). "Phylogeny of the Tachycineta genus of New World swallows: Insights from complete mitochondrial genomes" (PDF). Energy balance in migratory birds: Insights from mitochondrial genomes and leptin receptor biology (PhD). Cornell University. pp. 91–122.
- ^ Whittingham, Linda A; Slikas, Beth; Winkler, David W; Sheldon, Frederick H (2002). "Phylogeny of the tree swallow genus, Tachycineta (Aves: Hirundinidae), by Bayesian analysis of mitochondrial DNA sequences". Molecular Phylogenetics and Evolution. 22 (3): 430–441. doi:10.1006/mpev.2001.1073. ISSN 1055-7903. PMID 11884168.
- ^ Moore, William S. (1995). "Inferring phylogenies from mtDNA variation: Mitochondrial-gene trees versus nuclear-gene trees". Evolution. 49 (4): 718–726. doi:10.2307/2410325. ISSN 0014-3820. JSTOR 2410325. PMID 28565131.
- ^ Dor, Roi; Carling, Matthew D.; Lovette, Irby J.; Sheldon, Frederick H.; Winkler, David W. (2012). "Species trees for the tree swallows (Genus Tachycineta): An alternative phylogenetic hypothesis to the mitochondrial gene tree". Molecular Phylogenetics and Evolution. 65 (1): 317–322. doi:10.1016/j.ympev.2012.06.020. ISSN 1055-7903. PMID 22750631.
- ^ "Tree Swallow Identification, All About Birds, Cornell Lab of Ornithology". www.allaboutbirds.org. Retrieved 28 September 2020.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z Turner, A. (2020). del Hoyo, Josep; Elliott, Andrew; Sargatal, Jordi; Christie, David A.; de Juana, Eduardo (eds.). "Tree Swallow (Tachycineta bicolor)". Handbook of the Birds of the World Alive. Barcelona, Spain: Lynx Edicions. doi:10.2173/bow.treswa.01. S2CID 216382529. Retrieved 10 December 2017.
- ^ a b Hussell, David J. T. (1983). "Age and plumage color in female tree swallows". Journal of Field Ornithology. 54 (3): 312–318.
- ^ Stutchbury, Bridget J.; Robertson, Raleigh J. (October 1987). "Signaling subordinate and female status: Two hypotheses for the adaptive significance of subadult plumage in female tree swallows" (PDF). The Auk. 104 (4): 717–723. doi:10.1093/auk/104.4.717. ISSN 0004-8038.
- ^ Coady, Chelsea D.; Dawson, Russell D. (2013). "Subadult plumage color of female tree swallows (Tachycineta bicolor) reduces conspecific aggression during the breeding season". The Wilson Journal of Ornithology. 125 (2): 348–357. doi:10.1676/12-155.1. ISSN 1559-4491. S2CID 85030082.
- ^ a b c Sharman, M. Y.; Robertson, R. J.; Ratcliffe, L. M. (1994). "Vocalizations of the tree swallow (Tachycineta bicolor) during the pre-laying period: A structural and contextual analysis". American Midland Naturalist. 132 (2): 264–274. doi:10.2307/2426582. ISSN 0003-0031. JSTOR 2426582.
- ^ a b Leonard, Marty L.; Fernandez, Nicole; Brown, Glen (1997). "Parental calls and nestling behavior in tree swallows". The Auk. 114 (4): 668–672. doi:10.2307/4089286. ISSN 0004-8038. JSTOR 4089286.
- ^ a b c d e Winkler, David W. (1992). "Causes and consequences of variation in parental defense behavior by tree swallows". The Condor. 94 (2): 502–520. doi:10.2307/1369222. ISSN 0010-5422. JSTOR 1369222. S2CID 45389696.
- ^ McIntyre, Emma; Horn, Andrew G.; Leonard, Marty L. (2014). "Do nestling tree swallows (Tachycineta bicolor) respond to parental alarm calls?". The Auk. 131 (3): 314–320. doi:10.1642/AUK-13-235.1. ISSN 0004-8038. S2CID 86754716.
- ^ McIntyre, Emma; Leonard, Marty L.; Horn, Andrew G. (2014). "Ambient noise and parental communication of predation risk in tree swallows, Tachycineta bicolor". Animal Behaviour. 87: 85–89. doi:10.1016/j.anbehav.2013.10.013. ISSN 0003-3472. S2CID 53173370.
- ^ Leonard, Marty L.; Horn, Andrew G.; Oswald, Krista N.; McIntyre, Emma (2015). "Effect of ambient noise on parent–offspring interactions in tree swallows". Animal Behaviour. 109: 1–7. doi:10.1016/j.anbehav.2015.07.036. ISSN 0003-3472. S2CID 53160897.
- ^ Knight, Samantha M.; Bradley, David W.; Clark, Robert G.; Gow, Elizabeth A.; Bélisle, Marc; Berzins, Lisha L.; Blake, Tricia; Bridge, Eli S.; Burke, Lauren; Dawson, Russell D.; Dunn, Peter O.; Garant, Dany; Holroyd, Geoffrey L.; Hussell, David J. T.; Lansdorp, Olga; Laughlin, Andrew J.; Leonard, Marty L.; Pelletier, Fanie; Shutler, Dave; Siefferman, Lynn; Taylor, Caz M.; Trefry, Helen E.; Vleck, Carol M.; Vleck, David; Winkler, David W.; Whittingham, Linda A.; Norris, D. Ryan (2018). "Constructing and evaluating a continent-wide migratory songbird network across the annual cycle". Ecological Monographs. 88 (3): 445–460. doi:10.1002/ecm.1298. ISSN 0012-9615.
- ^ a b Winkler, David W.; Wrege, Peter H.; Allen, Paul E.; Kast, Tracey L.; Senesac, Pixie; Wasson, Matthew F.; Llambías, Paulo E.; Ferretti, Valentina; Sullivan, Patrick J. (2004). "Breeding dispersal and philopatry in the tree swallow". The Condor (Submitted manuscript). 106 (4): 768–776. doi:10.1650/7634. ISSN 0010-5422. S2CID 42958338.
- ^ Winkler, David W. (2006). "Roosts and migrations of swallows". El Hornero. 21 (2): 85–97.
- ^ Jones, Jason (2003). "Tree swallows (Tachycineta bicolor): A new model organism?". The Auk. 120 (3): 591. doi:10.1642/0004-8038(2003)120[0591:TSTBAN]2.0.CO;2. ISSN 0004-8038.
- ^ Shutler, Dave; Clark, Robert G. (2003). "Causes and consequences of tree swallow (Tachycineta bicolor) dispersal in Saskatchewan". The Auk. 120 (3): 619–631. doi:10.1642/0004-8038(2003)120[0619:CACOTS]2.0.CO;2. ISSN 0004-8038.
- ^ Muldal, Alison; Gibbs, H. Lisle; Robertson, Raleigh J. (1985). "Preferred nest spacing of an obligate cavity-nesting bird, the tree swallow". The Condor. 87 (3): 356–363. doi:10.2307/1367216. ISSN 0010-5422. JSTOR 1367216.
- ^ Rendell, Wallace B.; Robertson, Raleigh J. (1989). "Nest-site characteristics, reproductive success and cavity availability for tree swallows breeding in natural cavities". The Condor. 91 (4): 875. doi:10.2307/1368072. ISSN 0010-5422. JSTOR 1368072.
- ^ a b Winkler, David W. (1993). "Use and importance of feathers as nest lining in tree swallows (Tachycineta bicolor)". The Auk. 110 (1): 29–36.
- ^ Lombardo, Michael P.; Bosman, Ruth M.; Faro, Christine A.; Houtteman, Stephen G.; Kluisza, Timothy S. (1995). "Effect of feathers as nest insulation on incubation behavior and reproductive performance of tree swallows (Tachycineta bicolor)". The Auk. 112 (4): 973–981. doi:10.2307/4089028. ISSN 0004-8038. JSTOR 4089028.
- ^ Windsor, Rebecca L.; Fegely, Jessica L.; Ardia, Daniel R. (2013). "The effects of nest size and insulation on thermal properties of tree swallow nests". Journal of Avian Biology. 44 (4): 305–310. doi:10.1111/j.1600-048X.2013.05768.x. ISSN 0908-8857.
- ^ Holland, Erika R.; Shutler, Dave (2018). "Nest feathering responses by tree swallows (Tachycineta bicolor) to experimental warming". Journal of Ornithology. 159 (4): 991–998. doi:10.1007/s10336-018-1568-6. ISSN 2193-7192. S2CID 46971093.
- ^ Dunn, P. O.; Winkler, D. W. (1999). "Climate change has affected the breeding date of tree swallows throughout North America". Proceedings of the Royal Society B: Biological Sciences. 266 (1437): 2487–2490. doi:10.1098/rspb.1999.0950. ISSN 0962-8452. PMC 1690485. PMID 10693819.
- ^ a b Nooker, Jacqueline K.; Dunn, Peter O.; Whittingham, Linda A. (2005). "Effects of food abundance, weather, and female condition on reproduction in tree swallows (Tachycineta bicolor)". The Auk. 122 (4): 1225. doi:10.1642/0004-8038(2005)122[1225:EOFAWA]2.0.CO;2. ISSN 0004-8038.
- ^ Winkler, David W.; Allen, Paul E. (1996). "The seasonal decline in tree swallow clutch size: physiological constraint or strategic adjustment?". Ecology. 77 (3): 922–932. doi:10.2307/2265512. ISSN 0012-9658. JSTOR 2265512. S2CID 84919928.
- ^ Dunn, Peter O.; Hannon, Susan J. (1991). "Intraspecific competition and the maintenance of monogamy in tree swallows". Behavioral Ecology. 2 (3): 258–266. doi:10.1093/beheco/2.3.258. ISSN 1045-2249.
- ^ Dunn, Peter O.; Hannon, Susan J. (1992). "Effects of food abundance and male parental care on reproductive success and monogamy in tree swallows". The Auk. 109 (3): 488–499. ISSN 0004-8038.
- ^ a b Lifjeld, Jan T.; Dunn, Peter O.; Robertson, Raleigh J.; Boag, Peter T. (1993). "Extra-pair paternity in monogamous tree swallows". Animal Behaviour. 45 (2): 213–229. doi:10.1006/anbe.1993.1028. ISSN 0003-3472. S2CID 53195131.
- ^ Crowe, Susan A.; Kleven, Oddmund; Delmore, Kira E.; Laskemoen, Terje; Nocera, Joseph J.; Lifjeld, Jan T.; Robertson, Raleigh J. (2009). "Paternity assurance through frequent copulations in a wild passerine with intense sperm competition". Animal Behaviour. 77 (1): 183–187. doi:10.1016/j.anbehav.2008.09.024. ISSN 0003-3472. S2CID 13722818.
- ^ Kempenaers, Bart; Lanctot, Richard B.; Robertson, Raleigh J. (1998). "Certainty of paternity and paternal investment in eastern bluebirds and tree swallows". Animal Behaviour. 55 (4): 845–860. doi:10.1006/anbe.1997.0667. ISSN 0003-3472. PMID 9632472. S2CID 24760456.
- ^ Kempenaers, Bart; Everding, Susie; Bishop, Cheryl; Boag, Peter; Robertson, Raleigh J. (2001). "Extra-pair paternity and the reproductive role of male floaters in the tree swallow (Tachycineta bicolor)". Behavioral Ecology and Sociobiology. 49 (4): 251–259. doi:10.1007/s002650000305. ISSN 0340-5443. S2CID 25483760.
- ^ Stutchbury, Bridget J.; Robertson, Raleigh J. (1985). "Floating populations of female tree swallows". The Auk. 102 (3): 651–654. doi:10.1093/auk/102.3.651. ISSN 0004-8038.
- ^ Stapleton, Mary K.; Kleven, Oddmund; Lifjeld, Jan T.; Robertson, Raleigh J. (2007). "Female tree swallows (Tachycineta bicolor) increase offspring heterozygosity through extrapair mating". Behavioral Ecology and Sociobiology. 61 (11): 1725–1733. doi:10.1007/s00265-007-0404-4. ISSN 0340-5443. S2CID 22513713.
- ^ Barber, Colleen A.; Edwards, Mandy J.; Robertson, Raleigh J. (2005). "A test of the genetic compatibility hypothesis with tree swallows, Tachycineta bicolor". Canadian Journal of Zoology. 83 (7): 955–961. doi:10.1139/z05-091. ISSN 0008-4301.
- ^ Bitton, Pierre-Paul; O'Brien, Erin L.; Dawson, Russell D. (2007). "Plumage brightness and age predict extrapair fertilization success of male tree swallows, Tachycineta bicolor". Animal Behaviour. 74 (6): 1777–1784. doi:10.1016/j.anbehav.2007.03.018. ISSN 0003-3472. S2CID 53170228.
- ^ Hallinger, Kelly Kristen (2017). Context-dependent fitness consequences of extra-pair paternity in tree swallows (Tachycineta bicolor) (PhD). Cornell University.
- ^ Belmaker, Amos; Hallinger, Kelly K.; Glynn, Rebecca A.; Haussmann, Mark F.; Winkler, David W. (2018). "Is there a context-dependent advantage of extra-pair mating in tree swallows?". The Auk. 135 (4): 998–1008. doi:10.1642/AUK-18-3.1. hdl:10150/631782. ISSN 0004-8038. S2CID 91253157.
- ^ a b c Arnqvist, Göran; Kirkpatrick, Mark (2005). "The evolution of infidelity in socially monogamous passerines: The strength of direct and indirect selection on extrapair copulation behavior in females". The American Naturalist. 165 (S5): S26–S37. doi:10.1086/429350. ISSN 0003-0147. PMID 15795859. S2CID 32810854.
- ^ Dunn, Peter O.; Whittingham, Linda A. (2006). "Search costs influence the spatial distribution, but not the level, of extra-pair mating in tree swallows". Behavioral Ecology and Sociobiology. 61 (3): 449–454. doi:10.1007/s00265-006-0272-3. ISSN 0340-5443. S2CID 4975256.
- ^ Forstmeier, Wolfgang; Nakagawa, Shinichi; Griffith, Simon C.; Kempenaers, Bart (2014). "Female extra-pair mating: adaptation or genetic constraint?". Trends in Ecology & Evolution. 29 (8): 456–464. doi:10.1016/j.tree.2014.05.005. ISSN 0169-5347. PMID 24909948.
- ^ a b Hauber, Mark E. (1 August 2014). The Book of Eggs: A Life-Size Guide to the Eggs of Six Hundred of the World's Bird Species. Chicago: University of Chicago Press. p. 448. ISBN 978-0-226-05781-1.
- ^ a b Clotfelter, Ethan D.; Whittingham, Linda A.; Dunn, Peter O. (2000). "Laying order, hatching asynchrony and nestling body mass in tree swallows Tachycineta bicolor". Journal of Avian Biology. 31 (3): 329–334. doi:10.1034/j.1600-048X.2000.310308.x. ISSN 0908-8857.
- ^ Robertson, Raleigh J. (1990). "Tactics and Counter-Tactics of Sexually Selected Infanticide in Tree Swallows". Population Biology of Passerine Birds: An Integrated Approach. NATO ASI Series. pp. 381–390. doi:10.1007/978-3-642-75110-3_32. ISBN 978-3-540-51759-7.
- ^ Whittingham, Linda A.; Dunn, Peter O. (2000). "Offspring sex ratios in tree swallows: females in better condition produce more sons". Molecular Ecology. 9 (8): 1123–1129. doi:10.1046/j.1365-294x.2000.00980.x. ISSN 0962-1083. PMID 10964231. S2CID 3720108.
- ^ McCarty, John P.; Winkler, David W. (2008). "Relative importance of environmental variables in determining the growth of nestling tree swallows Tachycineta bicolor". Ibis. 141 (2): 286–296. doi:10.1111/j.1474-919X.1999.tb07551.x. ISSN 0019-1019.
- ^ Dunn, Erica H. (1979). "Age of effective homeothermy in nestling tree swallows according to brood size". The Wilson Bulletin. 91 (3): 455–457. ISSN 0043-5643.
- ^ De Steven, Diane (1980). "Clutch size, breeding success, and parental survival in the tree swallow (Iridoprocne bicolor)". Evolution. 34 (2): 278–291. doi:10.1111/j.1558-5646.1980.tb04816.x. hdl:2027.42/137562. ISSN 0014-3820. PMID 28563429. S2CID 19454000.
- ^ Robertson, Raleigh J.; Rendell, Wallace B. (1990). "A comparison of the breeding ecology of a secondary cavity nesting bird, the tree swallow (Tachycineta bicolor), in nest boxes and natural cavities". Canadian Journal of Zoology. 68 (5): 1046–1052. doi:10.1139/z90-152. ISSN 0008-4301.
- ^ Leech, Susan M.; Leonard, Marty L. (1997). "Begging and the risk of predation in nestling birds". Behavioral Ecology. 8 (6): 644–646. doi:10.1093/beheco/8.6.644. ISSN 1045-2249.
- ^ a b McCarty, John P.; Winkler, David W. (1999). "Foraging ecology and diet selectivity of tree swallows feeding nestlings". The Condor. 101 (2): 246–254. doi:10.2307/1369987. ISSN 0010-5422. JSTOR 1369987.
- ^ Twining, Cornelia W.; Lawrence, Peter; Winkler, David W.; Flecker, Alexander S.; Brenna, J. Thomas (2018). "Conversion efficiency of α-linolenic acid to omega-3 highly unsaturated fatty acids in aerial insectivore chicks". The Journal of Experimental Biology. 221 (3): jeb165373. doi:10.1242/jeb.165373. ISSN 0022-0949. PMID 29217628.
- ^ Leonard, Marty L.; Horn, Andrew G. (2001). "Begging in the absence of parents by nestling tree swallows". Behavioral Ecology. 12 (4): 501–505. doi:10.1093/beheco/12.4.501. ISSN 1465-7279.
- ^ Johnson, L. Scott; Wimmers, Larry E.; Campbell, Sara; Hamilton, Lucy (2003). "Growth rate, size, and sex ratio of last-laid, last-hatched offspring in the tree swallow Tachycineta bicolor". Journal of Avian Biology. 34 (1): 35–43. doi:10.1034/j.1600-048X.2003.02950.x. ISSN 0908-8857.
- ^ Whittingham, Linda A; Dunn, Peter O; Clotfelter, Ethan D (2003). "Parental allocation of food to nestling tree swallows: the influence of nestling behaviour, sex and paternity". Animal Behaviour. 65 (6): 1203–1210. doi:10.1006/anbe.2003.2178. ISSN 0003-3472. S2CID 4993059.
- ^ Leonard, M. L.; Horn, Andrew G. (2001). "Begging calls and parental feeding decisions in tree swallows (Tachycineta bicolor)". Behavioral Ecology and Sociobiology. 49 (2–3): 170–175. doi:10.1007/s002650000290. ISSN 0340-5443. S2CID 25507198.
- ^ a b St. Louis, Vincent L.; Breebaart, Loes (1991). "Calcium supplements in the diet of nestling tree swallows near acid sensitive lakes". The Condor. 93 (2): 286–294. doi:10.2307/1368944. ISSN 0010-5422. JSTOR 1368944.
- ^ Vleck, Carol M.; Vleck, David; Palacios, Maria G. (2011). "Evolutionary ecology of senescence: a case study using tree swallows, Tachycineta bicolor". Journal of Ornithology. 152 (S1): 203–211. doi:10.1007/s10336-010-0629-2. ISSN 0021-8375. S2CID 25321642.
- ^ Haussmann, Mark F.; Winkler, David W.; Vleck, Carol M. (22 June 2005). "Longer telomeres associated with higher survival in birds". Biology Letters. 1 (2): 212–214. doi:10.1098/rsbl.2005.0301. ISSN 1744-9561. PMC 1626238. PMID 17148169.
- ^ Belmaker, Amos (2016). "Patterns of co-variation of telomere length, condition, life history and fitness in a short-lived bird species". The Role of Telomere Length in Tree Swallow Behavior and Life History (PhD). Cornell University.
- ^ Belmaker, Amos; Hallinger, Kelly K.; Glynn, Rebbeca A.; Winkler, David W.; Haussmann, Mark F. (2019). "The environmental and genetic determinants of chick telomere length in tree swallows (Tachycineta bicolor)". Ecology and Evolution. 9 (14): 8175–8186. doi:10.1002/ece3.5386. ISSN 2045-7758. PMC 6662556. PMID 31380080.
- ^ a b c d e Winkler, D. W.; Hallinger, K. K.; Ardia, D. R.; R., R., R., R., R., R., R., R., R., R., R., R., R., R., R., R., R., R., R., R.풀, 에프 에드 "트리 스왈로 (타키시네타 바이콜로)"북아메리카의 새들.뉴욕 이타카: 코넬의 조류학 연구소.
- ^ Zach, Reto; Mayoh, Keith R. (1984). "Gamma radiation effects on nestling tree swallows". Ecology. 65 (5): 1641–1647. doi:10.2307/1939142. ISSN 0012-9658. JSTOR 1939142.
- ^ 채프먼, L. B.(1955년).'나무 제비 군락지'버드밴딩. 6: 45–70
- ^ 에링턴, P. L. (1932)"위스콘신 남부 랩터들의 음식 습성.1부올빼미". 콘도르 34 (4) : 176–186.
- ^ a b Maass, Natalia May (2019). Perceived predation risk and the responses of adult and nestling tree swallows (Tachycineta bicolor) (MS). Eastern Kentucky University.
- ^ Shutler, Dave; Mullie, Adele; Clark, Robert G (2004). "Tree swallow reproductive investment, stress, and parasites". Canadian Journal of Zoology. 82 (3): 442–448. CiteSeerX 10.1.1.530.1736. doi:10.1139/z04-016. ISSN 0008-4301.
- ^ a b Roby, Daniel D.; Brink, Karen L.; Wittmann, Karin (1992). "Effects of bird blowfly parasitism on eastern bluebird and tree swallow nestlings" (PDF). Wilson Bulletin. 104 (4): 630–643.
- ^ DeSimone, Joely G.; Clotfelter, Ethan D.; Black, Elizabeth C.; Knutie, Sarah A. (2018). "Avoidance, tolerance, and resistance to ectoparasites in nestling and adult tree swallows". Journal of Avian Biology. 49 (2): jav–01641. doi:10.1111/jav.01641. ISSN 0908-8857.
- ^ Hasselquist, Dennis; Wasson, Matthew F.; Winkler, David W. (2001). "Humoral immunocompetence correlates with date of egg-laying and reflects work load in female tree swallows". Behavioral Ecology. 12 (1): 93–97. doi:10.1093/oxfordjournals.beheco.a000384. ISSN 1465-7279.
- ^ Ardia, Daniel R. (2005). "Individual quality mediates trade-offs between reproductive effort and immune function in tree swallows". Journal of Animal Ecology. 74 (3): 517–524. doi:10.1111/j.1365-2656.2005.00950.x. ISSN 0021-8790.
- ^ Ardia, Daniel R. (2005). "Tree swallows trade off immune function and reproductive effort differently across their range". Ecology. 86 (8): 2040–2046. doi:10.1890/04-1619. ISSN 0012-9658. S2CID 33354318.
- ^ Palacios, Maria G; Cunnick, Joan E; Winkler, David W; Vleck, Carol M (2007). "Immunosenescence in some but not all immune components in a free-living vertebrate, the tree swallow". Proceedings of the Royal Society B: Biological Sciences. 274 (1612): 951–957. doi:10.1098/rspb.2006.0192. ISSN 0962-8452. PMC 2141670. PMID 17251097.
- ^ Palacios, Maria G.; Winkler, David W.; Klasing, Kirk C.; Hasselquist, Dennis; Vleck, Carol M. (2011). "Consequences of immune system aging in nature: a study of immunosenescence costs in free-living tree swallows". Ecology (Submitted manuscript). 92 (4): 952–966. doi:10.1890/10-0662.1. ISSN 0012-9658. PMID 21661557.
- ^ "Migratory Bird Treaty Act Protected Species (10.13 List)". US Fish & Wildlife Service. 2013. Retrieved 4 June 2018.
- ^ "Birds protected under the Migratory Birds Convention Act". Government of Canada. 2017. Archived from the original on 20 May 2019. Retrieved 21 July 2018.
- ^ Wiebe, Karen L. (2016). "Interspecific competition for nests: Prior ownership trumps resource holding potential for mountain bluebird competing with tree swallow". The Auk. 133 (3): 512–519. doi:10.1642/AUK-16-25.1. ISSN 0004-8038.
- ^ Finch, Deborah M. (1990). "Effects of predation and competitor interference on nesting success of house wrens and tree swallows". The Condor. 92 (3): 674–687. doi:10.2307/1368686. ISSN 0010-5422. JSTOR 1368686.
- ^ Smits, Judit E.; Wayland, Mark E.; Miller, Michael J.; Liber, Karsten; Trudeau, Suzanne (2000). "Reproductive, immune, and physiological end points in tree swallows on reclaimed oil sands mine sites". Environmental Toxicology and Chemistry. 19 (12): 2951–2960. doi:10.1002/etc.5620191216. ISSN 0730-7268.
- ^ Gentes, Marie-Line; Waldner, Cheryl; Papp, Zsuzsanna; Smits, Judit E.G. (2006). "Effects of oil sands tailings compounds and harsh weather on mortality rates, growth and detoxification efforts in nestling tree swallows (Tachycineta bicolor)". Environmental Pollution. 142 (1): 24–33. doi:10.1016/j.envpol.2005.09.013. ISSN 0269-7491. PMID 16297515.
- ^ Godwin, Christine M.; Barclay, Robert M. R.; Smits, Judit E. G. (2019). "Tree swallow (Tachycineta bicolor) nest success and nestling growth near oil sands mining operations in northeastern Alberta, Canada". Canadian Journal of Zoology. 97 (6): 547–557. doi:10.1139/cjz-2018-0247. ISSN 0008-4301.
- ^ Hallinger, Kelly K.; Cristol, Daniel A. (2011). "The role of weather in mediating the effect of mercury exposure on reproductive success in tree swallows". Ecotoxicology. 20 (6): 1368–1377. doi:10.1007/s10646-011-0694-1. ISSN 0963-9292. PMID 21553259. S2CID 42492417.
- ^ Winkler, David W.; Luo, Miles K.; Rakhimberdiev, Eldar (September 2013). "Temperature effects on food supply and chick mortality in tree swallows (Tachycineta bicolor)". Oecologia. 173 (1): 129–138. Bibcode:2013Oecol.173..129W. doi:10.1007/s00442-013-2605-z. ISSN 0029-8549. PMC 3751296. PMID 23468236.
- ^ Shipley, J. Ryan; Twining, Cornelia W.; Taff, Conor C.; Vitousek, Maren N.; Flack, Andrea; Winkler, David W. (28 September 2020). "Birds advancing lay dates with warming springs face greater risk of chick mortality". Proceedings of the National Academy of Sciences. 117 (41): 25590–25594. doi:10.1073/pnas.2009864117. ISSN 0027-8424. PMC 7568286. PMID 32989166. S2CID 222159036.
외부 링크
| 위키미디어 커먼즈에는 트리 제비와 관련된 미디어가 있다. |
| 위키피아는 타치시네타 바이콜로와 관련된 정보를 가지고 있다. |











