공정화학
Process chemistry공정화학은 의약품 개발 단계를 위한 화합물을 제조하기 위한 합성 계획 및 시험 플랜트 절차의 개발 및 최적화와 관련된 제약 화학의 힘이다. 공정화학은 초기 약물 발견 단계에서 분자를 소규모로 설계하고 합성하는 역할을 하는 제약 화학의 팔인 약용화학과는 구별된다.
약용 화학자들은 (대개 SAR 연구를 위해) 쉽게 조절할 수 있는 화학적 구성 요소로부터 가능한 한 빨리 많은 화합물을 합성하는 것에 크게 관심을 두고 있다. 일반적으로 발견 화학에 활용되는 반응의 레퍼토리는 다소 협소하다(예를 들어, 부흐발트-하트위그 아미네이션, 스즈키 커플링, 환원 아미네이션은 일반적인 반응이다).[1] 이와는 대조적으로 공정 화학자는 안전하고, 비용 및 노동 효율적이며, "친환경"하며, 다른 고려사항 중에서도 재현 가능한 화학적 과정을 식별해야 한다. 종종, 공정 화학자들은 가장 짧고 가장 효율적인 합성 경로를 찾기 위해 값비싼 기능 그룹 조작과 산화/감소 단계를 제거하는 창의적인 합성 솔루션을 고안해야 한다.
이 기사는 소분자 약품의 생산과 관련된 화학 및 제조 공정에만 초점을 맞추고 있다. 생물학적 의료 제품(더 흔히 "생물학"이라고 함)은 승인된 치료법의 증가하는 비율을 나타내지만, 이러한 제품의 제조 과정은 이 글의 범위를 벗어난다. 또한 화학 플랜트 엔지니어링(예: 열 전달 및 원자로 설계) 및 약물 제형과 관련된 많은 복잡한 요소도 커서 처리될 것이다.
공정화학에 대한 고찰
공정 화학에서 비용 효율성은 가장 중요하며, 따라서 시험 공장 합성 경로를 고려하는 데 초점이 맞춰져 있다. 제조된 의약품은 제제 전에 일반적으로 활성제약성분(API)이라고 하며, 여기에서 이와 같이 언급될 것이다. API 생산원가는 "재료비"와 "전환비"의 두 가지 요소로 나눌 수 있다.[2] 합성 공정의 생태학적 및 환경적 영향도 적절한 측정 기준(예: EcoScale)으로 평가해야 한다.
이상적인 공정 화학적 경로는 각 측정 기준에서 좋은 점수를 얻을 수 있지만 불가피하게 절충이 예상된다. 대부분의 대형 제약 공정 화학 및 제조 부서는 주어진 합성 경로의 다른 경로에 대한 전체적인 매력을 측정하기 위해 가중 정량적 방법을 고안했다. 원가가 주요 동력이기 때문에 재료 비용과 볼륨 시간 산출물은 일반적으로 가중치가 크다.
재료비
화학 공정의 재료 비용은 외부 공급 업체로부터 조달한 모든 원료, 중간자, 시약, 용매 및 촉매의 원가를 합한 것이다. 재료 비용은 다른 노선에 대한 하나의 합성 경로의 선택이나 중간 생산의 아웃소싱 결정에 영향을 미칠 수 있다.
전환원가
화학 공정의 전환 비용은 재료와 시간, 그리고 그 재현성의 한 요인이다. 화학 공정의 효율성은 원자 경제, 수율, 대량 생산량, 환경 인자(E-factor)로 정량화할 수 있으며 재현성은 품질 서비스 수준(QSL)과 공정 우수 지수(PEI) 지표로 평가할 수 있다.
원자경제
반작용의 원자경제는 최종 산물에 통합된 시작 물질에서 나오는 원자의 수로 정의된다. 원자 경제는 주어진 합성 경로의 "효율성"을 나타내는 지표로 볼 수 있다.[3]
예를 들어 클라이센 재배열과 디엘-알데르 사이클로어데이션은 100% 원자경제적인 반응의 예다. 반면, Wittig의 원형 반응은 특히 원자 경제가 좋지 않다(그림의 예에서 20% 이상).
공정 합성 경로는 전체 합성 계획에서 원자 경제가 극대화되도록 설계되어야 한다. 따라서 가능한 경우 보호 그룹과 높은 분자량 이탈 그룹과 같은 "비용상" 시약은 피해야 한다. API 합성에 대한 70~90% 범위의 원자 경제 값은 이상적이지만, 이 범위 내의 특정 복잡한 대상에 접근하는 것은 비현실적이거나 불가능할 수 있다. 그럼에도 불구하고, 원자 경제는 두 경로를 같은 분자와 비교하기에 좋은 척도다.
양보
수율은 화학 반응에서 얻은 제품의 양으로 정의된다. 공정 화학에서 실질적인 유의성의 수율은 격리된 수율, 즉 모든 정화 단계 후 격리된 제품의 수율이다.[citation needed] 최종 API 합성에서는 각 합성 단계에 대해 80% 이상의 격리된 수율이 예상된다.[citation needed] 허용 가능한 수율의 정의는 제품의 중요성과 가용 기술이 결합하여 효율적으로 적용할 수 있는 방법에 전적으로 달려 있다. 100%에 가까운 수율을 정량적이라 하며, 90% 이상의 수율은 대체로 우수하다고 이해한다.[4]
제약 제품의 적절한 전체 수율을 보장하기 위해 공정 경로 설계에 사용되는 몇 가지 전략이 있다. 첫째는 수렴합성의 개념이다. 각 합성 단계에서 매우 우수하고 우수한 수율을 가정하면, 서로 독립적으로 준비된 후기 단계에서 여러 개의 핵심 매개체를 결합함으로써 다단계 반응의 전체적인 수율을 극대화할 수 있다.
고립된 수율(시간 효율성뿐만 아니라)을 극대화하기 위한 또 다른 전략은 망원경 합성의 개념(일항 합성이라고도 한다)이다. 이 접근방식은 일반적으로 원자로에 순차적으로 시약을 추가하는 것만으로 반응 시퀀스에서 작업 및 정화 단계를 제거하는 과정을 설명한다. 이렇게 하면 이러한 단계에서 불필요한 손실을 피할 수 있다.
마지막으로 전체 비용을 최소화하기 위해 고가의 시약, 용제 또는 촉매와 관련된 합성 단계를 가능한 한 늦게 공정 경로에 설계하여 시약 사용량을 최소화해야 한다.
파일럿 플랜트 또는 제조 플랜트 설정에서 수율은 API 합성 재료 비용에 심대한 영향을 미칠 수 있으므로, 강력한 경로의 세심한 계획과 반응 조건의 미세 조정이 결정적으로 중요하다. 합성 경로를 선택한 후 공정 화학자는 전체 수율을 극대화하기 위해 각 단계를 철저히 최적화할 것이다. 낮은 수율은 일반적으로 원하지 않는 측면 제품 형성을 나타내며, 이는 규제 프로세스에서 적기를 발생시킬 수 있을 뿐만 아니라 원자로 청소 작업에 어려움을 줄 수 있다.
볼륨 시간 출력
화학 공정의 볼륨 시간 출력(VTO)은 특정 공정 또는 API 합성에 대한 화학 원자로의 점유 비용을 나타낸다. 예를 들어, 높은 VTO는 특정 합성 단계가 주어진 출력에 사용되는 "반응자 시간" 측면에서 비용이 많이 든다는 것을 나타낸다. 수학적으로 특정 공정에 대한 VTO는 배치당 시간(m)을 해당 API 또는 중간(kg으로 측정)의 출력으로 나눈 모든 원자로의 총 용량(m3)에 의해 계산된다.
예를 들어, Boehringer Ingelheim의 프로세스 화학 그룹은 주어진 합성 단계 또는 화학 공정에서 1 미만의 VTO를 목표로 한다.
또한 특정 원자로의 운용 비용과 가용 용량을 고려하여 API 합성(배치당 달러 단위)의 원시 변환 비용을 VTO에서 계산할 수 있다. 대량의 API의 경우 일반 파일럿 플랜트나 제조 플랜트의 공간을 이용하는 것보다 전용 생산 플랜트를 구축하는 것이 경제적인 경우가 많다.
환경 계수(e-factor) 및 공정 질량 강도(PMI)
합성 반응의 환경적 영향을 포착하는 이 두 조치 모두 제조 과정에서 폐기물 처리의 중요하고 상승하는 비용을 포착하려는 것이다. 전체 API 프로세스에 대한 E-요인은 합성 계획에서 생성되는 총 폐기물 질량과 격리된 제품의 질량의 비율로 계산된다.
유사한 측정값인 공정 질량 강도(PMI)는 격리된 제품의 질량에 대한 재료 총 질량의 비율을 계산한다.
두 측정기준 모두 실제 용매나 촉매를 재활용하더라도 반응 및 작업용제, 시약 및 촉매 등 모든 합성 단계에 사용되는 모든 물질을 계산한다. 아웃소싱 중간자 또는 일반 시약의 합성과 관련된 낭비를 고려할 때 E-요인 또는 PMI 계산의 불일치가 발생할 수 있다. 또한, 발생 폐기물의 환경 영향은 이 계산에서 무시되므로, E-요인에 다양한 폐기물 흐름과 관련된 "비우호성 지수"를 곱한 환경 지수(EQ) 지표가 고안되었다. 단일 합성 단계의 E-요인 또는 PMI에 대한 타당한 목표는 10에서 40 사이의 값이다.
품질서비스수준(QSL)
최종 2가지 "전환 비용" 고려사항은 주어진 반응 또는 API 합성 경로의 재현성을 포함한다. 품질서비스 수준(QSL)은 격리된 중간 또는 최종 API의 품질 재현성의 척도다. 이 값을 계산하는 세부사항은 이 글의 목적상 약간 뉘앙스가 있고 중요하지 않지만, 본질적으로 계산에는 총 배치 수에 대한 만족스러운 품질 배치의 비율이 포함된다. 합리적인 QSL 목표는 98~100%이다.
공정우수지수(PEI)
QSL과 마찬가지로 공정 우수지수(PEI)는 공정 재현성의 척도다. 그러나 여기서 절차의 강건성은 다양한 운영의 수율과 주기 시간 측면에서 평가된다. PEI 수익률은 다음과 같이 정의된다.
실제로 공정이 고수익이고 산출 결과의 분포가 좁다면 PEI는 매우 높아야 한다. 쉽게 재현할 수 없는 공정은 흡인 수준 수율이 높고 평균 수율이 낮아 PEI 수율이 낮아질 수 있다.
마찬가지로, PEI 사이클 시간은 다음과 같이 정의될 수 있다.
이 표현식의 경우, 더 짧은 주기 시간의 만족도를 반영하기 위해 (수율이 더 높은 것과는 대조적으로) 항을 반전한다. 반응, 원심분리 또는 건조와 같은 중요한 공정에 대한 사이클 타임의 재현성은 제조공장 설정에서 속도 제한이 있는 경우 매우 중요할 수 있다. 예를 들어, 격리 단계가 특히 어렵거나 느리면 API 합성을 위한 병목 현상이 될 수 있으며, 이 경우 해당 작업의 재현성과 최적화가 중요해진다.
API 제조 프로세스의 경우, 모든 PEI 지표(수익 및 주기 시간)는 98 ~ 100%를 목표로 해야 한다.
에코스케일
2006년,[5] Van Aken 등에서는 실용적이고 경제적인 고려사항의 사소한 가중치뿐만 아니라 화학적 과정의 안전성과 생태학적 영향을 평가하기 위한 정량적 프레임워크를 개발했다. 다른 이들은 다양한 측정 기준의 가중치를 추가, 빼기, 조정하여 이 EcoScale을 수정했다. 다른 요인 중 EcoScale은 사용된 시약의 독성, 가연성 및 폭발적 안정성, 비표준 또는 잠재적으로 위험한 반응 조건(예: 압력 상승 또는 불활성 대기) 및 반응 온도를 고려한다. 일부 EcoScale 기준은 이전에 고려된 기준(예: E-요인)과 중복된다.
합성 사례 연구
Boehringer Ingelheim HCV 프로테아제 억제제 (BI 201302)
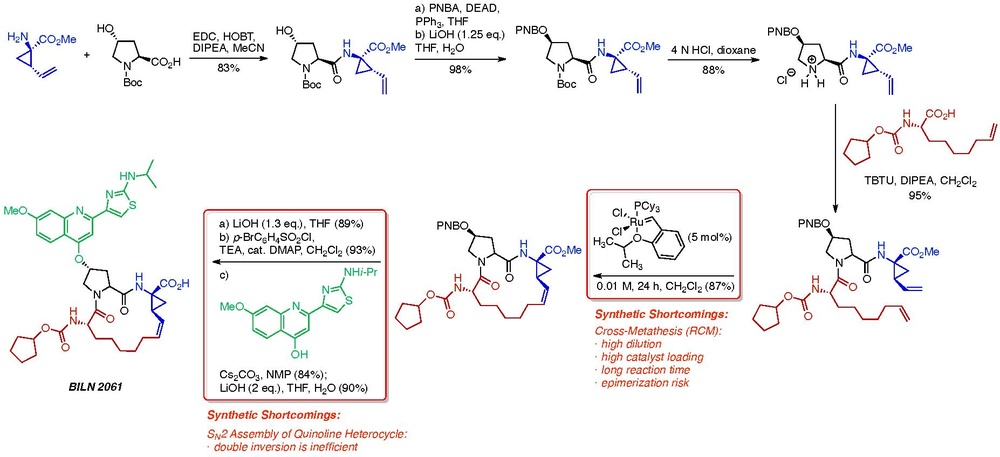
매크로사이클화는 공정화학자들에게 반복적인 도전으로, 대형 제약사들은 이런 내재된 한계를 극복하기 위해 반드시 창의적인 전략을 개발해 왔다. 이 분야의 흥미로운 사례 연구는 Boehringer Ingelheim의 과학자들이 C형 간염 환자를 치료하기 위한 NS3 프로테아제 억제제의 개발을 포함한다.[6] BI의 프로세스 화학 팀은 BLN 2061과 유사한 활성 NS3 억제제 BI 201302로 가는 더 저렴하고 효율적인 경로를 개발하는 임무를 맡았다. 아래 계획에 설명된 BLN 2061로의 초기 스케일업 경로에서 두 가지 중요한 단점이 즉시 확인되었다.[7] 거시경제화 단계는 교차표현 반응에 내재된 네 가지 과제를 내포했다.
- 일반적으로 높은 희석은 다이엔 스타팅 재료의 원치 않는 조광과 과점화를 방지하는데 필요하다. 그러나 파일럿 플랜트 환경에서 높은 희석 계수는 처리량이 낮고 용제 비용이 높으며 폐기물 비용이 더 높은 것으로 해석된다.
- RCM 반응을 완료로 구동하기 위해 높은 촉매 부하가 필요한 것으로 확인됨 사용된 루테늄 촉매(1세대 호베이다 촉매)의 높은 라이센스 비용 때문에 높은 촉매 하중은 재정적으로 금지되었다. 촉매의 재활용은 탐구되었지만 비실용적인 것으로 판명되었다.
- 선택된 촉매를 사용한 반응의 운동학적 속도가 느리기 때문에 반응 완료에 긴 반응 시간이 필요했다. 이러한 한계를 보다 능동적인 촉매를 사용하여 극복할 수 있다는 가설이 제기되었다. 그러나 2세대 호베이다와 그럽스 촉매들이 1세대 촉매보다 운동적으로 더 활동적인 반면, 이러한 촉매들을 이용한 반응은 다량의 조광성 및 과두성 제품을 형성했다.
- 교차측정 반응 조건에서의 경시화 위험. Boehringer Ingelheim의 프로세스 화학 그룹은 광범위한 기계론적 연구를 수행했고, 인식은 대부분 루테나시클로펜틴 중간을 통해 발생한다는 것을 보여주었다.[8] 또한 이 계획에 채택된 호베이다 촉매는 유사한 그럽스 촉매와 비교하여 경구화 위험을 최소화한다.
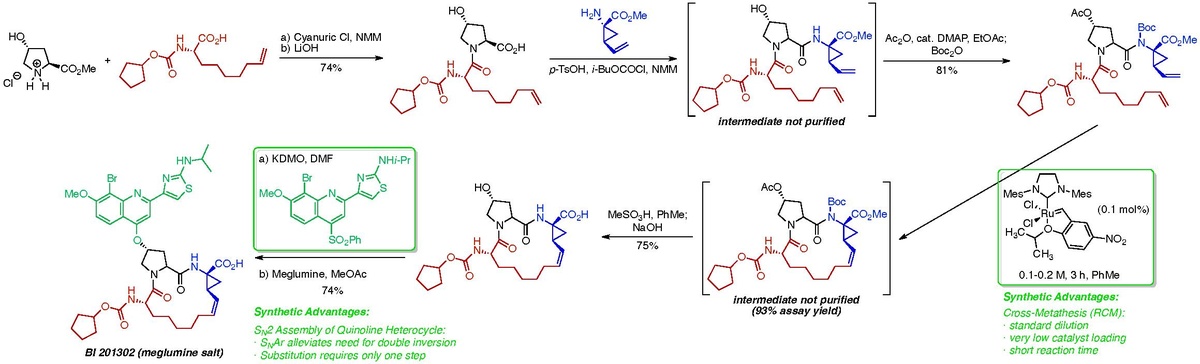
또한, 퀴놀린 이성애자를 설치하기 위한 최종 이중 S2N 시퀀스는 합성 경로에서 2차 비효율성으로 확인되었다.
교차방정반응을 분석한 결과, 반복전구체의 순응이 반응 혼합물의 조광기와 과점 형성에 심대한 영향을 미친다는 것이 밝혀졌다. Boehringer Ingelheim 화학자들은 C-4 아미드 질소에 보크 보호 그룹을 설치함으로써 시작 부지를 비닐사이클로프로판 모이티에서 비에노산 모이티로 이동시킬 수 있게 되어, 근육내 반응의 속도를 향상시키고 경구화 위험을 줄일 수 있었다. 또한 사용된 촉매는 값비싼 1세대 호베이다 촉매에서 반응성이 좋고 가격이 저렴한 그레라 촉매로 전환되었다.[9] 이러한 수정은 경쟁적 조광반응과 과점반응의 비율이 매우 극적으로 감소되었다는 점에서 공정화학자들이 0.1-0.2 M의 표준반응 희석 상태에서 반응을 실행할 수 있게 했다.
또한, 공정 화학 팀은 그들이 BLN 2061의 합성을 위해 고용한 S2N 전략 대신에 퀴놀린 이성애자를 설치하는 SARN 전략을 구상했다. 이 수정은 히드록시프로라인 계통의 C-4 위치에서 스테레오 화학의 보존을 진행함으로써 비효율적인 이중 역전의 필요성을 방지했다.[10]
이 사례 연구를 VTO 관점에서 검토하는 것은 흥미롭다. 0.01 M diene에서 Grela 촉매를 사용한 최적화되지 않은 교차-금속 반응의 경우 반응과 48시간의 작업 시간이 지난 후 반응 수율은 82%로 결정되었다. 용량의 80%까지 채워진 6-큐빅 미터 원자로는 35 kg의 원하는 제품을 제공했다. 최적화되지 않은 대응의 경우:
이러한 VTO 가치는 엄청나게 높은 것으로 간주되었으며, 연간 예상 수요가 크다는 점을 감안할 때, 이 API로 3단계 시험을 시작하기 전에도 전용 공장에 대한 가파른 투자가 필요했을 것이다. 그러나 반응 개발 및 최적화 후 공정팀은 0.2M의 다이엔 농도로 1시간(작업 및 원자로 청소 시간 12시간 추가) 만에 반응 수율을 93%로 개선할 수 있었다. 이러한 변경으로, 용량 80%까지 채워진 6-큐빅 미터 원자로는 799 kg의 원하는 제품을 제공했다. 이러한 최적화된 대응의 경우:
따라서 최적화 후 이 합성 단계는 장비와 시간 면에서 비용이 적게 들고 표준 제조 시설에서 수행하는 것이 더욱 실용적이 되어 새로운 전용 공장에 고가의 투자가 필요 없게 되었다.
추가 항목
전이 측정 촉매 및 장기 투석
생체투석 및 효소공학
최근 대형 제약 공정 화학자들은 API 합성을 위한 중요한 치랄 구성 요소를 생산하기 위해 효소 반응의 개발에 크게 의존하고 있다. 자연적으로 발생하는 효소의 많은 다양한 등급이 공정 제약 화학 적용을 위해 공동 선택되고 설계되었다. 가장 광범위한 용도는 케토렐라제, 트랜스아미나제 등에서 나오지만, 그 중에서도 하이드롤라제, 알돌라제, 산화효소, 에스테라제, 탈할로네제 등에서는 격리된 예가 있다.[11]
오늘날 공정 화학에서 생물학적 투석의 가장 두드러진 사용 중 하나는 제2형 당뇨병의 관리를 위해 Merck가 개발한 DPP-4 억제제인 Januvia®의 합성이다. 전통적인 프로세스 합성 루트는 API 시타글립틴을 공급하기 위해 로듐을 이용한 비대칭 수소화에 이어 후반 단계의 에나민 형성을 수반했다. 이 과정은 고압 수소 환경에서 반응을 실행해야 하는 필요성, 전이-금속 촉매의 높은 비용, 미량의 촉매를 제거하기 위한 탄소 처리의 어려운 과정, 불충분한 입체성 등 여러 가지 한계로 인해 어려움을 겪었으며, f에 앞서 후속 재분산 단계가 필요했다.소금의 내부 [12][13]형성
머크의 공정 화학 부서는 시타글립틴 합성의 마지막 단계를 위한 대규모 생물학적 분석 환원성 아미네이션을 개발하기 위해 중형 생석회화 회사인 코덱시스와 계약했다. 코덱시스는 11번의 방향 진화를 통해 아스테로박터 박테리아에서 나온 트랜스아미노효소 효소를 조작했다. 공학적 트랜스아미노효소는 27개의 개별적인 포인트 돌연변이를 포함했고 모효소보다 4배 더 큰 활동을 보였다. 또한, 효소는 높은 기질 농도(100 g/L)를 처리하고, 트랜스매이션 반응의 유기 용매, 시약 및 부산물을 견딜 수 있도록 설계되었다. 이 생체분석 경로는 화학분석 수소화 경로의 한계를 성공적으로 피했다. 즉, 고압에서 반응을 실행하고 탄소처리에 의한 과잉 촉매 제거와 불충분한 항억제성으로 인한 제품 재분산 요구조건은 생체촉매를 사용함으로써 제거되었다. Merck와 Codexis는 Januvia®[14]로 향하는 이 생물학적 분석적 경로의 개발로 2010년 대통령 그린 케미 챌린지 상을 받았다.
연속/흐름 제조
최근에는 소규모 화학 합성을 위한 유량 원자로의 개발과 최적화에 많은 진전이 있었다(MIT의 재미슨 그룹과 케임브리지 대학의 레이 그룹, 그 중에서도 이 분야의 노력을 개척했다). 그러나 제약업계는 대규모 합성작업에 이 기술을 채택하는 데 더디게 움직였다. 그러나 특정 반응의 경우, 연속적인 처리에는 배치 처리보다 안전성, 품질 및 처리량의 측면에서 뚜렷한 장점이 있을 수 있다.
특별한 관심의 한 사례 연구, a에서 완전히 연속 공정의 엘리릴리 앤드 컴퍼니에서 해당 프로세스를 화학 그룹에 의해 비대칭 수소 첨가 LY500307,[15]의 합성. 정신 분열증 환자들의 치료를 위해 임상 실험에 뛰어드는 것은 강력한 ERβ 모두의 효능 제이다에서 핵심 중간에 액세스 하는 데로 개발이 포함한다ddit표준 항정신병 약물의 양생에 이온. 이 핵심 합성 단계에서는 치랄 로듐 촉매제가 사분해 올레핀의 항항체 감소를 위해 사용된다. 광범위한 최적화 후, 촉매 하중을 상업적으로 실용적인 수준으로 줄이기 위해, 반응은 최대 70 atm까지 수소 압력을 필요로 한다는 것을 발견했다. 100 atm까지의 반응에 대해 상당한 자본 비용으로 고압 배치 원자로를 취득할 수 있지만, 표준 화학 원자로의 압력 한계는 약 10 atm이다. 특히 화학 개발 초기 단계의 API의 경우 그러한 투자는 분명히 큰 위험을 안고 있다.
또 다른 우려는 수소화 제품이 비우호적 지질학적 포인트를 갖고 있어 일괄 공정으로 94% ee 이상에서 원유 중간을 분리할 수 없다는 점이었다. 이러한 한계 때문에, LY500307로 향하는 공정 화학 경로는 반드시 수소화 후 운동적으로 제어되는 결정화 단계를 수반하여 이 펜ultimate 중간의 불순도를 99% ee로 업그레이드하였다.
Eli Lilly의 프로세스 화학 팀은 반응, 작업 및 운동 제어 결정 모듈을 포함한 이 펜ultimate 중간 공정을 완전히 연속적으로 개발하는 데 성공하였다(이러한 노력에 내재된 엔지니어링 고려사항은 이 글의 범위를 벗어난다). 유량형 원자로의 장점은 고압 배관이 수소화 및 기타 고압 반응에 활용될 수 있다는 점이다. 그러나 배치형 원자로의 머리 공간은 제거되기 때문에, 고압 반응의 작동과 관련된 많은 안전 우려는 연속 공정 원자로의 사용에 의해 제거된다. 또한 2단 혼합 서스펜션 혼합 제품 제거(MSMPR) 모듈은 제품의 확장성이 뛰어나고 지속적이며 운동적으로 제어되는 결정화를 위해 설계되었기 때문에 >99% ee에서 격리할 수 있어 추가 배치 결정 단계가 필요하지 않았다.
이 연속 공정은 86%의 수율에서 핵심 중간값의 144kg을 제공했는데, 이는 배치 공정을 사용한 90%의 격리 수율과 비견된다. 이 73리터 규모의 파일럿 규모 유량 원자로(공간 0.5m3 이하를 점유)는 400리터 원자로에서 이론적 일괄 처리와 동일한 주간 처리량을 달성했다. 따라서, 연속적인 흐름 프로세스는 이론적인 배치 프로세스와 비교하여 안전성, 효율성(배치 결정의 필요성을 제거함) 및 처리량의 장점을 보여준다.
공정화학분야 학술연구기관
리즈 대학교 프로세스 연구 개발 연구소
참조
- ^ Roughley, S. D.; Jordan, A. M. (2011). "The medicinal chemist's toolbox: an analysis of reactions used in the pursuit of drug candidates". J. Med. Chem. 54 (10): 3451–79. doi:10.1021/jm200187y. PMID 21504168.
- ^ Dach, R.; Song, J. J.; Roschangar, F.; Samstag, W.; Senanayake, C. H. (2012). "The eight criteria defining a good chemical manufacturing process". Org. Process Res. Dev. 16 (11): 1697–1706. doi:10.1021/op300144g.
- ^ Trost, B. M. (1991). "The atom economy - a search for synthetic efficiency". Science. 254 (5037): 1471–7. Bibcode:1991Sci...254.1471T. doi:10.1126/science.1962206. PMID 1962206.
- ^ 학문적 관점에서 볼 때, 푸로리스 외 연구진은 100%의 수율을 정량적, 90% 이상의 수율, 80% 이상의 수율, 70% 이상의 수율, 70% 이상의 수율, 50% 이상의 수율을 정량적, 미미한 수율이라고 설명한다.[citation needed]
- ^ Van Aken, K.; Strekowski, L.; Patiny, L. (2006). "EcoScale, a semi-quantitative tool to select an organic preparation based on economical and ecological parameters". Beilstein J. Org. Chem. 2 (3): 3. doi:10.1186/1860-5397-2-3. PMC 1409775. PMID 16542013.
- ^ Faucher, A-M.; Bailey, M. D.; Beaulieu, P. L.; Brochu, C.; Duceppe, J-S.; Ferland, J-M.; Ghiro, E.; Gorys, V.; Halmos, T.; Kawai, S. H.; Poirier, M.; Simoneau, B.; Tsantrizos, Y. S.; Llinas-Brunet, M. (2004). "Synthesis of BILN 2061, an HCV NS3 protease inhibitor with proven antiviral effect in humans". Org. Lett. 6 (17): 2901–2904. doi:10.1021/ol0489907. PMID 15330643.
- ^ Yee, N. K.; Farina, V.; Houpis, I. N.; Haddad, N.; Frutos, R. P.; Gallou, F.; Wang, X-J.; Wei, X.; Simpson, R. D.; Feng, X.; Fuchs, V.; Xu, Y.; Tan, J.; Zhang, L.; Xu, J.; Smith-Keenan, L. L.; Vitous, J.; Ridges, M. D.; Spinelli, E. M.; Johnson, M. (2006). "Efficient large-scale synthesis of BILN 2061, a potent HCV protease inhibitor, by a convergent approach based on ring-closing metathesis". J. Org. Chem. 71 (19): 7133–7145. doi:10.1021/jo060285j. PMID 16958506.
- ^ Zeng, X.; Wei, X.; Farina, V.; Napolitano, E.; Xu, Y.; Zhang, L.; Haddad, N.; Yee, N. K.; Grinberg, N.; Shen, S.; Senanayake, C. H. (2006). "Epimerization reaction of a substituted vinylcyclopropane catalyzed by ruthenium carbenes: mechanistic analysis". J. Org. Chem. 71 (23): 8864–8875. doi:10.1021/jo061587o. PMID 17081017.
- ^ Grela, K.; Harutyunyan, S.; Michrowska, A. (2002). "A highly efficient ruthenium catalyst for metathesis reactions" (PDF). Angew. Chem. Int. Ed. 41 (21): 4038–4040. doi:10.1002/1521-3773(20021104)41:21<4038::aid-anie4038>3.0.co;2-0. hdl:11370/969f537e-6d3b-425c-abfa-1b41e7d0e330. PMID 12412074.
- ^ Wei, X.; Shu, C.; Haddad, N.; Zeng, X.; Patel, N. D.; Tan, Z.; Liu, J.; Lee, H.; Shen, S.; Campbell, S.; Varsolona, R. J.; Busacca, C. A.; Hossain, A.; Yee, N. K.; Senanayake, C. H. (2013). "A highly convergent and efficient synthesis of a macrocyclic hepatitis C virus protease inhibitor BI 201302". Org. Lett. 15 (5): 1016–1019. doi:10.1021/ol303498m. PMID 23406520.
- ^ Bornscheuer, U. T.; Huisman, G. W.; Kazlauskas, R. J.; Lutz, S.; Moore, J. C.; Robins, K. (2012). "Engineering the third wave of biocatalysis". Nature. 485 (7397): 185–94. Bibcode:2012Natur.485..185B. doi:10.1038/nature11117. PMID 22575958. S2CID 4379415.
- ^ Savile, C. K.; Janey, J. M.; Mundorff, E. C.; Moore, J. C.; Tam, S.; Jarvis, W. R.; Colback, J. C.; Krebber, A.; Fleitz, F. J.; Brands, J.; Devine, P. N.; Huisman, G. W.; Hughes, G. J. (2010). "Biocatalytic asymmetric synthesis of chiral amines applied to sitagliptin manufacture". Science. 329 (5989): 305–309. doi:10.1126/science.1188934. PMID 20558668. S2CID 21954817.
- ^ Desai, A. A. (2011). "Sitagliptin manufacture: a compelling tale of green chemistry, process intensification, and industrial asymmetric catalysis". Angew. Chem. Int. Ed. 50 (9): 1974–1976. doi:10.1002/anie.201007051. PMID 21284073.
- ^ Busacca, C. A.; Fandrick, D. R.; Song, J. J.; Sananayake, C. H. (2011). "The growing impact of catalysis in the pharmaceutical industry". Adv. Synth. Catal. 353 (11–12): 1825–1864. doi:10.1002/adsc.201100488.
- ^ Johnson, M. D.; May, S. A.; Calvin, J. R.; Remacle, J.; Stout, J. R.; Dieroad, W. D.; Zaborenko, N.; Haeberle, B. D.; Sun, W-M.; Miller, M. T.; Brannan, J. (2012). "Development and scale-up of a continuous, high-pressure, asymmetric hydrogenation reaction, workup, and isolation". Org. Process Res. Dev. 16 (5): 1017–1038. doi:10.1021/op200362h.


![An illustrative example of convergent synthesis {\displaystyle {\begin{array}{|r|r|r|}\hline &{\text{Illustrative Example}}&{\text{Overall Yield}}\\\hline \color {BrickRed}{\text{Linear Synthesis}}&{\ce {A ->[85\%] B ->[85\%] C ->[85\%] Product}}&\color {BrickRed}{61.4\%}\\\hline \color {PineGreen}{\text{Convergent Synthesis}}&\left.{\begin{matrix}{\ce {A ->[85\%] B}}\\{\ce {D ->[85\%] E}}\end{matrix}}\quad \right\}{\ce {-> Product}}&\color {PineGreen}{72.3\%}\\\hline \end{array}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6c5c7dc7065f27073d01f8a57db8d194f4baae1c)
![{\displaystyle {\text{VTO}}={\frac {{\text{nominal volume of all reactors}}[{\ce {m}}^{3}]*{\text{time per batch}}[{\ce {h}}]}{{\text{output per step}}[{\ce {kg}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c8000cea021078e77a3d9451f1684f2e176fa832)