곤충 후각
Insect olfaction곤충 후각은 곤충이 사료, 포식자 회피, 짝짓기 파트너(페로몬을 통한) 찾기, 난소 [1]서식지를 찾기 위해 휘발성 화합물을 검출하고 식별할 수 있도록 하는 화학 수용체의 기능을 말한다.그러므로,[1] 그것은 곤충들에게 가장 중요한 감각이다.대부분의 중요한 곤충들의 행동은 그들이 무엇을 맡고 언제 [2]냄새를 맡느냐에 따라 완전히 시간을 맞춰야 한다.예를 들어, 후각은 나방 Deilephila Elpenor와 말벌 Polybia sericea와 같은 많은 종류의 곤충에서 숙주 식물을 찾고 먹이를 사냥하는데 필수적입니다.
곤충들이 냄새를 감지하기 위해 주로 사용하는 두 개의 기관은 더듬이와 상악 [3]팔뚝이라고 불리는 특별한 입 부분이다.그러나 최근의 연구는 무화과 [4]말벌에서 난소포자의 후각 역할을 증명했다.후각 기관 안에는 후각 수용체 뉴런이라고 불리는 뉴런이 있는데, 이름에서 알 수 있듯이, 후각 수용체 뉴런은 세포막 안에 냄새 분자에 대한 수용체를 수용합니다.후각수용체 뉴런의 대부분은 전형적으로 안테나에 있다.이 뉴런들은 매우 풍부할 수 있다; 예를 들어, 드로소필라 파리는 2,600개의 후각 [3]뉴런을 가지고 있다.
곤충들은 민감하게 [1][5]그리고 선택적으로 수천 개의 휘발성 화합물을 냄새 맡고 구별할 수 있습니다.민감성은 곤충이 아주 적은 양의 냄새제나 냄새제의 농도의 작은 변화에 적응하는 방법이다.선택성은 냄새나는 물질을 구별하는 곤충의 능력을 말한다.수혈절지동물 중 이들 화합물은 일반적으로 짧은 사슬 카르본산, 알데히드, 저분자량 질소화합물의 [5]세 종류로 나뉜다.
곤충은 포유동물, 특히 인간의 후각을 연구하기 위한 모델 시스템으로 사용되어 왔다.그러나 G단백질결합수용체(GPCR)를 사용하는 척추동물과 달리 곤충은 모두 이질적인 리간드 게이트 이온 [3]채널인 OR(후각수용체), GR(미각수용체), IR(이온성 수용체)를 포함한 단백질을 발현한다.흑삭충나방(Agrotis ipsilon)으로 알려진 나비목의 나방 종은 OBP(취기결합단백질), CSP(화학감각결합단백질), SNMP(감각뉴런막단백질)를 포함한 훨씬 더 많은 단백질을 생산하여 나방이 [6]성페로몬과 숙주식물에서 방출되는 냄새와 같은 냄새를 인식할 수 있도록 돕는다.척추동물과 마찬가지로 감각신경세포의 축삭은 사구체로 수렴하지만 사구체가 있는 곳은 다르다.포유동물에서는 후구에 있지만 곤충에서는 더듬이 [7]잎에 있습니다.
진화사
후각은 신진대사에 비용이 많이 든다.더 많은 비용이 드는 것은 이와 관련된 더 복잡한 특성입니다.2008년 Niven & Laughlin은 높은 후각 감수성이 에너지적으로 비용이 많이 든다는 것을 발견했으며, 다른 연구에 따르면 자극으로 인해 발생하는 최종 행동을 바꿀 수 있는 능력도 마찬가지인 것으로 밝혀졌다.2016년 현재[update] 대부분의 연구는 비현실적으로 신뢰할 수 있는 [8]식품을 사용하여 실험실 조건에서 이루어졌기 때문에 관련된 진화적 균형은 더 많은 연구가 필요하다.
후각 캐스케이드
안테나, 상악강 촉진, 그리고 입술의 감각 뉴런은 후각 수용체와 같은 세포 표면 단백질에 대한 냄새의 결합에 반응하여 스파이크라고 불리는 냄새 특유의 전기 신호를 생성합니다.안테나와 상악의 감각 뉴런은 축삭을 통해 더듬이엽으로 [7]이 정보를 보내는 반면, 음순의 감각 뉴런은 축삭을 통해 식도하 신경절로 [9]이 정보를 보냅니다.더듬이 잎 안에서 그들은 사구체라 불리는 반직선 구조의 다른 뉴런들과 시냅스합니다.
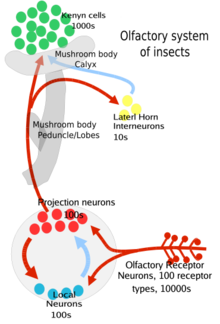
구체적으로 그 과정은 다음과 같다: 우선 냄새나는 곤충의 안테나 또는 센실라라고 [5]불리는 머리카락 같은 돌기로 덮인 상악촉진 쪽으로 흐른다.그리고 나서 그 냄새제는 감각의 외골격(또는 큐티클)의 작은 구멍을 통해 들어가 세포외액이라고 불리는 세포 사이의 [1]액체로 확산됩니다.여기서 냄새 분자는 냄새성 결합 단백질에 결합하고, 냄새성 결합 단백질은 후각수용체 뉴런(ORN)[1][3] 표면에 있는 수용체와[1] 공동수용체(Orco) 팀으로 운반한다.이것은 신경세포가 [2]축삭 아래로 활동전위를 발사하도록 이끈다.이 신호는 곤충 뇌의 더듬이엽이나 식도하 신경절로 보내지며, 곤충은 다른 감각의 다른 신호와 정보를 통합할 수 있습니다.
이 ON들은 양극성이며, 한쪽 끝에는 냄새에 대한 수용체를 가진 후각 수상돌기가 있고 다른 한쪽 끝에는 뇌의 [3]더듬이 잎에 활동 전위를 전달하는 축삭이 있습니다.더듬이 잎은 투영 뉴런과 국소 뉴런의 두 가지 종류의 뉴런을 가지고 있습니다.투영 뉴런은 축삭 말단을 버섯 몸체라고 불리는 곤충 뇌의 부분과 측면 뿔이라고[3] 불리는 뇌의 다른 부분으로 보냅니다.이 두 지역 모두 곤충 뇌의 원생대뇌의 일부입니다.
조사 방법
활동 전위 기록은 세 가지 다른 방법으로 전자안테노그램, 일렉트로팔포그램 및 싱글센실럼 기록([5]SSR)으로 수행됩니다.전기안테노그램(EAG) 및 전기안테노그램(EPG)에서는 각각 안테나 전체 또는 상악촉진으로부터의 활동전위가 기록된다.동아시아 경기와 EPG는 각각의 장기에서 [5]후각에 대한 전반적인 견해를 제공한다.SSR 중에 전극이 하나의 센실럼에만 삽입되고 해당 센실럼에 포함된 OND만으로 기록이 작성되므로 보다 자세한[5]. 정보를 얻을 수 있습니다.
이러한 방법 중 어느 것이든 고해상도 가스 크로마토그래피와 결합하여 휘발성 화합물을 중요한 동물이나 [5]서식지에서 분리할 수 있습니다.예를 들어, 이 방법은 특정 꽃의 어떤 화합물이 벌에게 가장 매력적인지를 결정하기 위해 사용될 수 있다.투영 뉴런의 기록에 따르면 일부 곤충에서는 ON에 의해 나타나는 냄새에 대한 강한 전문화와 구별이 있습니다.이것은 특히 페로몬 검출을 담당하는 사구체의 특수 복합체인 마크로글루리의 투영 뉴런에 해당된다.
기피제 및 흡인제
인간은 [3]해충을 옮기는 농업과 질병을 통제하기 위해 곤충 후각을 이용한다.일부 농업 해충의 경우 성 페로몬이 알을 낳기 전에 포획하기 위해 함정에 넣어져 파괴적인 [3]애벌레가 부화한다.곤충들이 탐지할 수 있는 화학물질이 수천 개 있는 반면, 곤충들이 냄새의 [5]원천으로부터 이동하거나 멀어지기 위한 신호로 사용하는 범위는 제한되어 있습니다.
특정 관심 곤충에 대한 유인제 또는 기피제를 찾는 기술은 복잡하고 길고 집중적인 과정입니다.예를 들어, 페로몬을 사용하는 것은 곤충의 [2]생육 단계, 즉 짧은 기간 동안만 곤충을 유인한다.음식 냄새가 배고픈 곤충들에게는 매력적일 수 있지만, 그것들은 그 [2]곤충들이 입맛에 맞는 작물이 가득한 밭에서는 효과적이지 않을 것이다.
상황에 따라 다른 유인제/반발제
곤충들은 화학적 [5]절약이라고 불리는 상황에 따라 많은 다른 용도로 같은 신호를 사용합니다.냄새에 반응하여 곤충이 어떻게 행동하는지를 바꿀 수 있는 상황은 화합물의 농도, 곤충의 수명 단계, 짝짓기 상태, 다른 후각 신호, 곤충의 먹이 상태, 하루 중 시간, 심지어 곤충의 신체 [2][3][5]위치와 같은 것입니다.예를 들어, 드로소필라는 사과 식초에 매우 끌리지만 매우 고농도에서는 추가적인 후각 수용체(식초, Or85a에 대한 친화력이 낮은)가 활성화되어 파리의 행동을 유인에서 [3]혐오로 변화시킵니다.같은 신호에 대한 이러한 다른 행동들을 행동 [2]가소성이라고 합니다.
이산화탄소
많은 곤충들이 이산화탄소2 [5]농도의 아주 미세한 변화를 감지할 수 있다.CO는 연구된 모든 절지동물에서[5] 유인물질로 발견되었고 모기 감시와 조절에 매우 중요한 반면2, 이 정형화된 반응조차도 플라스틱일 수 있습니다.드로소필라는 걸을 때는 CO를 피하지만2 [3]비행할 때는 CO를 향해 움직인다.
디트
많은 곤충(및 다른 절지동물)이 N, N-디에틸-3-메틸벤츠아미드 또는 DEET를 포함하는 영역을 피하는 것으로 나타났다.그들은 DEET를 선천적으로 피하는데, 이는 DEET가 미각 수용체,[3] 이온 자극성 수용체 및 후각 수용체를 자극하고 다른 냄새 수용체와의 상호작용을 "왜곡"시키는 "혼란제이다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d e f Carraher, Colm; Dalziel, Julie; Jordan, Melissa D.; Christie, David L.; Newcomb, Richard D.; Kralicek, Andrew V. (2015). "Towards an understanding of the structural basis for insect olfaction by odorant receptors". Insect Biochemistry and Molecular Biology. 66: 31–41. doi:10.1016/j.ibmb.2015.09.010. PMID 26416146.
- ^ a b c d e f Gadenne, Christophe; Barrozo, Romina B.; Anton, Sylvia (2016). "Plasticity in Insect Olfaction: To Smell or Not to Smell?". Annual Review of Entomology. 61: 317–333. doi:10.1146/annurev-ento-010715-023523. PMID 26982441.
- ^ a b c d e f g h i j k l Li, Qian; Liberles, Stephen D. (2015). "Aversion and Attraction through Olfaction". Current Biology. 25 (3): R120–R1209. doi:10.1016/j.cub.2014.11.044. PMC 4317791. PMID 25649823.
- ^ Yadav, Pratibha; Borges, Renee M. (2017). "The insect ovipositor as a volatile sensor within a closed microcosm". Journal of Experimental Biology. 220 (9): 1554–1557. doi:10.1242/jeb.152777. PMID 28468812.
- ^ a b c d e f g h i j k l Syed, Zainulabeuddin (2015). "Chemical ecology and olfaction in arthropod vectors of diseases". Current Opinion in Insect Science. 10: 83–89. doi:10.1016/j.cois.2015.04.011. PMID 29588018.
- ^ Gu, Shao-Hua; et al. (2014). "Molecular Characterization and Differential Expression of Olfactory Genes in the Antennae of the Black Cutworm Moth Agrotis ipsilon". PLOS ONE. 9 (8): e103420. Bibcode:2014PLoSO...9j3420G. doi:10.1371/journal.pone.0103420. PMC 4118888. PMID 25083706.
- ^ a b Wilson, Rachel (2013). "Early olfactory processing in Drosophila: mechanisms and principles". Annual Review of Neuroscience. 36: 217–241. doi:10.1146/annurev-neuro-062111-150533. PMC 3933953. PMID 23841839.
- ^ Gadenne, Christophe; Barrozo, Romina B.; Anton, Sylvia (2016-03-11). "Plasticity in Insect Olfaction: To Smell or Not to Smell?". Annual Review of Entomology. Annual Reviews. 61 (1): 317–333. doi:10.1146/annurev-ento-010715-023523. ISSN 0066-4170. PMID 26982441. S2CID 207568844.
- ^ Riabinina, Olena; Task, Darya; Marr, Elizabeth; Lin, Chun-Chieh; Alford, Robert; O'Brochta, David A.; Potter, Christopher J. (2016-10-03). "Organization of olfactory centres in the malaria mosquito Anopheles gambiae". Nature Communications. 7: 13010. Bibcode:2016NatCo...713010R. doi:10.1038/ncomms13010. PMC 5063964. PMID 27694947.