카드뮴(I) 테트라클로로알루민산염
Cadmium(I) tetrachloroaluminate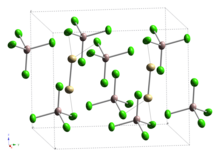 | |
| 이름 | |
|---|---|
| IUPAC 이름 디카드뮴(2+) bis(테트라코리도알루민산(1-)) | |
| 식별자 | |
3D 모델(JSmol) | |
| |
| |
| 특성. | |
| Cd2[AlCl4]2 | |
| 어금질량 | 562.4123 g/192 |
| 외관 | 화이트 크리스털 |
| 녹는점 | 227°(높음) |
| 위험 | |
| NIOSH(미국 건강 노출 제한): | |
PEL(허용) | [1910.1027] TWA 0.005 mg/m3 (Cd)[1] |
REL(권장) | CA[1] |
IDLH(즉시 위험) | Ca [9 mg/m3 (Cd)로)][1] |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
카드뮴(I) 테트라클로로알루민산염은 카드뮴(I)의 테트라클로로알루민산염인 2Cd2(AlCl4) 공식을 가진 무기 화합물이다.카드뮴이 +1 산화상태로 함유된 최초의 화합물(1961)이며 카드뮴-카드뮴 결합이 특징이다.
준비 및 특성
Cd2(AlCl4)2는 원래 녹인 CdCl에2 Cd 금속을 녹인 후 AlCl을3 첨가하여 준비했다.[2]
- CdCl2 + Cd → Cd2Cl2
- Cd2Cl2 + 2 AlCl3 → Cd2(AlCl4)2
라만 진동 스펙트럼에 대한 후속 연구는 카드뮴-카드뮴 결합의 존재를 나타냈으며,[3] 이는 단일 결정체에 대한 두 개의 개별 X선 회절 연구로 확인되었다.[4][5]따라서 이 화합물은 Hg를2+
2 포함하는 수은(I) (Mercurous) 화합물(예: 수은(I) 염화물)과 비교할 수 있다.Cd-Cd 본드는 AlCl4 유닛과 정점을 공유하는 에탄과 같은 CdCl26 유닛의 일부로, Cd-Cd 본드 길이는 257.6pm 또는[4] 256.1pm으로 보고되었다.[5]
Cd2(AlCl4)2는 직설적이다.그것은 손상되지 않은 전자를 포함하고 있지 않으며 불균형적으로 물과 쉽게 반응하여 Cd 금속과 Cd를2+ 준다.

CdCl26 유닛의 열타원 그림
참조
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. "#0087". National Institute for Occupational Safety and Health (NIOSH).
- ^ Corbett, J. D.; Burkhard, W. J.; Druding, L. F. (January 1961). "Stabilization of the Cadmium(I) Oxidation State. The System Cd-Cd1
2(AlCl
4)
2–Cd2
(AlCl
4)
2". Journal of the American Chemical Society. 83 (1): 76–80. doi:10.1021/ja01462a016. - ^ Corbett, J. D. (Aug 1962). "The Cadmium(I) Ion Cd2+
2. Raman Spectrum and Relationship to Hg2+
2". Inorganic Chemistry. 1 (3): 700–703. doi:10.1021/ic50003a051. - ^ a b Faggiani, R.; Ronald J. Gillespie; John E. Vekris (1986). "The cadmium(I) ion, Cd2+
2; X-ray crystal structure of Cd
2(AlCl
4)
2". Journal of the Chemical Society, Chemical Communications. 1986 (7): 517–518. doi:10.1039/C39860000517. - ^ a b Staffel, T.; Dr. Gerd Meyer (1987). "Synthesis and crystal structures of Cd[AlCl
4]
2 and Cd
2[AlCl
4]
2". Zeitschrift für anorganische und allgemeine Chemie. 548 (5): 45–54. doi:10.1002/zaac.19875480505.


