아멜로블라스
Ameloblast| 아멜로블라스 | |
|---|---|
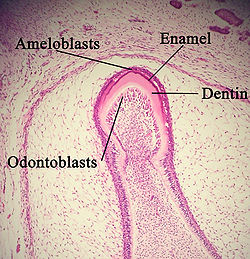 아멜로브레스트가 표시된 발육 치아. | |
 경추부위: (1) 치낭 세포, (2) 치낭 메센치메, (3) 오도노블라스, (4) 덴틴, (5) 스테라메이트 레티쿨룸, (6) 외측 에나멜 상피, (7)내부 에나멜 상피, (8) 아멜로블 상피, (9) 에나멜. | |
| 세부 사항 | |
| 식별자 | |
| 라틴어 | 아멜로블라스투스 |
| 메슈 | D000565 |
| TE | E5.4.1.1.2.3.20 |
| FMA | 70576 |
| 미세조영술의 해부학적 용어 | |
아멜로브래스(ameloblastes)는 치아발육 중에만 존재하는 세포로, 치아의 표면이 형성되는 치아의 가장 단단한 외층인 에나멜을 퇴치한다.
구조
각 아멜로브레스트는 직경 약 4마이크로미터, 길이 40마이크로미터의 주상세포로 단면적으로 육각형이다.아멜로브레스의 비밀스러운 끝은 톰스의 과정으로 알려진 6면 피라미드 같은 투영으로 끝난다.Tomes의 공정에 대한 각도는 치아 에나멜의 기본 단위인 에나멜 로드의 방향성에 있어서 중요하다.원위 단자 바는 Tomes의 공정을 아멜로브라스틱과 분리시키는 접합형 복합체다.
개발
아멜로브라스틱은 외피에서 유래된 구강 상피 조직에서 유래한다.그들의 프리아멜로브래스(그 유래는 내피에나멜 상피세포로부터)와의 차별화는 치과 파피야의 엑토메네시피 세포로부터 신호의 결과물이다.처음에는 프리아멜로브래스(preameloblastes)가 프리시큐러리 아멜로브래스(presecretory ameloblastes)로 구별되고, 이어 치아 에나멜을 내려놓는 분비 아멜로브래스(melob프리아멜로브래스로부터 아멜로브래스까지의 차이는 프리시큐러리(또는 귀납) 단계라 불리는 아멜로제네시스 1단계에서 발생한다.[1]
아멜로봇은 오도노블래스에 의해 덴틴(프레덴틴)의 첫 번째 층이 형성된 후에야 완전히 기능하게 된다.세포는 에나멜 성숙 후 감소된 에나멜 상피의 일부분이며, 이후 치아 분화 전후에 사멸을 겪는다.[2][3]: 103 이러한 단계는 성숙 단계라고 불리는 아멜로제네시스 3단계와 최종 단계에서 발생한다.
아멜로브레스의 분화와 발육에 영향을 미칠 수 있는 여러 가지 요인들이 있어 치아 구조 내에서 이상이 형성될 수 있다.한 예로 아멜로브라스틱 분화에 중요한 역할을 하는 BMP(골형성 단백질)가 있다.BMP 억제제인 폴리스타틴이 치아발육의 상피에 과하게 표현될 때 아멜로봇은 분화되지 않고 에나멜 형태도 없다.또 다른 예로는 치아 발육 상피에서 '디커-1'을 조건부로 삭제하면 에나멜 형성이 부족한 아멜로브라스틱의 분화가 저해될 수 있다.[2]
라이프 사이클
아멜로봇의[3]: 153 수명주기는 다음 6단계로 구성된다.
- 형태발생기
- 조직단계
- 형태 형성(비밀) 단계(톰의 프로세스 표시)
- 수태 단계
- 보호단계
- 탈수기
뮤린 ALC(세포와 같은 아멜로블라스) 세포 라인은 아멜로블라스틱의 기원이다.[4]
함수
아멜로브라스틱은 에나멜 단백질 에나멜린과 아멜로겐을 분비하는 세포로, 인체에 가장 단단한 물질인 에나멜을 형성하기 위해 나중에 미네랄화된다.[5]아멜로브래스는 에나멜의 이온성분과 유기성분을 조절한다.순환시계(24시간)가 아마 아멜로브래스(골조직 생산의 골조세포와 유사)[6]에 의해 매일 에나멜 생산을 조절할 것이라는 이론이 있다.아멜로브래스들은 생물유민화에 유리한 조건을 유지하기 위해 그들의 분비물과 재흡수 활동을 조정한다.[3]: 147
임상적 유의성
이 세포들은 환경에 민감하다.한 가지 일반적인 예는 신생아 라인에 의해 설명되며, 레치우스의 증분 라인이 1차 치아와 영구 첫 번째 어금니의 더 큰 큐스에서 발견되어 그 사람이 태어났을 때 에나멜 생산에 지장이 있음을 보여준다.[7]유년기에 높은 열은 에나멜 생산에 장애를 일으키는 신체 스트레스 요인의 한 예다.
이러한 민감성의 또 다른 가능한 예로는 에나멜 경도를 증가시키고 결과적으로 치과용 캐리(caries)를 예방하기 위해 사용되는 원소제인 불소 과다 섭취에 대한 소아 피폭 후(2~8세) 치과용 불소의 발달이 있을 수 있다.[8]
참고 항목
참조
- ^ He P, Zhang Y, Kim SO, Radlanski RJ, Butcher K, Schneider RA, DenBesten PK (June 2010). "Ameloblast differentiation in the human developing tooth: effects of extracellular matrices". Matrix Biology. 29 (5): 411–9. doi:10.1016/j.matbio.2010.03.001. PMC 3296366. PMID 20211728.
- ^ a b Huang GT, Thesleff I (2013). Stem cells in craniofacial development and regeneration. Hoboken, New Jersey: Wiley-Blackwell. ISBN 9781118498118. OCLC 809365748.
- ^ a b c Nanci A (2012). Ten Cate's oral histology : development, structure, and function (Eighth ed.). Mosby. ISBN 978-0-323-24207-3.
- ^ Takahashi S, Kawashima N, Sakamoto K, Nakata A, Kameda T, Sugiyama T, Katsube K, Suda H (February 2007). "Differentiation of an ameloblast-lineage cell line (ALC) is induced by Sonic hedgehog signaling". Biochemical and Biophysical Research Communications. 353 (2): 405–11. doi:10.1016/j.bbrc.2006.12.053. PMID 17188245.
- ^ Gallon V, Chen L, Yang X, Moradian-Oldak J (August 2013). "Localization and quantitative co-localization of enamelin with amelogenin". Journal of Structural Biology. 183 (2): 239–49. doi:10.1016/j.jsb.2013.03.014. PMC 3737400. PMID 23563189.
- ^ Sehic A, Nirvani M, Risnes S (October 2013). "Incremental lines in mouse molar enamel". Archives of Oral Biology. 58 (10): 1443–9. doi:10.1016/j.archoralbio.2013.06.013. PMID 23845754.
- ^ 일러스트레이티드 치과 발생학, 역사학 및 해부학, Bath-Balogh 및 Fehrenbach, Exvier, 2011, 페이지 151
- ^ Sierant ML, Bartlett JD (September 2012). "Stress response pathways in ameloblasts: implications for amelogenesis and dental fluorosis". Cells. 1 (3): 631–45. doi:10.3390/cells1030631. PMC 3671616. PMID 23745169.
외부 링크
- Simmer JP, Papagerakis P, Smith CE, Fisher DC, Rountrey AN, Zheng L, Hu JC (October 2010). "Regulation of dental enamel shape and hardness". Journal of Dental Research. 89 (10): 1024–38. doi:10.1177/0022034510375829. PMC 3086535. PMID 20675598.