에나멜 오르간
Enamel organ| 에나멜 오르간 | |
|---|---|
 에나멜 오르간 | |
| 세부 사항 | |
| 식별자 | |
| 라틴어 | 오르가눔 에나멜리움 |
| 메슈 | D004658 |
| TE | organ_by_E5.4.1.1.2.3.5 E5.4.1.2.3.5 |
| 해부학적 용어 | |
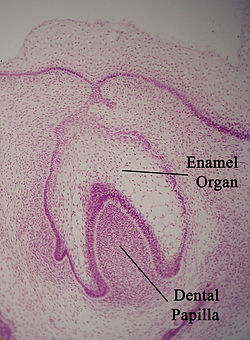
치아 기관이라고도 알려진 에나멜 기관은 발육하는 치아에서 볼 수 있는 세포의 집합체로서, 치아 파피야 위에 놓여 있다.[1] 에나멜 장기는 에나멜의 형성과 덴티닌 형성의 개시, 치아관 형상의 확립, 덴토에나멜 접합부의 설치 등을 담당한다.[1]
에나멜 장기는 네 개의 층을 가지고 있다; 안쪽 에나멜 상피, 바깥 에나멜 상피, 층간 중간, 그리고 스테나이트 망막.[1]
에나멜 오르간 깊이 있는 차별화된 엑토메네시메인 치과용 파피야는 덴틴과 치과용 펄프를 생산하게 된다. 주변의 엑토메네시메 조직인 치낭은 치근 밑의 원시적인 시멘텀, 치주 인대, 치주 뼈다귀 뼈다.[1] 내부 에나멜 상피와 외부 에나멜 상피 합체체가 있는 부위는 치근의 증식에 중요한 경추근이다.[1]
치아발달
치아의 발육은 자궁의 6주차에 구강 상피에서 시작된다. 이 과정은 세 단계로 나뉜다.
- 입문
- 형태생성 및
- 히스토제네시스[2]
7주말 i.u.u.에 치과용 층의 국부적 증식 세포는 치아봉오리로 알려진 둥글고 타원형 부음을 형성하며, 이는 결국 중피세포로 발전하여 에나멜 기관을 둘러싸게 된다. 각각의 상피부종과 주변의 중피세포는 치아 세균을 형성한다.[3]
치아 세균은 치아의 원시적인 구조로, 그들의 형성은 꽃봉오리 단계, 모자 단계, 종 단계 세 단계로 구분된다.
단계는 에나멜 장기의 발달 정도에 기초한다. 구강 상피는 치아 에나멜을 형성하고, 엑토메인켄시메는 치아의 펄프와 틀니를 형성한다. ectomesenchyme은 구강 상피까지 깊게 놓여있다.[4]
버드 스테이지
이것은 치아발달의 초기 단계인데, 8주차에 발생한다. 치과용 라미나의 증식은 작은 이빨 봉오리를 형성하는데, 이것은 현재 에나멜 기관으로 알려진 상피 세포의 구면 또는 난형 응축이다.[1] 에나멜 장기는 주변부에 위치한 낮은 주상세포와 중앙에 위치한 다각형 세포로 구성된다. 에나멜 장기는 또한 증식하는 중피 세포에 둘러싸여 있는데, 이것은 두 개의 뚜렷한 부위의 응결을 초래한다.[2]
- 치과용 파피야: 에나멜 오르간 아래
- 치아 주머니: 치아 봉오리와 치아 파피야를 둘러싸고 있는 부분의 ectometsenchymal 응축.
치과용 파피야와 치아 주머니는 모두 봉오리 단계에서 구조적으로 정의되지 않으며, 이후 단계(캡과 벨 단계)에서 더 정의될 것이다. 에나멜 오르간과 주변의 중피 세포 사이의 상호 작용과 신호 전달은 치아 발달의 후기에 중요한 역할을 한다.[2] 각 치과용 아치에는 10개의 이빨 봉오리가 있을 것이며, 이는 20개의 1차 치아를 차지할 것이다.
캡 스테이지
캡 단계는 9-10주 아이유에 발생한다.[1] 이 단계에서 세포의 불균등한 증식은 엑토메네시메 조직으로 발현되며 캡 모양의 에나멜 기관이 형성된다. 엑토메네시메 조직은 또한 원시적인 치과 펄프를 형성하기 위해 표면적으로 흡수된다. 세포의 분화는 이 단계에서 다른 조직층을 만들기 위해 발생한다; 외부 에나멜 상피층, 층간 중간층, 스텔라테 레티쿨룸, 내부 에나멜 상피층, 치과용 파피야, 치과용 모낭. 단순한 입방체 상피층의 층인 외부 에나멜 상피층은 치아발달 시 보호 역할을 한다.[1] 에나멜 장기의 가장 안쪽 층인 스텔라테 레티쿨룸은 세포 사이에 GAG를 모은다. 내부 에나멜 상피는 벨 스테이지 동안 에나멜을 형성할 것이다.
얼리 벨 스테이지
이 단계에서는 에나멜 장기가 고르지 않게 자라고, 상피 모자가 깊어진다.[3] 에나멜 오르간의 캡 모양은 캡의 밑면이 깊어질 때 종 모양을 가정한다.[3] 내부 에나멜 상피(Papilla cells가 성장함)의 접힘은 치아 왕관의 배합 패턴을 지도화한다. 그 과정은 형태분화라고 알려져 있다. 치과용 파피야 세포가 가하는 압력은 스테로이트 레티쿨룸(에나멜 장기에 존재하는) 내 액체의 압력에 의해 균등하게 반대되는 것으로 나타났다.[3]
에나멜 장기의 접힘은 세포 분화 시간의 차이와 다른 비율에 의해 발생하며, 각 치아에 다른 왕관 모양을 야기한다.
후기 벨 스테이지
이 단계는 뿌리 형성과 광물화의 시작에 의해 특징지어지는 결합 단계(치과 경조직의 형성)이다. 내부 에나멜 상피와 오도노블라스 사이의 영역은 미래의 덴티노나멜 접합부의 윤곽을 보여준다. 덴틴(덴티노제네시스)의 형성은 에나멜(아멜로제네시스) 형성에 선행한다. 그것은 미래의 쿠스프 지역에서 미래의 덴티노나멜 접합부를 따라 먼저 발생하며 과육과 비육체적으로 진행된다. 내부 에나멜 상피세포는 전아멜로브성형체가 되어 치아의 중피세포와 오도노브성형 분화를 촉진하는 귀납적 인자를 방출한다.[1] 이것은 그림에서 볼 수 있다(A로 표시됨). 오도노블라드는 덴틴을 누웠다. 덴틴의 첫 번째 층이 형성된 후, 이것은 아멜로브라스틱(B)이 미래의 근막 및 쿠스팔 부위에 덴틴 위에 에나멜(빨간색 부위)을 깔도록 유도한다. 그리고 나서 아멜로제시스가 뒤따를 것이다. 이어 에나멜 장기의 자궁경부 부분은 헤르트윅 에피헬리알 루트 피복(HERS)을 발생시킨다. 이는 미래의 뿌리의 윤곽을 나타내며, 또한 뿌리의 크기, 형태, 길이 및 개수를 담당한다.
크라운 형태학 결정
에나멜 장기의 구성은 경추, 개, 전모, 어금니에 따라 크게 달라지지 않는다. 프리몰라/몰라와 인치/캐닌에 존재하는 오도노블라스틱, 아멜로블라스틱, 시멘토블라스 등의 양은 그대로 유지되지만, 이러한 형태학적 형태의 치아의 주요한 차이는 에나멜 오르간(덴틴, 에나멜, 시멘텀)에 의해 분비되는 제품의 분비량과 양이다. 무엇이 다른 치아에 있는 에나멜 기관들 사이의 차이를 결정하는지에 대한 명확한 합의는 없었다. 그러나 치과 전문의와 생물학자는 치과외 매트릭스/에나멜 매트릭스의 세포간 유전자와 세포신호화가[6] 역할을 한다는 견해를 폭넓게 갖고 있다.
왕관을 덮는 에나멜 층의 모양은 다음의 다섯 가지 성장 매개변수에 의해 결정된다.[7]
- 부등성장률
- 부등 성장 기간(서미 팁)
- 아멜로블라스 연장율
- 아멜로브라스 연장 기간
- 부등종료율 확산.
부등 성장 메커니즘은 에나멜 층의 두께를 설정하며, 로드(또는 프리즘)[1]와 인터로드에 존재하는 리본 모양의 탄산염 아파타이트 결정으로 결정된다. 그것들은 치아발달의 종 단계에서 아멜로브레그에 의해 생산된다. 결정체가 길고 촘촘히 박혀 있기 때문에 치아의 결정체가 풍부하느냐에 따라 두께가 달라진다. 왕관 형태 또는 형태학은 상피-메신키 상호 작용에 의해 결정되는데, 상피-메신키 상호 작용은 덴티노나멜 접합(DEJ)에서 발생한다. 첫째, 아멜로브리스 전은 펄프 뿔을 덮고 있는 덴틴 표면의 내측 에나멜 상피와 구별된다.[8] 그런 다음 아멜로브레스터 파동은 첨탑 팁과 구별되어 내 에나멜 상피아를 통해 미네랄이 함유된 덴틴 표면의 경사면을 따라 이동한다. 그 분화는 틀니 표면의 경사를 따라 확장되어 한계에 도달하게 되는데, 그 안에서 내피 상피와 외피 상피가 융합되어 허트윅의 상피근 피복을 형성하게 된다. 에나멜 광물은 아멜로제네시스(에나멜 형성)의 분비 단계 동안 매일 증가(적용 성장)할 것이다. 궁극적으로, 비밀의 단계는 끝나고 그들은 성숙 단계 아멜로바래스로 전환될 것이다. 이 아멜로봇은 치아의 에나멜 표면으로 내려갈 것이며, 왕관과 치아의 모양이 형성될 것이다.[9]
이상
오돈토메스
오돈톰은 완전히 차별화된 상피세포와 중피세포가 성장해 아멜로브레드와 오도노브레스트가 생겨나면서 생기는 발달 이상 현상으로 꼽힌다.[10] 역사학적으로 에나멜, 덴틴, 시멘텀을[11] 포함한 다른 치과 조직으로 구성되어 있으며, 경우에 따라서는 펄프 조직으로 구성되어 있기 때문에 에나멜 장기가 적절한 방식으로 배열되지 않으면 오도노메가 형성될 수도 있다.[12] 오돈톰은 다음 중 하나로 분류된다.
- 화합물
- 이 기형은 해부학적으로 일반적인 치아와 같으며, 치아 조직(에나멜, 덴틴, 시멘텀)을 질서정연하게 배치하였다. 이것들은 복잡한 오돈톰보다 더 빈번하다.[12][13]
- 콤플렉스
- 이 기형은 치과 조직이 불규칙한 덩어리를 형성하면서 무질서하게 배열되는 결과를 낳는다.[12][13]
오돈톰은 희귀한 실체로서 보통 증상이 없다; 그것들은 종종 정기적인 치과 방사선 검사에서 부수적인 발견이다.[14][15] 복합오토메는 주변이 매끄러운 얇은 방사광 영역에 둘러싸인 석회화 물질의 불규칙한 질량으로 나타나며, 복합형은 잘 정의된 방사광 병변 중앙에서 치아를 닮은 석회화 구조를 보여준다.
오돈톰의 개발과 관련된 몇 가지 요인은 다음과 같다.
구강에서 오도노메가 분출한 것은 1980년에 처음 보고되었다.[15]
밀스 인바기나투스
Dens Invaginatus는 치아 이상현상으로, 영향을 받은 치아(치질된 오도놈)가 에나멜에 의해 완전히 또는 부분적으로 정렬된 충치를 포함하고 있으며, 방사선학적으로 치아 안의 치아(덴티)와 유사하다.[16]
밀도의 비침습성에 대한 공감대가 부족하다. 외도생식 동안 에나멜 장기의 세포가 발달하는 동안 치과용 파피야로 증식하고 응고되기 때문에 인바기나투스가 발생한다고 제안한다.[17]
또 다른 제안된 이론은 치아 발달 중 에나멜 장기의 왜곡과 그에 따른 에나멜 장기의 일부의 돌출은 에나멜 라인 채널의 형성으로 이어질 것이라는 것이다.[18]
역사학적으로, 밀도 내 에나멜의 구조와 구성에는 차이가 있다. 내부 에나멜은 비정형적이고 더 복잡한 막대 모양을 보이며 표면은 전형적인 벌집무늬가 있지만 페리키마타는 없다.[19]
호출은 다음과 같을 수 있다.
- Coronal 유형: 치아 파피야에 에나멜 장기를 주입하는 가벼운 발작
- 래디컬 타입: 허트윅의 상피근 피복과 관련된 왕관과 뿌리의 대부분을 점유하고 있으며, 시멘텀으로 줄지어 있다.[20]
밀도 인두염은 밀도 인두염에 걸린 치아가 맥박 질환에 걸리기 쉽기 때문에 임상적으로 중요하다. 자극제는 에나멜과 덴틴을 얇게 발라서 풀팔 조직과 분리된 부위에만 넣을 수 있으며 치과용 카리에를 예방하기 위한 추가 예방 조치가 필요하다.[21]
에나멜 결함과 쿠엘리악 병
어린이들의 코엘리악 질환은 초기에는 증상이 없을 수 있기 때문에 진단을 충분히 받지 못한 것으로 생각된다. 연구에 따르면 영구 치아와 낙엽 치아의 에나멜 결함은 어린이와 성인에게 진단되지 않은 코엘리악 질환의 존재를 암시할 수 있다.[22][23][24] 쿠엘리악성 질환 관련 에나멜 결함은 가장 일반적으로 근막 및 첫 번째 어금니와 연관되며, 4사분면에서 동일한 치아에 에나멜 결함의 대칭적인 분포로 특징지어진다.[22][25] 이것은 다른 에나멜 결점에서는 볼 수 없는 코엘리악 질환의 에나멜 결함의 뚜렷한 특징이다.
아멜로겐인에 의한 치아 형성의 방해로 코엘리악 질환의 에나멜 결함이 발생한다. 아멜로제닌은 치아 결정의 광물화와 조직화에 큰 역할을 하는 프로라인이 풍부한 에나멜 단백질이다.[26][27] 이 과정을 방해하면 치아 표면이 변형된다. 담금질 질환 환자는 이들 환자에게 독성이 있는 단백질 글리아딘을 제거하기 위해 높은 수준의 순환 IgG와 IgA 항글리아딘 항체(AGA)를 생성한다. 그러나 아멜로겐과 글리아딘의 구조적 유사성으로 인해 AGA는 에나멜의 부적절한 형성을 초래하는 아멜로겐을 방해할 수 있다.[26] 게다가 IgG는 태반을 가로질러 운반될 수 있기 때문에 자궁내부에서 청소년기까지 아멜로제네시스 과정이 교란된다.[25]
글리아딘은 밀 글루텐의 높은 소수성 단백질이다. 항체는 이 단백질과 상호작용하기 위해 생성된다. 따라서, 글루텐이 없는 식단은 에나멜 결함에 대한 순환 항체가 감소할 수 있기 때문에 치아 발육의 정상화로 이어질 수 있다.[28]
참고 항목
| 무료 사전인 Wiktionary에서 에나멜을 찾아 보십시오. |
참조
- ^ a b c d e f g h i j Antonio N (2017-10-13). Ten Cate's oral histology: development, structure, and function. review (9th ed.). St. Louis, Missouri: Elsevier. ISBN 978-0-323-48524-1. OCLC 990257609.
- ^ a b c Avery J (1951). "Embryology of the tooth". Journal of Dental Research. 30: 490.
- ^ a b c d Avery J (1954). "Primary induction of tooth formation". Journal of Dental Research. 33: 702.
- ^ Pansky B (1982). Review of MEDICAL EMBRYOLOGY. Ohio. p. 77.
- ^ Rauth RJ, Potter KS, Ngan AY, Saad DM, Mehr R, Luong VQ, Schuetter VL, Miklus VG, Chang P, Paine ML, Lacruz RS, Snead ML, White SN (December 2009). "Dental enamel: genes define biomechanics". review. Journal of the California Dental Association. 37 (12): 863–8. PMC 2825347. PMID 20066874.
- ^ Jussila M, Thesleff I (April 2012). "Signaling networks regulating tooth organogenesis and regeneration, and the specification of dental mesenchymal and epithelial cell lineages". review. Cold Spring Harbor Perspectives in Biology. 4 (4): a008425. doi:10.1101/cshperspect.a008425. PMC 3312678. PMID 22415375.
- ^ Simmer JP, Papagerakis P, Smith CE, Fisher DC, Rountrey AN, Zheng L, Hu JC (October 2010). "Regulation of dental enamel shape and hardness". review. Journal of Dental Research. 89 (10): 1024–38. doi:10.1177/0022034510375829. PMC 3086535. PMID 20675598.
- ^ Baldock, Richard; Bard, Jonathan; Davidson, Duncan; Morriss-Kay, Gillian (2015-09-23). Kaufman's atlas of mouse development supplement : coronal images. Baldock, Richard,, Bard, Jonathan,, Davidson, Duncan,, Morriss-Kay, Gillian,, Kaufman, Matthew H. Amsterdam. ISBN 9780128009130. OCLC 932060547.
- ^ Simmer JP, Papagerakis P, Smith CE, Fisher DC, Rountrey AN, Zheng L, Hu JC (October 2010). "Regulation of dental enamel shape and hardness". Journal of Dental Research. 89 (10): 1024–38. doi:10.1177/0022034510375829. PMC 3086535. PMID 20675598.
- ^ Neville B, Damm DD, Allen C, Bouquot J (2009). Oral and maxillofacial pathology. review (3rd ed.). St. Louis, Mo.: Saunders/Elsevier. ISBN 978-1-4377-2197-3. OCLC 834142726.
- ^ Bhargavan Sarojini S, Khosla E, Varghese T, Johnson Arakkal L (2014). "Eruption of odontomas into the oral cavity: a report of 2 cases". primary. Case Reports in Dentistry. 2014: 639173. doi:10.1155/2014/639173. PMC 4037568. PMID 24900927.
- ^ a b c d Girish G, Bavle RM, Singh MK, Prasad SN (2016-01-01). "Compound composite odontoma". primary. Journal of Oral and Maxillofacial Pathology. 20 (1): 162. doi:10.4103/0973-029X.180982. PMC 4860922. PMID 27194882.
- ^ a b Abdul M, Pragati K, Yusuf C (2014). "Compound composite odontoma and its management". primary. Case Reports in Dentistry. 2014: 107089. doi:10.1155/2014/107089. PMC 4283421. PMID 25587458.
- ^ Vengal M, Arora H, Ghosh S, Pai KM (March 2007). "Large erupting complex odontoma: a case report". primary. Journal of the Canadian Dental Association. 73 (2): 169–73. PMID 17355809.
- ^ a b c Mehta D, Raval N, Udhani S, Parekh V, Modi C (2013). "An unusual case report of erupted odontoma". primary. Case Reports in Dentistry. 2013: 570954. doi:10.1155/2013/570954. PMC 3576803. PMID 23476816.
- ^ Malden N (2013-11-02). "Book review: Oral and Maxillofacial Medicine, the Basis of Diagnosis and Treatment, 3rd edition, by Crispian Scully. Oxford: Churchill Livingstone Elsevier, 2013 (448pp; £49.99p/b). ISBN 978-0-7020-4948-4". Dental Update. 40 (9): 738. doi:10.12968/denu.2013.40.9.738.
- ^ Rushton VE (2006-05-13). "Research summary: Radiographic processing in general dental practice". British Dental Journal. 200 (9): 503. doi:10.1038/sj.bdj.4813528. S2CID 24142205.
- ^ Oehlers FA (November 1957). "Dens invaginatus (dilated composite odontome). I. Variations of the invagination process and associated anterior crown forms". Oral Surgery, Oral Medicine, and Oral Pathology. 10 (11): 1204–18 contd. doi:10.1016/0030-4220(57)90077-4. PMID 13477660.
- ^ Bloch-Zupan A (2014), "Genetic Alterations: Heritable Dentin Defects", The Dental Pulp, Springer Berlin Heidelberg, pp. 155–168, ISBN 9783642551598
- ^ "Radicular dens invaginatus". Dental Abstracts. 53 (2): 77–78. 2008-03-01. doi:10.1016/j.denabs.2007.10.012. ISSN 0011-8486.
- ^ Hülsmann M (March 1997). "Dens invaginatus: aetiology, classification, prevalence, diagnosis, and treatment considerations". International Endodontic Journal. 30 (2): 79–90. doi:10.1111/j.1365-2591.1997.tb00679.x. PMID 10332241.
- ^ a b Salanitri, S.; Seow, W. K. (2013). "Developmental enamel defects in the primary dentition: aetiology and clinical management". Australian Dental Journal. 58 (2): 133–140. doi:10.1111/adj.12039. ISSN 1834-7819. PMID 23713631.
- ^ Calvo, J. C. Llodra; Lozano, J. Maldonado; García, P. Baca; Lafuente, P. Junco; Páez, E. Ortega (2008-07-01). "Prevalence of dental enamel defects in celiac patients with deciduous dentition: a pilot study". Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology and Endodontics. 106 (1): 74–78. doi:10.1016/j.tripleo.2008.01.022. ISSN 1528-395X. PMID 18585624.
- ^ Cheng, Jianfeng; Malahias, Ted; Brar, Pardeep; Minaya, Maria Teresa; Green, Peter H. R. (2010-03-01). "The Association Between Celiac Disease, Dental Enamel Defects, and Aphthous Ulcers in a United States Cohort". Journal of Clinical Gastroenterology. 44 (3): 191–194. doi:10.1097/MCG.0b013e3181ac9942. ISSN 0192-0790. PMID 19687752. S2CID 9376758.
- ^ a b Sóñora, Cecilia; Arbildi, Paula; Rodríguez‐Camejo, Claudio; Beovide, Verónica; Marco, Alicia; Hernández, Ana (2016). "Enamel organ proteins as targets for antibodies in celiac disease: implications for oral health". European Journal of Oral Sciences. 124 (1): 11–16. doi:10.1111/eos.12241. ISSN 1600-0722. PMID 26712243.
- ^ a b Muñoz, Florencia; Río, Natalia Del; Sóñora, Cecilia; Tiscornia, Inés; Marco, Alicia; Hernández, Ana (2012). "Enamel defects associated with coeliac disease: putative role of antibodies against gliadin in pathogenesis". European Journal of Oral Sciences. 120 (2): 104–112. doi:10.1111/j.1600-0722.2012.00949.x. ISSN 1600-0722. PMID 22409216.
- ^ Moradian-Oldak, Janet (2001-09-01). "Amelogenins: assembly, processing and control of crystal morphology". Matrix Biology. 20 (5–6): 293–305. doi:10.1016/S0945-053X(01)00154-8. ISSN 0945-053X. PMID 11566263.
- ^ Dahlbom, Ingrid; Korponay-szabó, Ilma R.; Kovács, Judit B.; Szalai, Zsuzsanna; Mäki, Markku; Hansson, Tony (2010-02-01). "Prediction of Clinical and Mucosal Severity of Coeliac Disease and Dermatitis Herpetiformis by Quantification of Iga/igg Serum Antibodies to Tissue Transglutaminase". Journal of Pediatric Gastroenterology and Nutrition. 50 (2): 140–146. doi:10.1097/MPG.0b013e3181a81384. ISSN 0277-2116. PMID 19841593. S2CID 43720349.


