단분자 실험
Single-molecule experiment단분자 실험은 개별 분자의 성질을 조사하는 실험이다. 단일 분자 연구는 분자의 개별 행동을 구별할 수 없고 평균 특성만 측정할 수 있는 앙상블 또는 대량 집합의 측정과 대조될 수 있다. 생물학, 화학, 물리학의 많은 측정 기술은 단일 분자를 관찰할 만큼 민감하지 않기 때문에, 단일 분자 형광 기술(1990년대 이후 개별 분자 수준에서 다양한 과정을 조사하기 위해 출현한)은 측정된 pr에 대해 많은 새로운 세부 사항을 제공했기 때문에 많은 흥분을 유발했다.과거에 접근할 수 없었던 오과 실제로 1990년대 이후, 개별 분자를 탐사하는 많은 기술들이 개발되었다.[2]
최초의 단일 분자 실험은 1970년대에 수행된 패치 클램프 실험이었지만, 이는 이온 채널을 연구하는 데 국한되었다. 오늘날 단일 분자 기법을 사용하여 연구된 시스템에는 근육 조직의 액틴 필라멘트에 대한 미오신의 이동과 고형분 내 개별 국소 환경의 분광 세부사항이 포함된다. 생물학적 중합체의 순응은 원자력 현미경(AFM)을 사용하여 측정되었다. 힘 분광법을 사용하면 보통 중합체인 단일 분자(또는 상호 작용하는 분자의 쌍)가 기계적으로 늘어나 그들의 탄력적인 반응을 실시간으로 기록할 수 있다.
역사
극저압의 가스 단계에서는 단분자 실험이 수십 년 동안 존재해 왔지만 W. E. Moerner와 로타 카도르의 연구로 1989년 이후 비로소 응축된 단계였다.[3] 1년 후 미셸 오리트와 재키 버나드도 형광에 의한 단일 분자의 흡수를 감지하는 것을 보여줄 수 있었다.[4]
많은 기법들은 한 번에 한 개의 분자를 관찰할 수 있는 능력을 가지고 있는데, 가장 두드러진 것은 단일 이온이 검출되는 질량 분광법이다. 게다가 단일 분자를 검출하는 가장 초기 수단 중 하나는 이온 채널 분야에서 에르윈 네허와 버트 사크만(그 후 그들의 정석적 공헌으로 노벨상을 수상하게 되었다)의 패치 클램프 기법이 발달하면서 생겨났다. 그러나 단일 분자를 관찰하기 위해 전도성을 측정하는 아이디어는 관찰할 수 있는 시스템의 종류에 심각한 제한을 두었다.
형광은 한 번에 한 개의 분자를 관측할 수 있는 편리한 수단이며, 주로 상업용 광학 검출기의 민감성 때문에 단일 광자를 계산할 수 있다. 그러나 분광학적으로 한 분자의 관측을 위해서는 분자가 격리된 환경에 있고 흥분시 광자를 방출해야 하는데, 이는 광전자 증배관(PMT)이나 눈사태 광다이오드(APD)를 이용하여 단일 광자를 검출하는 기술 덕분에 광자 방출 사건을 큰 감각으로 기록할 수 있게 된다.viity와 시간 분해능
최근에는 촉매변환과 구조재편의 미묘한 시간 의존적 움직임으로 인해 대량으로 쉽게 연구할 수 없는 효소 기능을 연구하기 위해 단백질, 뉴클레오티드 등의 생체 분자를 표기한 것을 통해 단분자 형광은 생물학적 영상에 대한 관심이 높은 대상이다. 가장 많이 연구된 단백질은 근육 조직에서 발견되는 미오신/액틴 효소의 등급이었다. 단분자 기술을 통해 이 단계적 메커니즘이 관찰되었고 많은 단백질에서 특징지어졌다.
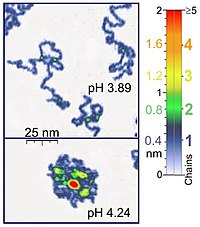
원자현미경과 같은 나노기계도 대부분의 생물학적 중합체와 같은 길이 단위로 작용하기 때문에 생물학적 중요성의 단일 분자 실험에 적합하다. 게다가 원자력 현미경(AFM)은 합성 고분자 분자의 연구에 적합하다. AFM은 폴리머 체인의 3D 시각화를 위한 독특한 가능성을 제공한다. 예를 들어, AFM 태핑 모드는 액체 매체 아래에 흡착된 폴리 전극 분자(예를 들어 폴리(폴리(2-비닐피리딘)의 0.4nm 두께 체인)를 기록할 만큼 충분히 부드럽다. 이러한 실험에서 2체인 중첩의 위치는 단일 체인 두께의 2배(상기된 예시의 경우 0.8nm)에 해당한다. 적절한 스캐닝 매개 변수를 적용할 때, 그러한 분자의 순응은 다양한 특성을 가진 액체 매체에서 실험의 수행을 가능하게 하는 몇 시간 동안 변하지 않는다.[1] 또한 팁과 샘플 고해상도 영상 사이의 힘을 제어함으로써 얻을 수 있다.[5][6] 광학 핀셋은 또한 DNA와 단백질 상호작용을 연구하고 계량화하는 데 사용되었다.[5][6]
실험에 대하여
개념
단일 분자 형광 분광법은 분자의 환경, 구조 및 위치에 대한 정보를 얻기 위해 분자의 형광도를 사용한다. 이 기법은 앙상블 평균화(즉, 많은 분자를 동시에 기록할 때 얻은 신호는 분자 역학의 평균 특성을 나타냄)로 인해 달리 사용할 수 없는 정보를 얻을 수 있는 능력을 제공한다. 개별 분자의 많은 실험에서의 결과는 두 개의 주 궤적이다.
단일 채널 기록
단일 분자 형광 분광법의 경우와 마찬가지로, 단일 채널 기록이라고 알려진 기법을 사용하여 특정 운동 정보(이온 채널 기능에 관한 경우)를 얻을 수 있는데, 이는 전체 셀 기록과 같은 앙상블 기록이 수행될 때 이용할 수 없는 것이다.[7] 구체적으로는 이온 채널이 전도 등급과 비전도 등급 사이를 번갈아 가며, 이 등급은 순응도가 다르다. 따라서 이온 채널의 기능 상태는 노이즈를 최소화하기 위해 적절한 예방 조치를 취한다면 충분히 민감한 전자장치를 사용하여 직접 측정할 수 있다. 차례로 이러한 등급은 이온 채널의 기본 기능에 직접적인 관계가 있는 하나 이상의 운동 상태로 나눌 수 있다. 체계적으로 변화하는 조건(예: 작용제 농도 및 구조, 투과 이온 및/또는 채널 차단기, 이온 채널 아미노산의 돌연변이)에서 이러한 유형의 단일 분자 연구를 수행하면 이온 채널의 다양한 운동 상태의 상호 변환에 관한 정보를 제공할 수 있다. 이온 채널의 최소 모델에는 개방 및 폐쇄의 두 가지 상태가 있다. 그러나 여러 개의 폐쇄 상태뿐만 아니라 비활성 상태 및/또는 감응 상태까지 데이터를 정확하게 나타내기 위해 다른 상태가 필요한 경우가 많은데, 이러한 상태는 자극이 있는 경우에도 발생할 수 있는 비전도 상태다.[7]
생체분자표기
단일 불소포체는 단백질이나 DNA와 같은 생체 분자에 화학적으로 부착될 수 있으며, 형광 탐침을 감시하여 개별 분자의 역학을 추적할 수 있다. 지역 환경의 변화를 나타내는 방출 강도 및/또는 복사 수명의 변화와 함께 Rayleigh 한계 내의 공간 이동을 추적할 수 있다. 예를 들어, 단일 분자 라벨링은 근육 세포의 미세 관 가닥을 따라 키네신 운동 단백질이 어떻게 움직이는지에 대한 방대한 양의 정보를 제공했다.
단일 분자 형광 공명 에너지 전달(FRET)
주요 기사 smFret.
단일 분자 형광 공명 에너지 전달에서 분자는 (적어도) 두 군데로 라벨이 붙어 있다. 레이저 빔은 첫 번째 탐침을 흥분시키는 분자에 초점을 맞춘다. 이 탐침은 긴장을 풀고 광자를 방출할 때 다른 탐침을 흥분시킬 기회가 있다. 두 번째 프로브의 첫 번째 프로브에서 방출되는 광자의 흡수 효율은 이들 프로브 사이의 거리에 따라 달라진다. 시간이 지날수록 거리가 변하기 때문에 이 실험은 분자의 내적 역학을 탐구한다.
단일분자 실험 대 앙상블 실험
개별 분자와 관련된 데이터를 볼 때 보통 첫 번째 순서, 두 번째 순서 등의 전파기와 점프 시간 확률 밀도 함수를 구성할 수 있는 반면, 대량 실험에서는 보통 상관 함수의 붕괴를 얻을 수 있다.[8] 이러한 고유한 기능(개별 분자로부터 파악됨)에 포함된 정보로부터 시스템의 동작 방식(예: 운동 방식,[9] 활동 가능성 또는 감소된 치수 형태)에 대한 비교적 명확한 그림을 추출할 수 있다.[10][11] 특히 개별 효소의 활동을 감시할 때 효소의 반응 경로를 구성할 수 있다([12]많은 특성). 또한, 동종 모집단에 대한 적합 방법 및 시험과 같은 단일 분자 데이터의 분석과 관련된 중요한 측면은 여러 저자에 의해 설명되어 왔다.[7] 한편, 단일 분자 데이터의 분석에는 저소음 환경 및 절연 피펫 팁의 구축, 기록에서 발견되는 일부 불필요한 구성 요소(소음)의 필터링, 데이터 분석에 필요한 시간(사전 처리, 모호하지 않은 사건 감지, 플로팅) 등 여러 가지 문제가 있다. 데이터, 적합 운동 체계 등).
임팩트
단일 분자 기술은 광학, 전자, 생물학, 화학에 영향을 미쳤다. 생물학에서 단백질과 다른 복잡한 생물 기계에 대한 연구는 그들의 운동학을 직접 관찰하는 것을 거의 불가능하게 만드는 앙상블 실험에 한정되었다. 예를 들어, 단분자 형광현미경을 사용하여 근육 조직에서 키네신-묘신 쌍을 연구한 후에야 보행 메커니즘을 직접 관찰할 수 있었다. 그러나 이러한 실험들은 대부분 생체내 연구에만 국한되어 왔으며, 살아있는 세포 영상에 대한 유용한 기법이 아직 완전히 실현되지 않았기 때문이다. 그러나 [13]생체내 단일 분자 이미징의 약속은 생물 분자를 고유 공정에서 직접 관찰할 수 있는 엄청난 잠재력을 가지고 있다. 이러한 기술들은 종종 저복사 단백질과 관련된 연구를 대상으로 하는데, 그 중 많은 것들이 여전히 발견되고 있다. 이러한 기법들은 또한 이질적인 표면의 매핑을 포함한 화학 분야의 연구에도 확장되었다.[14]
참고 항목
- 단분자석
- 힘 분광학
- 자석 핀셋
- 광학 핀셋
- 단일 입자 추적
- 라만 분광학
- 스캐닝 프로브 현미경 검사
- 전자 현미경 검사
- 테더드 입자 운동(TPM)
- 초해상도 현미경
- 전압 클램프
- 튜닝 가능한 저항성 펄스 감지
- 단일 분자 실시간 시퀀싱
참조
- ^ a b Y. 로이터와 S. 민코, 고체-액체 인터페이스에서의 AFM 단일 분자 실험: Adsorbed Flexible Polyelectrolyt Chains의 상황 순응에서, 미국화학협회 저널 127권 45, 페이지 15688–15689(2005)
- ^ Juette, MF; Terry, DS; Wasserman, MR; Zhou, Z; Altman, RB; Zheng, Q; Blanchard, SC (June 2014). "The bright future of single-molecule fluorescence imaging". Curr Opin Chem Biol. 20: 103–11. doi:10.1016/j.cbpa.2014.05.010. PMC 4123530. PMID 24956235.
- ^ W. E. Moerner와 L. Kador, 고체, 물리적에서 단일 분자의 광학적 검출 및 분광법. 레트 62, 2535 - 2538 (1989년)
- ^ M. 오리트와 J. 버나드, P-terphenyl 결정, P-terphenyl 결정에서 형광물질의 배설로 검출된 단일 펜타센 분자. 레트 65, 2716–2719 (1990)
- ^ a b D. Murugesapillai 외, HMO1에 의한 DNA 브리징 및 루핑은 핵 무염색소, 핵산 레스 (2014) 42 (14) : 8996-9004
- ^ a b Murugesapillai, D.; et al. (2016). "Single-molecule studies of high-mobility group B architectural DNA bending proteins". Biophys Rev. 9 (1): 17–40. doi:10.1007/s12551-016-0236-4. PMC 5331113. PMID 28303166.
- ^ a b c B. 삭만과 E. Neher, Single-Channel Recording, ISBN 9780306414190(1995).
- ^ O. Flomenbom, J. Klfter, A. Szabo, 2개의 상태 단일 분자 궤적으로부터 무엇을 배울 수 있는가? 2012년 1월 14일 바이오피스 웨이백 머신에 보관. J. 88, 3780–3783(2005); arXiv:q-bio/0502006
- ^ Srinivasan, Bharath (2020-10-08). "Explicit Treatment of Non Michaelis-Menten and Atypical Kinetics in Early Drug Discovery". dx.doi.org. Retrieved 2020-11-09.
- ^ O. Flomenbom과 R. J. Silbey, 두 개의 주 궤도에 정보 콘텐츠 활용 2012년 1월 14일, 웨이백 머신 Proc에 보관. 나틀. 아카드. Sci. USA 103, 10907–10910(2006년).
- ^ O. Flomenbom과 R. J. Silbey, 유한 2 상태 궤적을 분석하기 위한 툴박스, Phys. 개정 E 78, 066105(2008); arXiv:0802.1520.
- ^ O. Flomenbom, K. 벨로니아, D. Loose, et al. 변동하는 단일 리파아제 분자의 촉매 활성에서 기하급수적인 붕괴 및 상관 관계 2012년 1월 14일 웨이백머신, Proc에 보관. 나틀. 아카드. Sci. US 102, 2368–2372(2005)
- ^ Zhan, Hong; Stanciauskas, Ramunas; Stigloher, Christian; Dizon, Kevin K.; Jospin, Maelle; Bessereau, Jean-Louis; Pinaud, Fabien (2014). "In vivo single-molecule imaging identifies altered dynamics of calcium channels in dystrophin-mutant C. elegans". Nature Communications. 5: ncomms5974. Bibcode:2014NatCo...5.4974Z. doi:10.1038/ncomms5974. PMC 4199201. PMID 25232639.
- ^ Walder, R.; Nelson, N.; Schwartz, D. K. (2011). "Super-resolution surface mapping using the trajectories of molecular probes". Nature Communications. 2: 515. Bibcode:2011NatCo...2..515W. doi:10.1038/ncomms1530. PMID 22044994.