실릴린
Silylene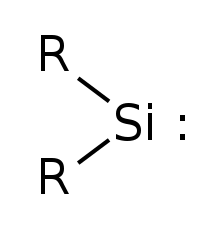 가장 간단한 실렌은 R=수소를 가지고 있다. | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 실릴린 | |
| 체계적 IUPAC 이름 실리데네[citation needed] | |
| 기타 이름 수소 규산염(-)II) 실리콘 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
펍켐 CID | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| H2SI | |
| 어금질량 | 30.101 g·1901−1 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
Silylene은 SiH라는2 공식을 가진 화학 화합물이다.가장 단순한 카베네인 메틸렌의 실리콘 아날로그다.실릴렌은 기체로써 안정된 분자지만 응축되면 양분자 방식으로[clarification needed] 빠르게 반응한다.싱글렛이나 트리플렛 상태로 존재할 수 있는 카베네와는 달리 실릴렌(및 그 파생상품 모두)은 싱글렛이다.null
실릴렌은 다른 대체물로 대체된 그것의 하이드로겐과 함께 실릴렌의 공식적인 파생상품이다.[1]대부분의 예는 아미도(NR2) 또는 알킬/아릴 그룹을 특징으로 한다.[2][3]실릴렌은 반응성 매개체로 제안되어 왔다.그들은 카베네 유사점이다.[4]null
합성 및 특성
실릴렌은 일반적으로 폴리실레인의 열분해 또는 광분해, 실리콘 원자 반응(삽입, 첨가 또는 추상화), 실레인의 열분해 또는 1,1-디할로실레인의 감소에 의해 합성된다.금속 Si에서 4가 실리콘 화합물로의 변환은 실릴렌 중간물을 통해 진행된다고 오랫동안 가정되어 왔다.
- Si + Cl2 → SiCl2
- SiCl2 + Cl2 → SiCl4
염화 메틸과 벌크 실리콘의 반응인 직접 공정에도 유사한 고려사항이 적용된다.null
실릴렌의 초기 관찰은 디메틸디클로로실렌의 탈염소화에 의한 디메틸실렌의 생성을 포함했다.[5]
- SiCl2(CH3)2 + 2K → Si(CH3)2 + 2 KCl
디메틸실렌의 형성은 트리메틸실레인(trimethylsilane)이 있는 곳에서 탈염소화를 실시하여 입증되었으며, 갇힌 제품은 펜타메틸디실레인(pentamethyldisilane)이다.
- Si(CH3)2 + HSi(CH3)3 → (CH3)2Si(H)−Si(CH3)3
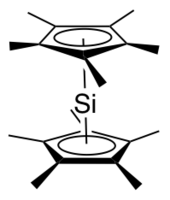
실온 분리형 N-헤로시클릭실린(N-heterocyclic silylene)은 N,Ndia-di-tert-butyl-1,3-diaza-2-silacyclopent-4-en-2-ylidene)으로, 1994년 Michael K에 의해 처음 기술되었다. 덴크 [6]외null
α-아미도 중심은 π-기부에 의해 실릴레네스를 안정시킨다.디오르고실리콘 디할라이드의 디할로겐화는 널리 이용되고 있다.[7]null
관련 반응
한 연구에서 diphenylsilylene은 트리실레인의 플래시 광분해에 의해 생성된다.[8]
이 반응에서 디페닐릴렌은 트리실라 링에서 압출된다.실릴렌은 520nm의 UV 분광법으로 관측할 수 있으며 화학적 반감기가 2마이크로초의 짧은 수명을 가지고 있다.첨가된 메탄올은 2차 순서가 1.3×1010 mols로−1−1 확산 제어에 가까운 화학적 트랩 역할을 한다.null
참고 항목
참조
- ^ Mizuhata, Yoshiyuki; Sasamori, Takahiro; Tokitoh, Norihiro (2009). "Stable Heavier Carbene Analogues". Chemical Reviews. 109 (8): 3479–3511. doi:10.1021/cr900093s. PMID 19630390.
- ^ a b Nagendran, Selvarajan; Roesky, Herbert W. (2008). "The Chemistry of Aluminum(I), Silicon(II), and Germanium(II)". Organometallics. 27 (4): 457–492. doi:10.1021/om7007869.
- ^ Haaf, Michael; Schmedake, Thomas A.; West, Robert (2000). "Stable Silylenes". Accounts of Chemical Research. 33 (10): 704–714. doi:10.1021/ar950192g. PMID 11041835.
- ^ Gaspar, Peter; West, R. (1998). "Silylenes". The Chemistry of Organic Silicon Compounds. Chemistry of Organic Silicon Compounds. The Chemistry of Functional Groups. Vol. 2. pp. 2463–2568. doi:10.1002/0470857250.ch43. ISBN 0471967572.
- ^ Skell, P. S.; Goldstein, E. J. (1964). "Dimethylsilene: CH3SiCH3". Journal of the American Chemical Society. 86 (7): 1442–1443. doi:10.1021/ja01061a040.
- ^ Denk, Michael; Lennon, Robert; Hayashi, Randy; West, Robert; Belyakov, Alexander V.; Verne, Hans P.; Haaland, Arne; Wagner, Matthias; Metzler, Nils (1994). "Synthesis and Structure of a Stable Silylene". Journal of the American Chemical Society. 116 (6): 2691–2692. doi:10.1021/ja00085a088.
- ^ Driess, Matthias; Yao, Shenglai; Brym, Markus; Van Wüllen, Christoph; Lentz, Dieter (2006). "A New Type of N-Heterocyclic Silylene with Ambivalent Reactivity". Journal of the American Chemical Society. 128 (30): 9628–9629. doi:10.1021/ja062928i. PMID 16866506.
- ^ Moiseev, Andrey G.; Leigh, William J. (2006). "Diphenylsilylene". Journal of the American Chemical Society. 128 (45): 14442–14443. doi:10.1021/ja0653223. PMID 17090011.