프로이슬린
Proinsulin| 인슐린 | |||||||
|---|---|---|---|---|---|---|---|
 인슐린은 생산 경로를 따라 변환 후 광범위한 수정을 거친다. 생산과 분비는 대부분 독립적이다; 준비된 인슐린은 분비를 기다리며 저장된다. C-펩타이드와 성숙한 인슐린 모두 생물학적으로 활발하다. 이 이미지의 세포 성분과 단백질은 크기가 작아지지 않는다. | |||||||
| 식별자 | |||||||
| 기호 | INS | ||||||
| 엔씨비유전자 | 3630 | ||||||
| HGNC | 6081 | ||||||
| 오밈 | 176730 | ||||||
| RefSeq | NM_000207 | ||||||
| 유니프로트 | P01308 | ||||||
| 기타자료 | |||||||
| 로커스 | 11번 씨 p15.5 | ||||||
| |||||||
프로이슐린은 췌장의 전문 지역인 랑게르한스 섬의 베타 세포에서 만들어진 인슐린의 프로호르몬 전구체다. 인간에서 프로이슬린은 INS 유전자에 의해 암호화된다.[1][2] 랑게르한스 섬은 프로이슬린의 1%~3% 정도만 온전한 상태로 분비된다.[3] 그러나 프로이슬린은 인슐린보다 반감기가 길기 때문에 혈액 속에서 순환하는 인슐린 같은 구조의 5~30%를 어느 곳에서나 차지할 수 있다.[3] 식후에는 프로인슐린 농도가 높고, 단식시에는 수치가 낮다.[3] 또한 프로이슬린과 인슐린은 구조적 차이를 가지고 있지만 프로이슬린은 인슐린 수용체에 어느 정도 친화력을 보인다. 프로이슬린은 구조상 상대적인 유사성으로 인해 인슐린에 의해 유사하게 유발되는 대사 활동의 5%에서 10% 사이에서 생성될 수 있다.[3]
프로이슐린은 성숙한 인슐린으로 갈라지기 전에 세포에 의해 분비되는 마지막 단일 체인 단백질 구조물이다.[4] 프로이슬린은 도널드 F 교수에 의해 발견되었다. 1967년 시카고 대학의 스타이너.[5]
구조
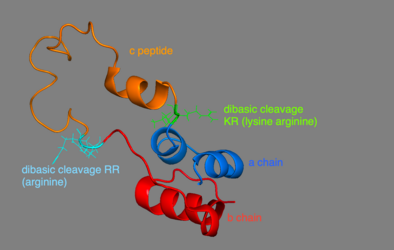
프로이슬린은 인간의 86개 잔류물(소의 81개)으로 구성되며,[6] 3개의 뚜렷한 체인으로 형성된다.[7] A 체인, B 체인, 그리고 둘을 연결하는 부위는 C 펩타이드라고 명명했다.[7] 프로이슬린의 정확한 구조는 성숙한 인슐린의 정확한 접힘에 결정적이다. C 펩타이드의 배치로 분자가 A와 B 체인의 안과 사이에 이황화물 결합을 정확하게 배치하게 되기 때문이다.[7][8] 성숙한 인슐린이 정확한 구조가 되기 위해 필요한 이황화 결합은 세 가지가 있다. 이황화채 중 두 채는 A와 B사슬 사이에 있으며, 한 채는 A사슬 내부 결합이다.[7] 이황화 결합은 A 사슬과 B 사슬의 7번째 잔류물, A 사슬의 20번째 잔류물과 B 사슬의 19번째 잔류물, 그리고 A 사슬의 6번째와 11번째 잔류물 사이에 발생한다.[9]
C 펩타이드 는 프로이슬린의 A와 B사슬 사이에 있다.[7] A 체인과 C 펩타이드의 연결은 C 펩타이드와 B 체인의 접합부보다 훨씬 안정적이며, C 펩타이드-A 체인 연결부근에 알파 헬리컬 특징이 나타난다.[10] C 펩타이드-A 체인 접합부는 프로이슬린의 잔류물 64와 65 사이에 발생한다. 이것들은 각각 리신과 아르기닌 분자들이다.[10] C 펩타이드-B 체인 연결부는 프로이슬린 31 및 32 위치에 있는 두 개의 아르기닌 잔류물 사이에 있다.[10]
포유류 종들 사이에서는 프로이슬린 구조의 상당 부분이 보존되어 있으며, C 펩타이드에 존재하는 한 종에서 다른 종으로 잔존물의 많은 변화들이 보인다.[8][11] 그렇긴 하지만, 종에 걸쳐 보존된 C 펩타이드의 잔류물은 A와 B 체인의 보존된 잔류물과 유사하게 상호작용한다.[8] 따라서, 이러한 보존된 잔여물은 성숙한 인슐린의 기능성에 중요하다고 가정한다.[8]
합성 및 변환 후 수정
프로이슐린은 거친 내포체성 망막에서 발견된 막 관련 리보솜에 합성되어 있으며, 여기서 접히고 이황화 결합이 산화된다. 그런 다음 골기 기구로 운반되어 분비된 염소로 포장되고, 일련의 보호제에 의해 처리되어 성숙한 인슐린을 형성한다. 성숙한 인슐린은 35개의 아미노산을 가지고 있다; 4개는 모두 제거되고, 나머지 31개는 C-펩타이드로 만들어진다. C-펩타이드(C-펩타이드)는 프로이슬린 수열의 중심에서 추출된다. 다른 두 끝(B 체인 및 A 체인)은 이황화 결합에 의해 연결된다.
프로인슐린을 성숙한 인슐린으로 변환한 후 수정은 랑게르한스 섬의 베타 세포에서만 일어난다.[12] 프로이슐린이 골지 기구를 통해 운반되면 C-펩타이드(C-펩타이드)가 분해된다.[9] 이 갈라진 틈은 두 개의 내복약으로 일어난다.[13] 1형 내복제 PC1과 PC3은 C 펩타이드-B 체인 연결을 방해한다.[13] 제2형 내단백질제인 PC2는 C 펩타이드-A 체인 본드를 분리한다.[13] 결과분자인 현재 성숙된 인슐린은 분비된 베실체에 헥사머로 저장되며, 분비될 까지 2+ 이온으로 안정화된다.[9]
면역유전성
인슐린이 원래 소나 포신 췌장에서 정제되었을 때 프로이슬린은 완전히 제거되지 않았다.[14][15] 일부 사람들이 이런 인슐린을 사용했을 때 프로이슬린은 인슐린이 주입된 곳에서 인체에 발진과 반응하거나 인슐린에 저항하거나 심지어는 피부에 움푹 들어가거나 덩어리를 만드는 원인이 되었을 수 있다. 이것은 다른 종의 프로이슬린 사이에 약간의 차이로 인한 이아트로겐성 상해라고 말할 수 있다. 고도로 정제된 포르신 인슐린이 도입된 1970년대 후반부터 인슐린 순도 99%에 이르면서 이는 중대한 임상 문제가 되지 않게 되었다.[16] 인슐린 약동학에 대한 그들의 영향과 관련하여, 인슐린 결합 항체가 인슐린의 간극률과 분포 공간을 효과적으로 증가시키고 도움을 주기 때문에 내인성 인슐린 분비가 없는 모든 당뇨병 환자들(예: 제1형 당뇨병을 가진 사람들)에게 적당한 농도의 인슐린 항체가 긍정적인 이점이 될 수 있다. 그 약리학적 생물학적 반감기를 연장하는 것.[17][clarification needed]
의료 관련성
역사적으로 많은 인슐린 관련 대사 질환의 초점은 성숙한 인슐린에 집중되어 왔다. 그러나 최근에는 이러한 질병과 관련하여 프로이슬린 또는 프로이슬린:인슐린 비율의[18] 구조와 기능을 연구하는 것의 중요성이 점점 명확해지고 있다.
멜리투스 당뇨병
성숙한 인슐린 농도에 비해 순환기 계통의 프로이슬린 수치가 증가하면 인슐린 저항성과 제2형 당뇨병의 발생이 임박했음을 나타낼 수 있다.[19] 당뇨병을 유발할 수 있는 프로이슬린에 대한 추가적인 문제에는 존재하는 사이스틴 수의 돌연변이가 포함되어 있어 정확한 접기에 영향을 미칠 수 있다.[9] 만약 돌연변이가 가벼운 변화만 일으킨다면 그것은 단지 단백질을 적절하게 접는 내소성 망막의 능력을 강조할 수 있을 것이다.[9] 이러한 스트레스는 잠시 후 성숙한 인슐린을 생성하는 β세포의 수가 감소하고, 그 후 당뇨병을 일으킬 것이다.[9]
신생아 당뇨병 멜리투스
산후 프로인슐린은 대사 조절에 매우 중요하다. 그러나 신생아의 프로이슬린은 눈의 정상적인 발달, 심장의 발달, 배아세포의 일반적인 생존을 위해 중요하다.[20] 너무 많거나 적은 양의 펩타이드로 태아의 결함과 사망을 유발할 수 있기 때문에 배아 발달 중 프로이슬린 농도의 조절은 매우 중요하다.[20] 지금까지 신생아 당뇨병에 대한 연구에서 B영역에서 발견된 아미노산 변화 돌연변이만이 이 질환으로 이어진다.[9]
참고 항목
- 인슐린
- 프리프로인슐린
- 신호 펩타이드
- 신호 펩타이드 펩타이드효소
- 프로프로틴 변환효소 1(PC1)
- 프로프로틴 변환효소 2(PC2)
참조
- ^ "Entrez Gene: INS insulin".
- ^ Bell GI, Pictet RL, Rutter WJ, Cordell B, Tischer E, Goodman HM (March 1980). "Sequence of the human insulin gene". Nature. 284 (5751): 26–32. Bibcode:1980Natur.284...26B. doi:10.1038/284026a0. PMID 6243748. S2CID 4363706.
- ^ a b c d "Interpretation for 80908 Proinsulin, Plasma". www.mayomedicallaboratories.com. Retrieved 2017-03-09.
- ^ Assali NS, Clark KE, Zugaib M, Brinkman CR, Nuwayhid B (1995). "Effects of estrogenic hormones on uteroplacental hemodynamics and progesterone production in the sheep". International Journal of Fertility. 23 (3): 219–23. PMC 8333766. PMID 40897.
- ^ Philipson LH, Bell G, Polonsky KS (January 2015). "Donald F. Steiner MD, 1930-2014: discoverer of proinsulin". Proceedings of the National Academy of Sciences of the United States of America. 112 (4): 940–1. Bibcode:2015PNAS..112..940P. doi:10.1073/pnas.1423774112. PMC 4313841. PMID 25561547.
- ^ UniProt의 "INS_HUMAN"에 대한 범용 단백질 자원 접근 번호 P01308.
- ^ a b c d e Nolan C, Margoliash E, Peterson JD, Steiner DF (May 1971). "The structure of bovine proinsulin". The Journal of Biological Chemistry. 246 (9): 2780–95. doi:10.1016/S0021-9258(18)62252-5. PMID 4928892.
- ^ a b c d Snell CR, Smyth DG (August 1975). "Proinsulin: a proposed three-dimensional structure". The Journal of Biological Chemistry. 250 (16): 6291–5. doi:10.1016/S0021-9258(19)41065-X. PMID 808541.
- ^ a b c d e f g Weiss MA (July 2009). "Proinsulin and the genetics of diabetes mellitus". The Journal of Biological Chemistry. 284 (29): 19159–63. doi:10.1074/jbc.R109.009936. PMC 2740536. PMID 19395706.
- ^ a b c Yang Y, Hua QX, Liu J, Shimizu EH, Choquette MH, Mackin RB, Weiss MA (March 2010). "Solution structure of proinsulin: connecting domain flexibility and prohormone processing". The Journal of Biological Chemistry. 285 (11): 7847–51. doi:10.1074/jbc.c109.084921. PMC 2832934. PMID 20106974.
- ^ Bell GI, Pictet RL, Rutter WJ, Cordell B, Tischer E, Goodman HM (March 1980). "Sequence of the human insulin gene". Nature. 284 (5751): 26–32. Bibcode:1980Natur.284...26B. doi:10.1038/284026a0. PMID 6243748. S2CID 4363706.
- ^ Groskreutz DJ, Sliwkowski MX, Gorman CM (February 1994). "Genetically engineered proinsulin constitutively processed and secreted as mature, active insulin" (PDF). The Journal of Biological Chemistry. 269 (8): 6241–5. doi:10.1016/S0021-9258(17)37593-2. PMID 8119968.
- ^ a b c Kaufmann JE, Irminger JC, Halban PA (September 1995). "Sequence requirements for proinsulin processing at the B-chain/C-peptide junction". The Biochemical Journal. 310 (3): 869–74. doi:10.1042/bj3100869. PMC 1135976. PMID 7575420.
- ^ Wilson RM, Douglas CA, Tattersall RB, Reeves WG (September 1985). "Immunogenicity of highly purified bovine insulin: a comparison with conventional bovine and highly purified human insulins". Diabetologia. 28 (9): 667–70. doi:10.1007/BF00291973. PMID 3905477.
- ^ Tanyolac S, Goldfine ID, Kroon L. "Insulin Pharmacology, Type of Regimens and Adjustments". Endotext.com. Archived from the original on 2011-07-25. Retrieved 2011-03-18.
- ^ Home PD, Alberti KG (November 1982). "The new insulins. Their characteristics and clinical indications". Drugs. 24 (5): 401–13. doi:10.2165/00003495-198224050-00003. PMID 6756879. S2CID 28616749.
- ^ Gray RS, Cowan P, di Mario U, Elton RA, Clarke BF, Duncan LJ (June 1985). "Influence of insulin antibodies on pharmacokinetics and bioavailability of recombinant human and highly purified beef insulins in insulin dependent diabetics". British Medical Journal. 290 (6483): 1687–91. doi:10.1136/bmj.290.6483.1687. PMC 1416075. PMID 3924216.
- ^ Mezza T, Ferraro PM, Sun VA, Moffa S, Cefalo CM, Quero G, et al. (November 2018). "Increased β-Cell Workload Modulates Proinsulin-to-Insulin Ratio in Humans". Diabetes. 67 (11): 2389–2396. doi:10.2337/db18-0279. PMID 30131390.
- ^ Mykkänen L, Haffner SM, Hales CN, Rönnemaa T, Laakso M (December 1997). "The relation of proinsulin, insulin, and proinsulin-to-insulin ratio to insulin sensitivity and acute insulin response in normoglycemic subjects". Diabetes. 46 (12): 1990–5. doi:10.2337/diab.46.12.1990. PMID 9392485. S2CID 44874023.
- ^ a b Hernández-Sánchez C, Mansilla A, de la Rosa EJ, de Pablo F (June 2006). "Proinsulin in development: New roles for an ancient prohormone". Diabetologia. 49 (6): 1142–50. doi:10.1007/s00125-006-0232-5. PMID 16596360.