MTRR(유전자)
MTRR (gene)| MTRR | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||
| 에일리어스 | MTRR, MSR, cblE, 5-메틸테트라히드로폴산메틸전달효소환원효소 | ||||||||||||||||||||||||
| 외부 ID | OMIM : 602568 MGI : 1891037 HomoloGene : 11419 GenCard : MTRR | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 맞춤법 | |||||||||||||||||||||||||
| 종. | 인간 | 마우스 | |||||||||||||||||||||||
| 엔트레즈 | |||||||||||||||||||||||||
| 앙상블 | |||||||||||||||||||||||||
| 유니프로트 | |||||||||||||||||||||||||
| RefSeq(mRNA) | |||||||||||||||||||||||||
| RefSeq(단백질) | |||||||||||||||||||||||||
| 장소(UCSC) | Chr 5: 7.85 ~7.91 Mb | Chr 13: 68.71 ~68.73 Mb | |||||||||||||||||||||||
| PubMed 검색 | [3] | [4] | |||||||||||||||||||||||
| 위키데이터 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
MSR로도 알려진 메티오닌 합성효소 환원효소는 사람에게서 MTRR [5][6]유전자에 의해 암호화되는 효소이다.
기능.
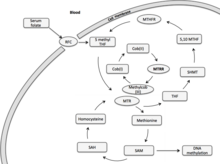
메티오닌은 단백질 합성과 일탄소 대사에 필요한 필수 아미노산이다.그것의 합성은 메티오닌 합성효소에 의해 촉매된다.메티오닌 합성효소는 코발라민 보조인자의 산화로 인해 결국 비활성 상태가 된다.메티오닌합성효소환원효소는 환원메틸화를 통해 기능성 메티오닌합성효소를 재생한다.페레독신-NADP(+) 환원효소([6]FNR) 계열의 전자전달효소이다.
메티오닌합성효소환원효소(MTRR)는 주로 메틸담체로서 메틸코브(I)알라민을 이용하여 호모시스테인의 [7]메티오닌으로의 환원메틸화에 관여한다.메티오닌은 포유류의 필수 아미노산으로 단백질 합성과 하나의 탄소 대사에 필요하다.활성화된 형태에서 S-아데노실메티오닌은 생물학적 트랜스메틸화 반응에서 메틸기여체 및 폴리아민 [7]합성의 프로필아민기여체로서 작용한다.메티오닌 탈메틸화의 주요 산물은 호모시스테인이다.호모시스테인의 재메틸화는 코발라민 의존 효소인 메티오닌 합성효소(MTR)[7]를 통해 일어난다.엽산 회로는 MTR을 [8]통해 호모시스테인 대사와 연결된다. 혈중 엽산(5-메틸 테트라히드로폴산, 5-MTHF)은 MTR에 메틸기를 기증하여 세포 메틸화에 활용된다.중간 메틸담체 메틸코발트결합인 메틸코브(III)알라민을 고반응 산화상태에서 헤테로 분해하여 코발라민을 cob(I)알라민으로 한다.MTR 효소의 효소 결합 cob(I) 알라민 보조 인자는 5-MTHF와 호모시스테인 [7]사이에서 메틸 운반체로 기능합니다.코브(I)알라민은 산화되어 코브(Cob)가 된다.II) 약 100 메틸 전달 사이클에 1회 알라민, cob(I)알라민-MTR-효소 복합체를 비활성 [9]상태로 만든다.이 효소 복합체의 재활성화는 MTRR에 의한 환원성 재메틸화를 통해 이루어지며, 메틸 공여체로서 S-아데노실메티오닌을 이용한다.MTR 재활성화는 또한 용해성 시토크롬 b5와 환원효소 1이라는 두 가지 산화환원 단백질과 관련된 NADPH 의존적일 수 있다.단, 이 경로는 재활성화에서 작은 역할을 담당하며, MTRR은 이러한 환원적 재활성화의 주요 요인으로 남아 있다.
MTRR에 의해 영향을 받는 생물학적 과정은 황 아미노산 대사 과정, DNA 메틸화, 메티오닌 대사 과정, 메티오닌 생합성 과정, 메틸화, S-아데노실메티오닌 회로, 호모시스테인 이화 과정, 엽산 대사 과정, 산화 환원 과정 및 시스타티오닌 베타-신타스의 음성 조절을 포함한다.e [7][8]액티비티
MTRR 유전자
메티오닌 합성효소 환원효소(MTRR) 유전자는 주로 코브(I) 알라민(비타민 B12)[10]의 환원 재생에 작용합니다.코브(I) 알라민은 폴산과 메티오닌 대사를 연결하는 메티오닌 합성효소(MTR) 메티오닌 합성효소의 활성화를 유지하는 보조인자입니다.엽산으로부터의 메틸기 기증은 세포 및 DNA 메틸화에 이용되어 후생유전 [10][7][11]유전에 영향을 준다.
에일리어스
- 5-메틸테트라히드로폴산호모시스테인메틸전달효소환원효소
- MSR
- [메티오닌합성효소]-코발라민메틸전달효소(Cob(II))알라민 저감)
- 메티오닌합성효소환원효소, 미토콘드리아
- EC 1.16.1.8
- CBLE
매핑
그 유전자는 인간 염색체 5에 매핑되었다.유전자 특이 프라이머 쌍은 인간 유전 [5]물질로 염색체 5만을 포함하는 하이브리드 매핑 패널에 크기에 맞는 제품의 PCR 증폭을 초래했다.제품 DNA 배열은 이 염색체에 특정한 사전 설정된 유전자 표지와 일치했다.정확한 유전자 세포 발생 위치는 현장에서의 형광 [5]교배를 통해 유전자를 포함하는 인공 염색체 구조에 매핑함으로써 결정되었다.정확한 MTRR 유전자 위치는 5p15.3-p15.[5]2로 매핑되었다.
구조.
MTRR 유전자는 Ferredoxin-NADP(+) 환원효소(FNR) 패밀리로 알려진 전자전달효소 패밀리와 관련되어 있습니다.인간의 15개 영장류와 16개 이상의 조직에서 발견되는 MTRR의 [12]길이는 34KB이다.이 유전자는 15개의 엑손으로 구성되며 수많은 세포질 미토콘드리아 mRNA 동질체를 포함한다.복수의 보조인자 결합 부위는 환원적 재메틸화를 통해 MTR 활성의 유지를 돕는다.flavodoxin_1 도메인을 제외한 모든 [12]결합 도메인은 선택적 상호작용과 비공유 상호작용을 포함한다.
보조 요인 바인딩 사이트
플라보독신-1 도메인
플라보 단백질은 특정 산화환원 활성 보철기를 결합하는 유비쿼터스 생물 촉매이다.이 도메인은 전자 전달 단백질과 연관되어 전자 전달 시스템에 [12]사용됩니다.보조인자 플라빈 모노뉴클레오티드(FMN)는 도메인에 비공유적으로 결합되어 전자전달 또는 페레독신을 [12]조절하는 철-황 구성 단백질과 기능적으로 교환할 수 있다.
유행
플라빈 아데닌 디뉴클레오티드 산화환원효소 FAD는 플라빈 단백질 산화환원효소 효소의 보조인자이다.FAD를 포함한 플라보단백질 피리딘 뉴클레오티드 시토크롬 환원효소는 환원당량(H+ 또는 전자)의 교환을 촉매한다.초기 전자공여체 및 최종 전자수용체는 각각 [12]단일 전자담체와 니코틴아미드 디뉴클레오티드를 담당하는 2개의 전자를 포함한다.
NAD
산화환원효소 활성에 대응하는 진화 보존 단백질 도메인.NADP 결합은 NADP+를 [12]전자수용체로 사용하여 산화환원반응을 촉매하여 금속이온의 산화상태를 변화시킨다.
메티오닌합성효소환원효소활성
S-아데노실호모시스테인을 메틸 공여체로 하는 코브(II)알라민의 환원성 재메틸화에 관여한다.반응을 촉진합니다.
[메티오닌합성효소]- cob(II)알라민+NADPH++S-아데노실메티오닌→[메티오닌합성효소]-메틸코브(I)알라민+S-아데노실호모시스테인+NADP+[12]
아쿠아코발라민환원효소(NADPH)활성
산화환원효소 계열에 속하며, 전자수용체 역할을 하는 NADP+로 금속이온을 산화시킨다.다음 반응을 촉매할 때 보조 인자로 FAD를 사용합니다.
2 cob(II) alamin + NADP + 2 aquacob(III) alamin + NADPH + H+.[12]
플라빈아데닌디뉴클레오티드
보조인자 또는 보철물 그룹인 플라보단백질의 FAD와 상호작용하며 FAD 또는 FMN(플라빈 모노뉴클레오티드) 형태의 플라빈 부분을 포함한다.도메인은 산화 FAD 또는 환원된 형태인 하이드로퀴논(FADH2)[12]을 비공유적으로 결합한다.
FMN
플라빈 모노뉴클레오티드 결합 도메인은 플라빈단백질 산화환원효소인 FMN의 [12]조효소와 상호작용한다.
NADP
니코틴아미드 아데닌 디뉴클레오티드 인산염은 산화환원 및 생합성 반응에 존재하는 조효소이다.도메인은 [12]NADP를 산화 또는 환원 형태로 각각 NADP+ 또는 NADPH로 결합한다.
ADPH
NADP,[12] NADPH의 환원 형태와 비공유적이고 선택적 상호작용을 수반한다.
NADPH-혈단백질환원효소활성
이 도메인은 산화환원효소 계열과 연관되어 있으며 전자수용체로 헴 단백질을 사용하여 NADH 또는 NADPH에 작용한다.반응을 촉매하기 위한 보조 인자로 FAD와 FMN이 필요합니다.
NADPH + H+ + n 산화혈단백질 = NADP + + n 환원혈단백질.[12]
단백질 결합
단백질 또는 단백질 [12]복합체와의 상호작용에 관여하는 결합 도메인.
다형
병원성 돌연변이
- (MTRR):c.66A>G – 코돈22에서 이소류신을 메티오닌으로 변환하는 다형성.이 변환은 FMN 바인딩 [13]도메인 내에서 발견되어 영향을 줍니다.
- (MTRR): c.524C>T – 코돈 175에서 세린에서 류신 치환.세포 내 코발라민 대사 [14]장애와 관련된 양성 돌연변이.
- (MTRR): c.1049A>G – 코돈 [15]350에서 리신에서 아르기닌으로의 치환.
- (MTRR): c.1349C>G – 코돈 450에서 프롤린에서 아르기닌으로의 치환.비정상적인 세포 내 코발라민 대사 [16]장애와 관련된 유병률.
- (MTRR): c.903+469C - Exon 6과 7 사이의 깊은 인트로닉 삽입(r.903_904ins140).트레오닌에서 시스테인으로 변화하여 인트론 [17]6에서 엑손 스플라이싱 인핸서가 활성화된다.
- (MTRR): c.1361C>T – 코돈 454에서 세린에서 류신으로의 치환을 수반하는 희귀 다형성.이베리아 돌연변이로 알려져 있으며, 코발라민 대사 장애로 인한 호모시스티뇨증 거대아세포성 빈혈에 만연합니다.서로 다른 [18]염색체에서 메틸시토신의 탈아미노화를 통해 주로 세 가지 다른 할로타입(GTACG, GCACA, GCACG)을 얻었다.
- (MTRR): c.1459G>A – 코돈 487에서 글리신에서 아르기닌으로의 치환을 포함한다.MTRR에 저장되며 FAD 바인딩 도메인 내에서 발생하는 것으로 확인되었습니다.선천적인 [19]유전병과 관련된 병원성.
- (MTRR): c.1573C>T: 코돈 525에서 [20]조기 종료 코돈에 의한 Arginine 치환.
- (MTRR): c.1622_1623dupTA – 조기 종료 코돈이 형성됩니다.CblE 타입의 [21]호모시스티뇨증과 관련된 병원성.
- (MTRR):r.1462_1557del96:7 베이스 쌍의 삭제에 의한 exon 11의 스플라이싱과 관련되어 있습니다.이 돌연변이 대립 유전자의 대규모 결실은 FAD 결합 도메인에 c-말단이 없는 결과를 초래한다.CblE 타입의 [21]호모시스티뇨증과 관련된 병원성.
- (MTRR): c.1953-6_1953-2del5 – CblE 타입의 호모시스틴뇨와 관련된 신규 돌연변이.이 돌연변이에서 발생하는 불안정한 mRNA는 번역에 필요한 mRNA의 부재를 초래하여 병원성을 [21]생성한다.
조기종단 코돈 형성과 관련된 돌연변이는 [21]번역될 경우 잘린 돌연변이 단백질을 야기한다.돌연변이는 FAD/NADPH 바인딩 도메인이 없고 NMD(Nonsense Mediated Decovery)에 의해 불안정한 mRNA를 나타냅니다.NMD는 (MTRR):c.1573C>T 또는 (MTRR):c.1622_1623dupp에는 존재하지 않습니다.TA [21]다형성(MTRR): c.903+469T>C 배리언트는 조기 종료 코돈의 [21]형성과도 관련되어 있습니다.
기타 돌연변이
- (MTRR): c.1911G> A –– 코돈 637에서 양성 동의어 돌연변이(알라닌에서 알라닌으로).코발라민 [22]대사 장애와 관련이 있다.
임상적 의의
MTRR 유전자의 단일 뉴클레오티드 다형(SNPs)은 MTR 활성을 손상시켜 메티오닌에 대한 메틸화 저하로 인해 호모시스테인 수치가 상승한다.호모시스테인 수치가 높아지는 것은 임신 합병증, 심혈관 질환,[23] 암, 거적아구성 빈혈, 알츠하이머병 및 [24]노인의 인지 기능 장애 외에 선천적 기형과 관련이 있다.돌연변이 변이체(66A>G)의 존재는 심장 이식 [23]환자의 혈장 코발라민 및 엽산 수치가 최대 4배까지 현저히 낮은 것과 관련이 있다.결과적으로 S-아데노실메티오닌 가용성의 감소는 DNA 저메틸화를 초래한다.낮은 엽산은 비타민 B12가 이 [24]경로에서 엽산과 상호작용하기 때문에 하나의 탄소 대사와 호모시스테인 대사를 제한한다.또한 이 돌연변이는 제2형 [25]당뇨병의 위험 증가와 관련이 있다.
암
특정 SNP는 폐암의 위험 증가와 관련이 있으며 이 병인에서 엽산 섭취와 상호 작용한다.(MTRR) : c.66A > G 돌연변이는 폐암 위험의 현저한 증가와 관련이 있습니다.다형성(MTR) 2756A>G와 함께 발현하면 용량 의존적으로 [24]폐암 위험을 더욱 높일 수 있다.이 다형성과 폐암의 위험 증가 사이의 상관관계는 낮은 엽산 섭취와 높은 비타민 B12로 나타나며, 이는 [24]B12의 독립적인 작용 메커니즘을 시사이다.이 돌연변이는 또한 대장암,[26][27][28][29] 급성 림프아구성 백혈병,[30] 방광암,[31] 자궁경부 상피내 종양,[33] 비호지킨 림프종[32] 및 식도 편평상피세포암의 위험 증가와 관련이 있다.
CblE형 호모시스티뇨증
MTR에 의한 호모시스테인의 메티오닌으로의 재메틸화는 코발라민인 메틸코발라민의 유도체를 필요로 한다.코발라민 대사는 플라즈마 단백질 트랜스코발라민(II)에 결합된 코발라민의 엔도사이토시스(endocytosis)에 의해 개시된다.이 복합체의 분열은 리소좀에서 세포질로 이동하면서 유리 코발라민을 생성한다.마이토크론드리아 효소인 메틸말론드리아 조효소 A 뮤타아제를 활성화하는 5'-디옥시아데노실코발라민(AdoCbl) 또는 메틸코발라민(MeCbl)[34]으로 전환될 수 있다.Cobalamin 대사의 오류는 MeCbl 감소와 AdoCbl의 영향을 받지 않는 Cbl형 [34]호모시스티뇨증의 특징이다.상염색체 열성 유전에서는 이러한 상보성은 드물다.유전되는 메티오닌 합성효소 기능결핍은 MTR 효소를 활성화하는 데 필요한 환원 시스템의 결함에 해당합니다.이 질환의 증상은 발달지체, 거적아구성빈혈, 호모시스테닌뇨증, 저메티오닌혈증, 뇌위축증 [34]및 고호모시스테인혈증을 포함한다.그러나 저메티오닌혈증은 여전히 일관성이 없는 증상이다.정상적인 코발라민 섭취와 함께 MeCbl 감소는 세포 내 메티오닌 생합성 감소를 시사한다.주로 소아기에 발생하며, 15개의 병원성 돌연변이가 CblE형 [35]호모시스티뇨증과 관련될 수 있다.또한 혈관 이상도 이 [36]결함과 관련이 있습니다.MTR 활성부위에서의 산화코발트 원자의 환원장애는 환원제로 [35]효소활성을 보정할 수 있는 이 상태와 관련된다.이 질환과 관련된 희귀 다형성으로는 (MTRR): c.1459G> A, (MTRR): c.1623-1624ins가 있습니다.TA 및 (MTRR): c.903+469T>C.[35](MTRR):c.1459G>A를 제외한 이러한 돌연변이에 의해 프레임 이동이 발생하여 조기 종료 코돈이 [35]생성됩니다.그 결과 생성물이 정상에서 멀어짐에 따라 돌연변이 mRNA가 발생하고 난센스 매개 붕괴(FMN)가 [35]개시된다.903+469에 대응하는 903_904ins140의 큰 삽입C는 CblE 병리학에서 가장 널리 사용되고 있습니다.인트론 6 내 강화 스플라이서의 활성화가 불완전하여 소량의 정상적인 스플라이스 MTRR mRNA가 [35]생성되며 [14C] 메틸테트라히드로폴산을 [35]사용하여 태아 진단이 가능하다.이러한 융모세포 또는 배양 양수세포 내의 아미노산에서 형성되는 자연 융모막 및 [14C]산에서의 돌연변이 분석은 CblE [35]결함을 나타낸다.또한 거세포성 빈혈은 CblE 결손의 대표적인 특징으로 OH-Cobalamin 투여 또는 엽산 [35]보충을 통해 교정할 수 있다.
관상 동맥 질환
황계 아미노산인 호모시스테인은 메티오닌 탈메틸화의 주요 산물이다.호모시스테인 증가는 심혈관 질환의 독립적 위험인자이며 소비된 비타민 B12/B6 및 엽산 [37]수치와 역상관된다.MTR에 의해 메티오닌에 대한 호모시스테인 메틸화가 촉매되어 비독성 호모시스테인 수치와 함께 적절한 세포 내 메티오닌 및 테트라히드로폴산 수치를 얻을 수 있다.GG 표현형은 고호모시스테인혈증과는 [37]무관하게 조기 관상동맥질환(CAD)의 발생을 촉진한다.고호모시스테인혈증은 내피세포 기능 장애, 혈소판 접착 및 혈관 평활근세포 [36]증식을 촉진하기 때문에 뇌, 관상동맥 및 말초 아테롬성 동맥경화 병리와 관련이 있다.DNA 손상과 호모시스테인 수치는 CAD 심각도에 비례합니다.호모시스테인 수준에 의존하는 인간 림프구의 미립자 빈도는 DNA 메틸화에서 활성 산소 종과 유라실 혼입을 증가시켜 유전자 변화와 점 [36]돌연변이를 촉진합니다.(MTRR): c.66A>G, 염색체를 포함한 다형성은 단편화되기 쉽다.이러한 염색체 손실 또는 전역 DNA 저메틸화는 주염색체 헤테로크로마틴의 응축, 미립자 형성 및 [36]배수의 위험 증가를 초래한다.이 돌연변이와 메티오닌 테트라히드로폴산 환원효소(MTHFR)의 677T 다형성은 DNA [36]손상 정도를 더욱 높이기 위해 작용한다.
메틸화 장애로 인한 저메틸화는 아테롬성 동맥경화증의 민감 [36]유전자를 조절하는 한편 아테롬성 동맥경화증 보호 유전자를 조절한다.이 이상은 아테롬성 동맥경화 병리학 중에 존재하며, 혈소판 유도 성장인자(PDGF)의 전사 활성을 증가시키고 평활근 세포 [36]증식을 촉진한다.
신경관 결함
두 갈래 척추
MTRR은 메틸합성효소 반응을 유지하기 위해 비타민 B12를 필요로 하는 반면, 엽산은 뉴클레오티드 전구체의 정상적인 합성에 필요하다.이것들은 정상적인 DNA 합성과 세포 메틸화 [7]반응을 보장한다.따라서 만성 엽산 또는 메틸 결핍은 비정상적인 DNA 메틸화와 관련된다.66A>G다형성은 신경관결함에서 업레귤레이션되어 척추분열 위험을 2배로 [38]높입니다.이 돌연변이에 대한 호모 접합증은 특히 순환 또는 양수에서 [13]낮은 세포 내 비타민[39] B12를 가진 척추 이피다에 대한 확립된 모성 위험 인자이다.비타민 B12는 혈장 메틸말론산(MMA)에 의해 반사되며, 혈장 메틸말론산은 B12 흡수 또는 신진대사의 장애를 나타낸다.[7]MTRR 돌연변이와 결합된 상승된 MMA는 척추 이피다의 [7]5배 증가에 해당한다.이 다형성의 작용 메커니즘은 어머니를 통해 이루어지기 때문에 부모에서 자녀로 이 돌연변이가 우선적으로 전달되지 않습니다.MTR-cob(I) 알라민-효소 복합체에 대한 비정상적인 MTRR 결합은 호모시스테인 메틸화 속도를 조절한다.결과적으로 메티오닌 및 S-아데노실메티오닌의 감소는 모두 신경관 [7]폐쇄와 관련된 DNA, 유전자 및 단백질 메틸화에 부정적인 영향을 미친다.신경조절 중 증식이 증가하면 DNA 뉴클레오티드의 가용성이 감소한다.이것들은 DNA메틸화 및 뉴클레오티드 형성이 손상되어 대체가 불가능하기 때문에 결과적으로 신경조절이 교란되어 신경관 [11]결손이 발생한다.이 돌연변이를 677C > T MTHFR 다형증과 함께 발현하면 독립적으로 작용하는 66A > G [7]돌연변이에 비해 척추 이형증의 위험이 더욱 높아집니다.
다운증후군
트리소미 21 또는 다운증후군은 [10][11][40]감수분열에서 비정상적인 염색체 분리에 의해 발생하는 가장 흔한 인간 염색체 이상이다.이 상태는 배란 전 난모세포 성숙을 나타내는 감수분열기(I) 및/[11]또는 수정을 나타내는 감수분열기(II) 중에 발생할 수 있다.이러한 단계에서 신진대사에 미치는 영향은 낮은 비타민 B12에 [41]의해 더욱 심해진다.호모시스테인의 메티오닌으로의 메틸화는 주로 (MTRR):c.66A>G다형성의 영향을 받는다.만성 호모시스테인 상승은 s-아데노실-L-호모시스테인 수치를 증가시켜 결과적으로 메틸전달효소 활성을 저해하고 DNA 저메틸화를 [10][42]촉진한다.이 돌연변이(GG 표현형)에 대해 동종인 산모는 헤테로 접합형(GA 표현형)[41]에 비해 다운증후군을 가진 아이를 가질 위험이 높다.지리적으로, 아일랜드 인구는 동족일 가능성이 높은 반면, 북미 인구는 일반적으로 이질적이어서,[11][41] 전자의 집단에서 다형성의 발생률이 더 높다.호모 접합 돌연변이 대립 유전자는 DNA 저메틸화와 감수성 비분리를 촉진하여 다운증후군의 [43]위험을 증가시킨다.이 다형성은 677C>T MTHFR [11]돌연변이와 함께 발현될 경우 독립적으로 2.5배의 위험 증가와 4배의 위험 증가와 관련이 있다.MTR2756A>G유전다형증과의 조합은 증후군 위험을 [11][42][44]더욱 높인다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c GRCh38: 앙상블 릴리즈 89: ENSG00000124275 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리즈 89: ENSMUSG000034617 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b c d Leclerc D, Wilson A, Dumas R, Gafuik C, Song D, Watkins D, Heng HH, Rommens JM, Scherer SW, Rosenblatt DS, Gravel RA (March 1998). "Cloning and mapping of a cDNA for methionine synthase reductase, a flavoprotein defective in patients with homocystinuria". Proceedings of the National Academy of Sciences of the United States of America. 95 (6): 3059–64. Bibcode:1998PNAS...95.3059L. doi:10.1073/pnas.95.6.3059. PMC 19694. PMID 9501215.
- ^ a b "Entrez Gene: MTRR 5-methyltetrahydrofolate-homocysteine methyltransferase reductase".
- ^ a b c d e f g h i j k van der Linden IJ, den Heijer M, Afman LA, Gellekink H, Vermeulen SH, Kluijtmans LA, Blom HJ (December 2006). "The methionine synthase reductase 66A>G polymorphism is a maternal risk factor for spina bifida". Journal of Molecular Medicine. 84 (12): 1047–54. doi:10.1007/s00109-006-0093-x. PMID 17024475. S2CID 24500664.
- ^ a b Zhang T, Lou J, Zhong R, Wu J, Zou L, Sun Y, Lu X, Liu L, Miao X, Xiong G (2013). "Genetic variants in the folate pathway and the risk of neural tube defects: a meta-analysis of the published literature". PLOS ONE. 8 (4): e59570. Bibcode:2013PLoSO...859570Z. doi:10.1371/journal.pone.0059570. PMC 3617174. PMID 23593147.
- ^ Vaughn JD, Bailey LB, Shelnutt KP, Dunwoody KM, Maneval DR, Davis SR, Quinlivan EP, Gregory JF, Theriaque DW, Kauwell GP (November 2004). "Methionine synthase reductase 66A->G polymorphism is associated with increased plasma homocysteine concentration when combined with the homozygous methylenetetrahydrofolate reductase 677C->T variant". The Journal of Nutrition. 134 (11): 2985–90. doi:10.1093/jn/134.11.2985. PMID 15514263.
- ^ a b c d Wang SS, Qiao FY, Feng L, Lv JJ (February 2008). "Polymorphisms in genes involved in folate metabolism as maternal risk factors for Down syndrome in China". Journal of Zhejiang University Science B. 9 (2): 93–9. doi:10.1631/jzus.B0710599. PMC 2225490. PMID 18257130.
- ^ a b c d e f g Hobbs CA, Sherman SL, Yi P, Hopkins SE, Torfs CP, Hine RJ, Pogribna M, Rozen R, James SJ (September 2000). "Polymorphisms in genes involved in folate metabolism as maternal risk factors for Down syndrome". American Journal of Human Genetics. 67 (3): 623–30. doi:10.1086/303055. PMC 1287522. PMID 10930360.
- ^ a b c d e f g h i j k l m n "MTRR - Methionine synthase reductase - Homo sapiens (Human) - MTRR gene & protein". Retrieved 2017-09-16.
- ^ a b Wilson A, Platt R, Wu Q, Leclerc D, Christensen B, Yang H, Gravel RA, Rozen R (August 1999). "A common variant in methionine synthase reductase combined with low cobalamin (vitamin B12) increases risk for spina bifida". Molecular Genetics and Metabolism. 67 (4): 317–23. doi:10.1006/mgme.1999.2879. PMID 10444342.
- ^ Hassan FM, Khattab AA, Abo El Fotoh WM, Zidan RS (September 2017). "A66G and C524T polymorphisms of methionine synthase reductase gene are linked to the development of acyanotic congenital heart diseases in Egyptian children". Gene. 629: 59–63. doi:10.1016/j.gene.2017.07.081. PMID 28778621.
- ^ G">"NM_002454.2(MTRR):c.1049A>G (p.Lys350Arg) AND not specified - ClinVar - NCBI". Retrieved 2017-09-16.
- ^ G">"NM_002454.2(MTRR):c.1349C>G (p.Pro450Arg) AND Disorders of Intracellular Cobalamin Metabolism - ClinVar - NCBI". Retrieved 2017-09-16.
- ^ Homolova K, Zavadakova P, Doktor TK, Schroeder LD, Kozich V, Andresen BS (April 2010). "The deep intronic c.903+469T>C mutation in the MTRR gene creates an SF2/ASF binding exonic splicing enhancer, which leads to pseudoexon activation and causes the cblE type of homocystinuria". Human Mutation. 31 (4): 437–44. doi:10.1002/humu.21206. PMC 3429857. PMID 20120036.
- ^ T">"NM_002454.2(MTRR):c.1361C>T (p.Ser454Leu) Simple - Variation Report - ClinVar - NCBI". Retrieved 2017-09-16.
- ^ A">"NM_002454.2(MTRR):c.1459G>A (p.Gly487Arg) AND Inborn genetic diseases - ClinVar - NCBI". Retrieved 2017-09-16.
- ^ T">"NM_002454.2(MTRR):c.1573C>T (p.Arg525Ter) AND not provided - ClinVar - NCBI". Retrieved 2017-09-16.
- ^ a b c d e f Zavadáková P, Fowler B, Suormala T, Novotna Z, Mueller P, Hennermann JB, Zeman J, Vilaseca MA, Vilarinho L, Gutsche S, Wilichowski E, Horneff G, Kozich V (2005). "cblE type of homocystinuria due to methionine synthase reductase deficiency: functional correction by minigene expression". Human Mutation. 25 (3): 239–47. doi:10.1002/humu.20131. PMID 15714522. S2CID 17183484.
- ^ A">"NM_002454.2(MTRR):c.1911G>A (p.Ala637=) Simple - Variation Report - ClinVar - NCBI". Retrieved 2017-09-16.
- ^ a b Wang P, Li S, Wang M, He J, Xi S (2017). "Association of MTRR A66G polymorphism with cancer susceptibility: Evidence from 85 studies". Journal of Cancer. 8 (2): 266–277. doi:10.7150/jca.17379. PMC 5327376. PMID 28243331.
- ^ a b c d Shi Q, Zhang Z, Li G, Pillow PC, Hernandez LM, Spitz MR, Wei Q (August 2005). "Polymorphisms of methionine synthase and methionine synthase reductase and risk of lung cancer: a case-control analysis". Pharmacogenetics and Genomics. 15 (8): 547–55. doi:10.1097/01.fpc.0000170916.96650.70. PMID 16006998. S2CID 25879819.
- ^ Zhi X, Yang B, Fan S, Li Y, He M, Wang D, Wang Y, Wei J, Zheng Q, Sun G (December 2016). "Additive Interaction of MTHFR C677T and MTRR A66G Polymorphisms with Being Overweight/Obesity on the Risk of Type 2 Diabetes". International Journal of Environmental Research and Public Health. 13 (12): 1243. doi:10.3390/ijerph13121243. PMC 5201384. PMID 27983710.
- ^ Matsuo K, Hamajima N, Hirai T, Kato T, Inoue M, Takezaki T, Tajima K (2002). "Methionine Synthase Reductase Gene A66G Polymorphism is Associated with Risk of Colorectal Cancer". Asian Pacific Journal of Cancer Prevention. 3 (4): 353–359. PMID 12716294.
- ^ Sharp L, Little J (March 2004). "Polymorphisms in genes involved in folate metabolism and colorectal neoplasia: a HuGE review". American Journal of Epidemiology. 159 (5): 423–43. doi:10.1093/aje/kwh066. PMID 14977639.
- ^ Wettergren Y, Odin E, Carlsson G, Gustavsson B (2010). "MTHFR, MTR, and MTRR polymorphisms in relation to p16INK4A hypermethylation in mucosa of patients with colorectal cancer". Molecular Medicine. 16 (9–10): 425–32. doi:10.2119/molmed.2009.00156. PMC 2935958. PMID 20549016.
- ^ Le Marchand L, Donlon T, Hankin JH, Kolonel LN, Wilkens LR, Seifried A (2002). "B-vitamin intake, metabolic genes, and colorectal cancer risk (United States)". Cancer Causes & Control. 13 (3): 239–48. doi:10.1023/A:1015057614870. PMID 12020105. S2CID 6326507.
- ^ Gemmati D, Ongaro A, Scapoli GL, Della Porta M, Tognazzo S, Serino ML, Di Bona E, Rodeghiero F, Gilli G, Reverberi R, Caruso A, Pasello M, Pellati A, De Mattei M (May 2004). "Common gene polymorphisms in the metabolic folate and methylation pathway and the risk of acute lymphoblastic leukemia and non-Hodgkin's lymphoma in adults". Cancer Epidemiology, Biomarkers & Prevention. 13 (5): 787–94. PMID 15159311.
- ^ Lin J, Spitz MR, Wang Y, Schabath MB, Gorlov IP, Hernandez LM, Pillow PC, Grossman HB, Wu X (September 2004). "Polymorphisms of folate metabolic genes and susceptibility to bladder cancer: a case-control study". Carcinogenesis. 25 (9): 1639–47. doi:10.1093/carcin/bgh175. PMID 15117811.
- ^ Skibola CF, Forrest MS, Coppedé F, Agana L, Hubbard A, Smith MT, Bracci PM, Holly EA (October 2004). "Polymorphisms and haplotypes in folate-metabolizing genes and risk of non-Hodgkin lymphoma". Blood. 104 (7): 2155–62. doi:10.1182/blood-2004-02-0557. PMID 15198953.
- ^ Stolzenberg-Solomon RZ, Qiao YL, Abnet CC, Ratnasinghe DL, Dawsey SM, Dong ZW, Taylor PR, Mark SD (November 2003). "Esophageal and gastric cardia cancer risk and folate- and vitamin B(12)-related polymorphisms in Linxian, China". Cancer Epidemiology, Biomarkers & Prevention. 12 (11 Pt 1): 1222–6. PMID 14652285.
- ^ a b c Watkins D, Rosenblatt DS (June 1988). "Genetic heterogeneity among patients with methylcobalamin deficiency. Definition of two complementation groups, cblE and cblG". The Journal of Clinical Investigation. 81 (6): 1690–4. doi:10.1172/JCI113507. PMC 442612. PMID 3384945.
- ^ a b c d e f g h i Zavadakova P, Fowler B, Zeman J, Suormala T, Pristoupilová K, Kozich V, Zavad'áková P (October 2002). "CblE type of homocystinuria due to methionine synthase reductase deficiency: clinical and molecular studies and prenatal diagnosis in two families". Journal of Inherited Metabolic Disease. 25 (6): 461–76. doi:10.1023/A:1021299117308. PMID 12555939. S2CID 9114486.
- ^ a b c d e f g Botto N, Andreassi MG, Manfredi S, Masetti S, Cocci F, Colombo MG, Storti S, Rizza A, Biagini A (September 2003). "Genetic polymorphisms in folate and homocysteine metabolism as risk factors for DNA damage". European Journal of Human Genetics. 11 (9): 671–8. doi:10.1038/sj.ejhg.5201024. PMID 12939653.
- ^ a b Brown CA, McKinney KQ, Kaufman JS, Gravel RA, Rozen R (June 2000). "A common polymorphism in methionine synthase reductase increases risk of premature coronary artery disease". Journal of Cardiovascular Risk. 7 (3): 197–200. doi:10.1177/204748730000700306. PMID 11006889. S2CID 32898984.
- ^ Shaw GM, Lu W, Zhu H, Yang W, Briggs FB, Carmichael SL, Barcellos LF, Lammer EJ, Finnell RH (June 2009). "118 SNPs of folate-related genes and risks of spina bifida and conotruncal heart defects". BMC Medical Genetics. 10: 49. doi:10.1186/1471-2350-10-49. PMC 2700092. PMID 19493349.
- ^ Balduino Victorino D, de Godoy MF, Goloni-Bertollo EM, Pavarino ÉC (2014). "Genetic polymorphisms involved in folate metabolism and maternal risk for down syndrome: a meta-analysis". Disease Markers. 2014: 1–12. doi:10.1155/2014/517504. PMC 4269293. PMID 25544792.
- ^ Muthuswamy S, Agarwal S (2016). "Do the MTHFR gene polymorphism and Down syndrome pregnancy association stands true? A case–control study of Indian population and meta-analysis". Egyptian Journal of Medical Human Genetics. 17 (1): 87–97. doi:10.1016/j.ejmhg.2015.08.003. ISSN 1110-8630.
- ^ a b c O'Leary VB, Parle-McDermott A, Molloy AM, Kirke PN, Johnson Z, Conley M, Scott JM, Mills JL (January 2002). "MTRR and MTHFR polymorphism: link to Down syndrome?". American Journal of Medical Genetics. 107 (2): 151–5. doi:10.1002/ajmg.10121. PMID 11807890.
- ^ a b Martínez-Frías ML, Pérez B, Desviat LR, Castro M, Leal F, Rodríguez L, Mansilla E, Martínez-Fernández ML, Bermejo E, Rodríguez-Pinilla E, Prieto D, Ugarte M (May 2006). "Maternal polymorphisms 677C-T and 1298A-C of MTHFR, and 66A-G MTRR genes: is there any relationship between polymorphisms of the folate pathway, maternal homocysteine levels, and the risk for having a child with Down syndrome?". American Journal of Medical Genetics. Part A. 140 (9): 987–97. doi:10.1002/ajmg.a.31203. PMID 16575899. S2CID 44819166.
- ^ Bosco P, Guéant-Rodriguez RM, Anello G, Barone C, Namour F, Caraci F, Romano A, Romano C, Guéant JL (September 2003). "Methionine synthase (MTR) 2756 (A --> G) polymorphism, double heterozygosity methionine synthase 2756 AG/methionine synthase reductase (MTRR) 66 AG, and elevated homocysteinemia are three risk factors for having a child with Down syndrome". American Journal of Medical Genetics. Part A. 121A (3): 219–24. doi:10.1002/ajmg.a.20234. PMID 12923861. S2CID 38425348.
- ^ Al-Gazali LI, Padmanabhan R, Melnyk S, Yi P, Pogribny IP, Pogribna M, Bakir M, Hamid ZA, Abdulrazzaq Y, Dawodu A, James SJ (October 2001). "Abnormal folate metabolism and genetic polymorphism of the folate pathway in a child with Down syndrome and neural tube defect". American Journal of Medical Genetics. 103 (2): 128–32. doi:10.1002/ajmg.1509. PMID 11568918.
추가 정보
- Wilson A, Platt R, Wu Q, Leclerc D, Christensen B, Yang H, Gravel RA, Rozen R (August 1999). "A common variant in methionine synthase reductase combined with low cobalamin (vitamin B12) increases risk for spina bifida". Molecular Genetics and Metabolism. 67 (4): 317–23. doi:10.1006/mgme.1999.2879. PMID 10444342.
- Wilson A, Leclerc D, Rosenblatt DS, Gravel RA (October 1999). "Molecular basis for methionine synthase reductase deficiency in patients belonging to the cblE complementation group of disorders in folate/cobalamin metabolism". Human Molecular Genetics. 8 (11): 2009–16. doi:10.1093/hmg/8.11.2009. PMID 10484769.
- James SJ, Pogribna M, Pogribny IP, Melnyk S, Hine RJ, Gibson JB, Yi P, Tafoya DL, Swenson DH, Wilson VL, Gaylor DW (October 1999). "Abnormal folate metabolism and mutation in the methylenetetrahydrofolate reductase gene may be maternal risk factors for Down syndrome". The American Journal of Clinical Nutrition. 70 (4): 495–501. doi:10.1093/ajcn/70.4.495. PMID 10500018.
- Leclerc D, Odièvre M, Wu Q, Wilson A, Huizenga JJ, Rozen R, Scherer SW, Gravel RA (November 1999). "Molecular cloning, expression and physical mapping of the human methionine synthase reductase gene". Gene. 240 (1): 75–88. doi:10.1016/S0378-1119(99)00431-X. PMID 10564814.
- Doolin MT, Barbaux S, McDonnell M, Hoess K, Whitehead AS, Mitchell LE (November 2002). "Maternal genetic effects, exerted by genes involved in homocysteine remethylation, influence the risk of spina bifida". American Journal of Human Genetics. 71 (5): 1222–6. doi:10.1086/344209. PMC 385102. PMID 12375236.
- Olteanu H, Munson T, Banerjee R (November 2002). "Differences in the efficiency of reductive activation of methionine synthase and exogenous electron acceptors between the common polymorphic variants of human methionine synthase reductase". Biochemistry. 41 (45): 13378–85. doi:10.1021/bi020536s. PMID 12416982.
- Zavadakova P, Fowler B, Zeman J, Suormala T, Pristoupilová K, Kozich V, Zavad'áková P (October 2002). "CblE type of homocystinuria due to methionine synthase reductase deficiency: clinical and molecular studies and prenatal diagnosis in two families". Journal of Inherited Metabolic Disease. 25 (6): 461–76. doi:10.1023/A:1021299117308. PMID 12555939. S2CID 9114486.
- Pietrzyk JJ, Bik-Multanowski M, Sanak M, Twardowska M (2003). "Polymorphisms of the 5,10-methylenetetrahydrofolate and the methionine synthase reductase genes as independent risk factors for spina bifida". Journal of Applied Genetics. 44 (1): 111–3. PMID 12590188.
- Zhu H, Wicker NJ, Shaw GM, Lammer EJ, Hendricks K, Suarez L, Canfield M, Finnell RH (March 2003). "Homocysteine remethylation enzyme polymorphisms and increased risks for neural tube defects". Molecular Genetics and Metabolism. 78 (3): 216–21. doi:10.1016/S1096-7192(03)00008-8. PMID 12649067.
- Brilakis ES, Berger PB, Ballman KV, Rozen R (June 2003). "Methylenetetrahydrofolate reductase (MTHFR) 677C>T and methionine synthase reductase (MTRR) 66A>G polymorphisms: association with serum homocysteine and angiographic coronary artery disease in the era of flour products fortified with folic acid". Atherosclerosis. 168 (2): 315–22. doi:10.1016/S0021-9150(03)00098-4. PMID 12801615.
- Sliwerska E, Szpecht-Potocka A (2003). "[Mutations of MTHFR, MTR, MTRR genes as high risk factors for neural tube defects]". Medycyna Wieku Rozwojowego. 6 (4): 371–82. PMID 12810988.
- Beyer K, Lao JI, Latorre P, Riutort N, Matute B, Fernández-Figueras MT, Mate JL, Ariza A (July 2003). "Methionine synthase polymorphism is a risk factor for Alzheimer disease". NeuroReport. 14 (10): 1391–4. doi:10.1097/01.wnr.0000073683.00308.0e. PMID 12876480. S2CID 33245738.
- Bosco P, Guéant-Rodriguez RM, Anello G, Barone C, Namour F, Caraci F, Romano A, Romano C, Guéant JL (September 2003). "Methionine synthase (MTR) 2756 (A --> G) polymorphism, double heterozygosity methionine synthase 2756 AG/methionine synthase reductase (MTRR) 66 AG, and elevated homocysteinemia are three risk factors for having a child with Down syndrome". American Journal of Medical Genetics. Part A. 121A (3): 219–24. doi:10.1002/ajmg.a.20234. PMID 12923861. S2CID 38425348.
- Olteanu H, Wolthers KR, Munro AW, Scrutton NS, Banerjee R (February 2004). "Kinetic and thermodynamic characterization of the common polymorphic variants of human methionine synthase reductase". Biochemistry. 43 (7): 1988–97. doi:10.1021/bi035910i. PMID 14967039.
- Gemmati D, Ongaro A, Scapoli GL, Della Porta M, Tognazzo S, Serino ML, Di Bona E, Rodeghiero F, Gilli G, Reverberi R, Caruso A, Pasello M, Pellati A, De Mattei M (May 2004). "Common gene polymorphisms in the metabolic folate and methylation pathway and the risk of acute lymphoblastic leukemia and non-Hodgkin's lymphoma in adults". Cancer Epidemiology, Biomarkers & Prevention. 13 (5): 787–94. PMID 15159311.
- Leal NA, Olteanu H, Banerjee R, Bobik TA (November 2004). "Human ATP:Cob(I)alamin adenosyltransferase and its interaction with methionine synthase reductase". The Journal of Biological Chemistry. 279 (46): 47536–42. doi:10.1074/jbc.M405449200. PMID 15347655.
- Vaughn JD, Bailey LB, Shelnutt KP, Dunwoody KM, Maneval DR, Davis SR, Quinlivan EP, Gregory JF, Theriaque DW, Kauwell GP (November 2004). "Methionine synthase reductase 66A->G polymorphism is associated with increased plasma homocysteine concentration when combined with the homozygous methylenetetrahydrofolate reductase 677C->T variant". The Journal of Nutrition. 134 (11): 2985–90. doi:10.1093/jn/134.11.2985. PMID 15514263.