등전점
Isoelectric point등전점(pI, pH(I), IEP)은 분자가 순수 전하를 전달하지 않거나 통계 평균에서 전기적으로 중립인 pH이다.등전점을 나타내는 표준 명명법은 pH(I)[1]입니다.단, pI도 사용됩니다.[2]간략하게 하기 위해 이 문서에서는 pI를 사용합니다.분자의 순전하는 주변 환경의 pH에 의해 영향을 받고 양성자(H)의+ 이득 또는 손실로 인해 더욱 양전하 또는 음전하가 될 수 있다.
표면은 자연적으로 이중층을 형성하기 위해 대전합니다.일반적으로 표면전하 결정 이온이+ H−/HO일 경우 고체가 잠긴 액체의 pH에 의해 순 표면 전하가 영향을 받는다.
pI 값은 주어진 pH에서 분자의 용해도에 영향을 미칠 수 있습니다.이러한 분자는 pH에서 pI에 해당하는 물이나 소금 용액에서 용해도가 최소이며 종종 용액 밖으로 침전된다.단백질과 같은 생물학적 양성 분자는 산성기와 염기성 기능기를 모두 포함한다.단백질을 구성하는 아미노산은 본질적으로 양, 음, 중성 또는 극성이며, 함께 단백질에 전체적인 전하를 줍니다.pH가 pI보다 낮으면 단백질은 순 양전하를 가지고 있고, pI보다 높으면 순 음전하를 가지고 있다.따라서 단백질을 분리하기 위해 일정한 pH를 사용하는 준비 겔 전기영동 또는 단백질을 분리하기 위해 pH 구배를 사용하는 등전초점 중 하나를 사용하여 폴리아크릴아미드 겔에서 순전하에 의해 단백질을 분리할 수 있다.또한 등전초점은 2-D 겔 폴리아크릴아미드 겔 전기영동의 첫 번째 단계입니다.
생체분자에서 단백질은 이온교환 크로마토그래피에 의해 분리될 수 있다.생물학적 단백질은 zwitterionic 아미노산 화합물로 구성되어 있다; 이러한 단백질의 순 전하는 환경의 pH에 따라 양전하 또는 음전하가 될 수 있다.표적 단백질의 특정 pI는 주변 과정을 모델링하는데 사용될 수 있으며, 그 후 혼합물의 나머지 부분으로부터 화합물을 정제할 수 있다.이 정화 프로세스에서는 다양한 pH 버퍼를 사용하여 환경의 pH를 변경할 수 있습니다.표적 단백질이 포함된 혼합물을 이온 교환기에 적재하면 고정 매트릭스는 양전하(이동 음이온용) 또는 음전하(이동 양이온용)될 수 있습니다.낮은 pH 값에서 혼합물에 포함된 대부분의 단백질의 순 전하가 양전하입니다. 양이온 교환기에서, 양전하 단백질은 음전하 매트릭스에 결합합니다.높은 pH 값에서 대부분의 단백질의 순 전하는 음이온 교환기에서 양으로 대전된 매트릭스에 결합합니다.환경이 단백질의 pI와 동일한 pH 값일 경우 순전하가 0이 되고 단백질이 교환기에 결합되지 않으므로 [3]용출될 수 있다.
pI 값 계산
1개의 아민과 1개의 카르복실기만을 가진 아미노산에 대해서는 이 [4]분자의 pKas 평균에서 pI를 계산할 수 있다.
전기영동겔의 pH는 해당 겔에 사용되는 완충제에 의해 결정됩니다.완충제의 pH가 실행 중인 단백질의 pI보다 높으면 단백질은 양극으로 이동한다(음전하는 양극으로 유인된다).완충제의 pH가 실행 중인 단백질의 pI보다 낮으면 단백질이 겔의 음극으로 이동한다(양전하가 음극으로 유인됨).만약 단백질이 pI와 동일한 완충 pH로 실행된다면, 그것은 전혀 이동하지 않습니다.이것은 개별 아미노산에도 해당된다.
예
 | 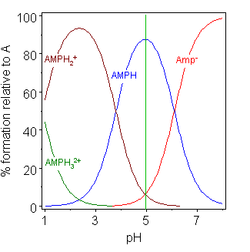 |
| 글리신 pK = 2.72, 9.60 | 아데노신 일인산 pK = 0.9, 3.8, 6.1 |
두 예(오른쪽)에서는 등전점이 녹색 수직선으로 표시됩니다.글리신에서 pK 값은 거의 7단위로 분리된다.따라서 기체상에서는 중성종인 글리신(GlyH)의 농도가 분석 글리신 [5]농도의 100%가 된다.글리신은 등전점에 zwitterion으로 존재할 수 있지만, 용액에서 이성화 반응을 위한 평형 상수
- HNCHCOH222 h3+22− HNCHCO
알 수 없습니다.
또 다른 예는 아데노신 일인산염이 원칙적으로 제3종이 관여할 수 있다는 사실을 보여주는 것이다.실제로 (AMP)H의32+ 농도는 이 경우 등전점에서는 무시할 수 있습니다.pI가 pH보다 크면 분자는 양전하를 갖는다.
펩타이드와 단백질의 등전점
펩타이드와 단백질의 등전점을 추정하기 위한 다수의 알고리즘이 개발되었다.대부분 pK 값이 다른 헨더슨-하셀발흐 방정식을 사용합니다.예를 들어, Bjellqvist와 동료가 제안한 모델 내에서 pK는 중복되는 pH [6]구배에서 동일한 표본을 집중함으로써 밀접하게 연관된 이모빌린 사이에서 결정되었다.방법론(특히 변형 아미노산에 대한 pK 값 결정)의 일부 개선도 제안되었다.[7][8]보다 진보된 방법은 하전된 아스파라긴산 또는 글루탐산으로부터 떨어진 인접 아미노산 ±3 잔류물의 영향, 유리 C 말단에 대한 영향 및 유전자 [9]알고리즘을 사용하여 해당 pK 값에 보정 용어를 적용한다.다른 최근의 접근법은 실험적으로 알려진 단백질/펩타이드 등전점에 [11]대한 지원 벡터 기계[10] 알고리즘과 pKa 최적화에 기초한다.
또한, 실험적으로 측정된 단백질의 등전점이 데이터베이스에 [12][13]통합되었다.최근, 이용 가능한 대부분의 방법을 사용하여 예측된 모든 단백질에 대한 등전점 데이터베이스도 개발되었다.[14]
실제로 염기성 아미노산(아르기닌, 리신 및/또는 히스티딘)을 초과한 단백질은 약 7(염기성)보다 큰 등전점을 갖는 반면 산성 아미노산(아스파르트산 및/또는 글루탐산)을 초과한 단백질은 종종 7(산)보다 낮은 등전점을 갖는다.폴리아크릴아미드겔(등전초집중이라고도 함)의 pH 구배를 따라 Ip에 의한 단백질의 전기영동(수평) 분리에 이어 두 번째 폴리아크릴아미드겔(SDS-PAGE)의 표준 분자량 선형(수직) 분리는 이른바 2차원 겔 전기영동 또는 2D를 구성한다.이 기술은 단백질을 뚜렷한 "스팟"으로 철저히 분리할 수 있도록 하며, 고분자량과 저Ip의 단백질은 2차원 겔의 왼쪽 상단으로 이동하며, 저분자량과 고Ip의 단백질은 동일한 겔의 오른쪽 하단으로 이동한다.
세라믹 재료
금속 산화물 세라믹의 등전점(IEP)은 재료 과학에서 다양한 수성 처리 단계(합성, 수정 등)에서 광범위하게 사용됩니다.수성 현탁액에 화학흡착 또는 물리흡착종의 입자 표면이 없는 경우 일반적으로 표면수산화기종인 M-OH(여기서 M은 Al, Si 등의 금속)로 덮여 있다고 가정한다.[15]IEP보다 높은 pH 값에서는 M-O가− 지배적인 반면, IEP보다 낮은 pH 값에서는 M-OH가2+ 우세하다.일반적인 세라믹의 대략적인 값은 [16][17]다음과 같습니다.
| 재료. | IEP |
|---|---|
| WO3[18] | 0.2-0.5 |
| Sb2O5[18] | 0.4~1.9 미만 |
| 음성25[18][19] | 1-2 (3) |
| γ-MnO2 | 1.5 |
| SiO2[18] | 1.7-3.5 |
| SiC[20] | 2-3.5 |
| Ta2O5[18] | 2.7-3.0 |
| TiO2[21] | 2.8-3.8 |
| §-FeO23[18] | 3.3-6.7 |
| SnO2[22] | 4-5.5 (7.3) |
| ZrO2[18] | 4-11 |
| ITO[23] | 6 |
| Cr2O3[18][19] | 6.2-8.1 (7) |
| Fe3O4[18] | 6.5-6.8 |
| CeO2[18] | 6.7-8.6 |
| Y2O3[18] | 7.15-8.95 |
| γ-Al2O3 | 7-8 |
| β-MnO2[19] | 7.3 |
| TLO2[24] | 8 |
| α-Al2O3 | 8-9 |
| α-Fe2O3[18] | 8.4-8.5 |
| ZnO[18] | 8.7-10.3 |
| Si3N4[22] | 9 |
| CuO[22] | 9.5 |
| 라오23 | 10 |
| NiO[22] | 10-11 |
| PBO[18] | 10.7-11.6 |
| MgO[18] | 12-13 (9.8-12.7) |
참고: 다음 목록은 물에 있는 선택된 재료의 25°C에서의 등전점을 나타냅니다.정확한 값은 온도와 같은 물리적 파라미터뿐만 아니라 순도 및 위상 등의 재료 요인에 따라 크게 달라질 수 있습니다.또한 등전점의 정확한 측정이 어려울 수 있으므로 많은 소스들이 종종 이러한 재료의 등전점에 대해 다른 값을 인용한다.
혼합 산화물은 해당 순수 산화물의 등전점 값과 중간 값을 나타낼 수 있습니다.예를 들어 합성된 비정질 알루미노실리케이트(AlO-SiO232)는 처음에 IEP가 4.5인 것으로 측정되었다(표면의 전기운동학적 거동은 표면 Si-OH종에 의해 지배되어 상대적으로 낮은 IEP [25]값을 설명한다).다른 사람들은232 3AlO-2SiO에 대해 상당히 높은 IEP 값(pH 6 ~8)을 보고했습니다.[22]마찬가지로 티탄산바륨 BaTiO의3 IEP도 5~6[22] 범위로 보고되었으며, 다른 바륨은 [26]3의 값을 얻었다. 티타니아(TiO2)와 지르코니아(ZrO2)의 혼합물을 연구하여 5.3~6.9 사이의 등전점을 가지며 %(ZrO2)[27]와 비선형적으로 변화하였다.혼합 산화물의 표면 하중은 산도와 상관관계가 있었다.티타니아 함량이 클수록 루이스 산도가 증가하였고, 지르코니아가 풍부한 산화물은 Br::온스테드 산도를 보였다.다양한 유형의 산성으로 인해 이온 흡착 속도와 용량에 차이가 생겼다.
등전점 대 무전점
Iso Electric Point(IEP; 등전점)와 Point of Zero Charge(PZC; 제로 전하점)라는 용어는 종종 서로 바꾸어 사용되지만, 특정 상황에서는 구별하는 것이 생산적일 수 있습니다.
H/OH가− 계면전위결정 이온인 시스템에서는+ pH로 0전하의 점을 부여한다.표면이 중성 순 전하를 나타내는 pH는 표면에서 전하가 0인 지점입니다.전기운동학적 현상은 일반적으로 제타 전위를 측정하며, 제타 전위는 전단면에서 순전하가 0인 점으로 해석됩니다.이를 [28]등전점이라고 합니다.따라서 등전점은 콜로이드 입자가 전기장에서 정지해 있는 pH 값이다.등전점은 입자 표면의 제로 전하 지점과는 다소 다를 것으로 예상되지만, 이러한 차이는 양전하 [15]또는 음전하가 특별히 흡착되지 않은 표면과 같은 소위 원시 표면에서는 종종 무시된다.이러한 맥락에서 특정 흡착은 Stern 층 또는 화학 흡착에서 발생하는 흡착으로 이해된다.따라서 표면에서 0 전하의 점은 해당 표면에 특정 흡착이 없는 경우 등전점과 동일한 것으로 간주됩니다.
Jolivett에 [19]따르면, 양전하 또는 음전하가 없는 경우, 표면은 0전하의 점으로 가장 잘 묘사된다.양전하와 음전하가 모두 같은 양이면 이것이 등전점입니다.따라서 PZC는 표면 전하의 부재를 나타내며 IEP는 중성 표면 전하의 상태를 나타냅니다.따라서 이 둘의 차이는 순 제로 충전 지점에서 충전된 사이트의 양입니다.졸리벳은 고유 표면 평형 상수인− pK와+ pK를 사용하여 하전 부위의 상대적 수 측면에서 두 조건을 정의한다.
큰 δpK(Jolivet에 따르면 4 이상)의 경우, 지배적인 종은 MOH인 반면 상대적으로 적은 수의 하전종이 존재하므로 PZC가 관련이 있다.δpK 값이 작을 경우, 대략 같은 수의 대전종이 다수 존재하기 때문에 IEP를 말한다.
「 」를 참조해 주세요.
레퍼런스
- ^ pH(I)에서 허용되는 변종에는I pHIEP, pH 등이 포함될 수 있다. 요점은 I의 '제곱'을 취할 수 없다는 것이다. 대신 지정된 조건에 따라 pH를 측정한다.
- ^ IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (2006–) "전기영동의 등전점" doi: 10.1351/goldbook.I03275
- ^ Dayton, W. R. (1983). "Protein Separation Techniques" (PDF). Reciprocal Meat Conference Proceedings. 36: 98–102.
- ^ 이 식의 도출에 대해서는 산 해리 상수를 참조한다.
- ^ Jensen, Jan H.; Gordon, Mark S. (August 1995). "On the Number of Water Molecules Necessary To Stabilize the Glycine Zwitterion". Journal of the American Chemical Society. 117 (31): 8159–8170. doi:10.1021/ja00136a013. ISSN 0002-7863.
- ^ Bjellqvist, B.; Hughes, G. J.; Pasquali, C.; Paquet, N.; Ravier, F.; Sanchez, J. C.; Frutiger, S.; Hochstrasser, D. (1993-10-01). "The focusing positions of polypeptides in immobilized pH gradients can be predicted from their amino acid sequences". Electrophoresis. 14 (10): 1023–1031. doi:10.1002/elps.11501401163. ISSN 0173-0835. PMID 8125050. S2CID 38041111.
- ^ Gauci, Sharon; van Breukelen, Bas; Lemeer, Simone M.; Krijgsveld, Jeroen; Heck, Albert J. R. (2008-12-01). "A versatile peptide pI calculator for phosphorylated and N-terminal acetylated peptides experimentally tested using peptide isoelectric focusing". Proteomics. 8 (23–24): 4898–4906. doi:10.1002/pmic.200800295. ISSN 1615-9861. PMID 19003858. S2CID 21527631.
- ^ Gasteiger, Elisabeth; Gattiker, Alexandre; Hoogland, Christine; Ivanyi, Ivan; Appel, Ron D.; Bairoch, Amos (2003-07-01). "ExPASy: the proteomics server for in-depth protein knowledge and analysis". Nucleic Acids Research. 31 (13): 3784–3788. doi:10.1093/nar/gkg563. ISSN 0305-1048. PMC 168970. PMID 12824418.
- ^ Cargile, Benjamin J.; Sevinsky, Joel R.; Essader, Amal S.; Eu, Jerry P.; Stephenson, James L. (2008-07-01). "Calculation of the isoelectric point of tryptic peptides in the pH 3.5-4.5 range based on adjacent amino acid effects". Electrophoresis. 29 (13): 2768–2778. doi:10.1002/elps.200700701. ISSN 0173-0835. PMID 18615785.
- ^ Perez-Riverol, Yasset; Audain, Enrique; Millan, Aleli; Ramos, Yassel; Sanchez, Aniel; Vizcaíno, Juan Antonio; Wang, Rui; Müller, Markus; Machado, Yoan J. (2012-04-03). "Isoelectric point optimization using peptide descriptors and support vector machines". Journal of Proteomics. 75 (7): 2269–2274. doi:10.1016/j.jprot.2012.01.029. ISSN 1876-7737. PMID 22326964.
- ^ Kozlowski, LP. (2016). "IPC - Isoelectric Point Calculator". Biol Direct. 11 (1): 55. doi:10.1186/s13062-016-0159-9. PMC 5075173. PMID 27769290.
- ^ Hoogland, C.; Mostaguir, K.; Sanchez, JC.; Hochstrasser, DF.; Appel, RD. (2004). "SWISS-2DPAGE, ten years later". Proteomics. 4 (8): 2352–6. doi:10.1002/pmic.200300830. PMID 15274128. S2CID 31933242.
- ^ Bunkute, E.; Cummins, C.; Crofts, FJ.; Bunce, G.; Nabney, IT.; Flower, DR. (2015). "PIP-DB: the Protein Isoelectric Point database". Bioinformatics. 31 (2): 295–6. doi:10.1093/bioinformatics/btu637. PMID 25252779.
- ^ Kozlowski, LP. (2016). "Proteome-pI: proteome isoelectric point database". Nucleic Acids Res. 45 (D1): D1112–D1116. doi:10.1093/nar/gkw978. PMC 5210655. PMID 27789699.
- ^ a b Hanaor, D.A.H.; Michelazzi, M.; Leonelli, C.; Sorrell, C.C. (2012). "The effects of carboxylic acids on the aqueous dispersion and electrophoretic deposition of ZrO2". Journal of the European Ceramic Society. 32 (1): 235–244. arXiv:1303.2754. doi:10.1016/j.jeurceramsoc.2011.08.015. S2CID 98812224.
- ^ Haruta, M (2004). "Nanoparticulate Gold Catalysts for Low-Temperature CO Oxidation". Journal of New Materials for Electrochemical Systems. 7: 163–172.
- ^ 브루넬 JP(1978년).'광물산화물 금속착체 흡착촉매 준비'순수 및 응용 화학 제50권, 페이지 1211-1229.
- ^ a b c d e f g h i j k l m n o Marrek Kosmulski, "Material Properties of Material Surfaces", Marcel Dekker, 2001.
- ^ a b c d Jolivett J.P., 금속 산화물 화학 및 합성. 솔루션에서 솔리드 스테이트로, John Wiley & Sons Ltd.2000, ISBN 0-471-97056-5(프랑스어 원문 번역본, De la Solution l l'Oxyde, InterEditions et CNRS Editions, Paris, 1994).
- ^ 미국 특허 5,165,996
- ^ 유럽도자기학회보 31(6), 1041-1047, 2011년 카르본산을 이용한 이산화티타늄 양극수 전기영동증착
- ^ a b c d e f Lewis, JA (2000). "Colloidal Processing of Ceramics". Journal of the American Ceramic Society. 83 (10): 2341–2359. CiteSeerX 10.1.1.514.1543. doi:10.1111/j.1151-2916.2000.tb01560.x.
- ^ Daido, T; Akaike, T (1993). "Electrochemistry of cytochrome c: influence of coulombic attraction with indium tin oxide electrode". Journal of Electroanalytical Chemistry. 344 (1–2): 91–106. doi:10.1016/0022-0728(93)80048-m.
- ^ Kosmulski, M; Saneluta, C (2004). "Point of zero charge/isoelectric point of exotic oxides: Tl2O3". Journal of Colloid and Interface Science. 280 (2): 544–545. Bibcode:2004JCIS..280..544K. doi:10.1016/j.jcis.2004.08.079. PMID 15533430.
- ^ Jara, A.A.; Goldberg, S.; Mora, M.L. (2005). "Studies of the surface charge of amorphous aluminosilicates using surface complexation models". Journal of Colloid and Interface Science. 292 (1): 160–170. Bibcode:2005JCIS..292..160J. doi:10.1016/j.jcis.2005.05.083. hdl:10533/176403. PMID 16051258.
- ^ Vamvakaki, Maria; Billingham, Norman C.; Armes, Steven P.; Watts, John F.; Greaves, Stephen J. (2001). "Controlled structure copolymers for the dispersion of high-performance ceramics in aqueous media". Journal of Materials Chemistry. 11 (10): 2437–2444. doi:10.1039/b101728o. ISSN 0959-9428.
- ^ Drisko, Glenna L; Luca, Vittorio; Sizgek, Erden; Scales, Nicolas F.; Caruso, Rachel A. (2009). "Template Synthesis and Adsorption Properties of Hierarchically Porous Zirconium Titanium Oxides". Langmuir. 25 (9): 5286–5293. doi:10.1021/la804030h. ISSN 0743-7463. PMID 19397363.
- ^ A.W. Adamson, A.P. Gast, "Physical Chemistry of Surfaces", John Wiley and Sons, 1997.
추가 정보
- Nelson DL, Cox MM(2004)레닝거 생화학 원리W. H. 프리먼; 제4판 (하드커버)ISBN 0-7167-4339-6
- 코스물스키 M. (2009년)표면 충전 및 제로 충전 지점.CRC 프레스, 초판(하드커버).ISBN 978-1-4200-5188-9
외부 링크
- IPC – Isolectric Point Calculator – 단백질 등전점 계산 방법 15가지 이상 사용
- prot pi - 단백질 등전점 - 단백질의 pI를 계산하기 위한 온라인 프로그램(복수의 서브유닛 및 번역 후 수정 포함)
- CurTiPot - 산염기 평형을 계산하기 위한 스프레드시트 세트(아미노산 등 양성 분자의 전하 대 pH 플롯)
- pICalculax - 화학적으로 수정된 펩타이드 및 단백질의 등전점(pI) 예측 변수
- SWISS-2DPAGE - 2차원 폴리아크릴아미드겔 전기영동(약 2,000단백질)에서 발생하는 등전점 데이터베이스
- PIP-DB - 단백질 등전점 데이터베이스(약 5,000단백질)
- 프로테옴-pI - 프로테옴 등전점 데이터베이스(모든 단백질에 대해 예측된 등전점)

![{\mathrm {p}}K^{-}-{\mathrm {p}}K^{+}=\Delta {\mathrm {p}}K=\log {{\frac {\left[{\mathrm {MOH}}\right]^{2}}{\left[{\mathrm {MOH}}{_{2}^{+}}\right]\left[{\mathrm {MO}}^{-}\right]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e3191d7ab56090ff3c419b53868c6c52134d80a)


