오쿠빈
Aucubin이 글은 대부분의 독자들이 이해하기에는 너무 기술적인 것일 수도 있다.할 수 하십시오.(2019년 3월)(이 및 학습 |
 | |
| 이름 | |
|---|---|
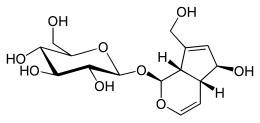
| IUPAC 이름 (1S,4aR,5S,7aS)-5--히드록시-7-(히드록시메틸)-1,4a,5,7a-테트라하이드로사이클로펜타[c]피란-1-yl β-D-글루코피라노사이드 | |
| 선호 IUPAC 이름 (2S,3R,4S,5S,6R)-2-{[(1S,4aR,5S,7aS)-5-Hydroxy-7-(hydroxymethyl)-1,4a,5,7a-tetrahydrocyclopenta[c]pyran-1-yl]oxy}-6-(hydroxymethyl)oxane-3,4,5-triol | |
| 기타 이름 오쿠빈 | |
| 식별자 | |
3D 모델(JSmol) | |
| 50340 | |
| 켐벨 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.006.856 |
| EC 번호 |
|
| 케그 | |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C15H22O9 | |
| 어금질량 | 346.332 g·190−1 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
오쿠빈은 이리도이드 글리코사이드 입니다.[1]이리도이드는 흔히 식물에서 발견되며 방어 화합물의 기능을 한다.[1]이리도이드는 많은 일반주의 초식동물의 성장률을 감소시킨다.[2]
자연발생
오쿠빈은 다른 이리도이드와 마찬가지로 아우쿠바 자포니카(가리아과), 에우코미아울무이드(에우코미아과), 플라타고 아시아티아카, 플라타고 전공, 플라타고 란솔라타(플랜타기나와), 갈륨아파린(루비아과) 등의 소행성에서 발견된다.이 식물들은 중국 전통 의학과 민속 의학에 사용된다.[3]
Agnuside는 aucubin과 p-hydroxybenzoic acid로 구성되어 있다.[4]
건강 효과
오쿠빈은 복강 내 80mg/kg 투여 당시 생쥐와 쥐에서 탄소 테트라클로로이드나 알파아마니틴에 의해 유발된 간 손상으로부터 보호하는 것으로 밝혀졌다.[5]
화학
Aucubin은 모노테르페노이드에 기반을 둔 화합물이다.[6]오쿠빈은 모든 이리도이드와 마찬가지로 사이클로펜탄[C]피란 뼈대를 가지고 있다.[6]이리도이드는 C11이 C10보다 더 자주 실종되는 10개, 9개 또는 드물게 8개의 탄소로 구성될 수 있다.[6]오쿠빈은 C11 탄소가 없어진 10개의 탄소를 가지고 있다.C5와 C9의 입체화학 구성은 시스 퓨전 링으로 연결되는데, 이는 재배열되지 않은 형태의 카보킬리클릭 또는 세코 스켈레톤을 포함하는 모든 이리도이드에 공통적이다.[6]C7-C8 본드의 산화분리는 세큐로이도이드를 제공한다.[7]이리도이드의 생합성의 마지막 단계는 대개 O-글리코실레이션과 O-알킬레이션으로 이루어진다.글리코사이드 이리도이드인 Aucubin은 O 연동 포도당 계수를 가지고 있다.
생합성
제라닐 피로인산염(GPP)은 이리도이드의 전구체다.[8]제라닐 인산염은 메발로네이트 경로나 메틸러리트리톨 인산염 경로를 통해 생성된다.[8]경로의 초기 단계에는 아세틸-CoA의 세 분자가 융합되어 C6 화합물 3-하이드록시-3-메틸글루타릴-CoA(HMG-CoA)가 생성된다.[8]HMG-CoA는 효소 HMG-CoA 환원효소에 의해 두 단계로 감소한다.[8]그 결과 메발론산염은 메발론산염 키나아제와 인산발론산염 키나아제라는 두 개의 분리된 키나제에 의해 순차적으로 인산염화되어 5-피로인산염발론산을 형성한다.[8]결합 데카복시화 반응을 통한 인산염발론산 데카복실화효소는 이소펜테닐 피이로인산염(IPP)을 제공한다.[8]IPP는 인산염 전 코서브스트레이트에 더 긴 체인을 형성하기 위해 첨가되는 기본적인 C5 빌딩 블록이다.[8]IPP는 IPP 이소머라아제에 의해 아군성 에스테르 디메틸알 파이로인산염(DMAPP)으로 이소머화된다.[8]탈인산화DMAPP를 포함한 다단계 과정을 통해 IPP와 DMAPP가 결합되어 C10 화합물 제라닐 피로인산염(GPP)을 형성한다.[8]제라닐 피로인산염은 테르페노이드 합성의 주요 분기점이다.[8]
Current[언제?]생합성 연구는 10-hydroxygerinol8-epi-iriotrial에서 가장 그럴듯한 합성 순서는 다음:범용 플랫폼의 dephosphorylation, 그러면 10-hydroxygeraniol을 만들기 위해 hydroxylat 되어는geranyl 양이온으로 이어진다;10-hydroxylgeraniol 10-hydroxynerol에;10-hydroxynerol에 NAD을 사용하여 산화된다 isomerized 것을 추천한다.한 트라이 m알데히드; 마침내 시험알데히드는 8-epi-iridotrial을 생산하기 위해 두 배의 Michael을 겪는다.[9] 8-Epi-iridotrial은 또 다른 지점 중간 지점이다.[6]
이리도이드 피란 링을 형성하기 위한 사이클리자톤 반응은 다음 두 가지 경로 중 하나에서 발생할 수 있다.
- 1번 경로 – C1에 대한 수이드라이드 핵소필 공격이 C3에 1-O-카르보닐 원자를 공격하여 락톤 링을 생성한다.
- 경로 2 – 탄소 4로부터의 양성자 상실로 인해 이중 결합 C3-C4가 형성되며, 결과적으로 3-O- 카르보닐 원자가 C1에 부착된다.[6]
중수소 추적 연구에 기초하여, 사이클링된 락톤 중간에서 나오는 오부신을 위한 생합성 경로는 유기체마다 다르다.[6]Gardenia jasminoides에서, 사이클링된 락톤 중간은 글리코실화하여 보쉬날로사이드(boschanaloside)를 형성하고, 보쉬날로사이드(boschanaloside)는 게니포시드로 산화되어 바티시오사이드(geniposid acid)를 형성하고, 바티시오사이드(buvin)를 수산화한다.[6]Scrophularia umbrosa biosynthetic pathway는 Gardenia jasminoides와는 다르다.In Scrophularia umbrosa, the lactone intermediate is glycosylated and oxidized at the C11 carbonyl to form 8-epi-dexoy-loganic acid, which is then converted to deoxygeniposidic acid; deoxygeniposidic acid is hydroxylated at C10 to geniposidic acid; decarboxylation and hydroxylation of C6 leads to aubucin.[10]
참조
- ^ a b Nieminen M; Suomi J; Van Nouhuys S (2003). "Effect of iridoid glycoside content on oviposition host plant choice and parasitim in a specialist herbivore". J. Chem. Ecol. 29 (4): 823–843. doi:10.1023/A:1022923514534. PMID 12775146. S2CID 16553547.
- ^ Puttick G, Bowers M (1998). "Effect of qualitative and quantitative variation in allelochemicals on a generalist insect: Iridoid glycosides and southern armyworm". J. Chem. Ecol. 14 (1): 335–351. doi:10.1007/BF01022550. PMID 24277013. S2CID 28710791.
- ^ Suh N, Shim C, Lee M, Kim S, Chung I (1991). "Pharmacokinetic Study of an Iridoid Glucoside: Aucubin". Pharmaceutical Research. 8 (8): 1059–1063. doi:10.1023/A:1015821527621. PMID 1924160. S2CID 24135356.
- ^ Eva Hoberg; Beat Meier & Otto Sticher (September–October 2000). "An analytical high performance liquid chromatographic method for the determination of agnuside and p-hydroxybenzoic acid contents in Agni-casti fructose". Phytochemical Analysis. 11 (5): 327–329. doi:10.1002/1099-1565(200009/10)11:5<327::AID-PCA523>3.0.CO;2-0.
- ^ Yang K, Kwon S, Choe H, Yun H, Chang I (1983). "Protective effect of Aucuba japonica against carbontetrackmkxmms damage in rat". Drug Chem. Toxicol. 6 (5): 429–441. doi:10.3109/01480548309014165. PMID 6628265.
- ^ a b c d e f g h Sampio-Santos M, Kaplan M (2001). "Biosynthesis Significance of iridoids in chemosystematics". J. Braz. Chem. Soc. 12 (2): 144–153. doi:10.1590/S0103-50532001000200004.
- ^ El-Naggar L, Beal J (1980). "Iridoids: a review". J. Nat. Prod. 43 (6): 649–707. doi:10.1021/np50012a001. PMID 20707392.
- ^ a b c d e f g h i j McGarbey, D; Croteau R (1995). "Terpenoid Metabolism". The Plant Cell. 7 (3): 1015–26. doi:10.1105/tpc.7.7.1015. PMC 160903. PMID 7640522.
- ^ Nangia A, Prasuna G, Rao P (1997). "Synthesis of cyclopenta[c]pyran skeleton of iridoid lactones". Tetrahedron. 53 (43): 14507–14545. doi:10.1016/S0040-4020(97)00748-5.
- ^ Damtoft S, Jensen S, Jessen C, Knudsen T (1993). "Late stages in the biosynthesis of aucubin in Scrophularia". Phytochemistry. 35 (5): 1089–1093. doi:10.1016/0031-9422(93)85028-P.


