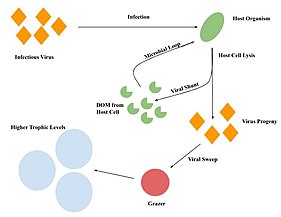
비리보레
Virivore비리보어는 독을 뜻하는[citation needed] 라틴어 vorare에서 유래한 영어 접두사 viro-의미 virus에서 유래했으며, vorare라는 라틴어 vorare에서 유래한 접미사 -vore로,[1] 따라서 비리보어는 바이러스를 소비하는 유기체입니다.비리보리는 유기체, 주로 이질적인 원생동물,[2][3][4][5][6][7] 그리고 일부 메타조아인들이[8][9] 바이러스를 섭취하는 잘 설명된 과정입니다.
바이러스는 미생물을 용해시키고 영양분을 방출할 수 있기 때문에 해양 환경에서 최고의 포식자로 간주됩니다.바이러스는 또한 미생물 영양 관계의 구조와 탄소 [10][11]흐름의 조절에 중요한 역할을 합니다.
디스커버리

첫 번째로 설명된 바이로보어는 작은 [2]해양 편모충으로 바이러스 입자를 섭취하고 소화하는 것으로 나타났습니다.그 후, 많은 연구들이 직접적이고 간접적으로 [3][4][5][6][7][8][9]비리온의 소비를 증명했습니다.2022년에 DeLong 등은 이틀 동안 섬모충인 Halteria와 Paramecium이 클로로바이러스 플라그 형성 단위를 최대 2배까지 줄였으며, 이는 영양소가 바이러스에서 [7]소비자에게 전달된다는 생각을 뒷받침합니다.

게다가, 할테리아 인구는 클로로바이러스를 유일한 영양 공급원으로 하여 증가했고, 클로로바이러스가 [7]없는 경우에는 최소한으로 증가했습니다.그러나 파라메슘 개체군은 대조군과 비교하여 클로로바이러스를 먹였을 때 성장에 차이가 없었습니다.파라메슘의 개체군 크기는 콜로바이러스만 있는 상태에서 일정하게 유지되었기 때문에, 이것은 파라메슘이 개체군 크기를 유지할 수 있지만 클로로바이러스를 유일한 탄소 공급원으로 사용하여 증가하지 않는다는 것을 나타냅니다.이러한 데이터는 일부 방목자가 바이러스에서 자랄 수 있다는 것을 보여주었지만, 모든 방목자에게 적용되는 것은 아닙니다.할테리아는 하루에 10,000에서 1,000,000개의 바이러스를 섭취한 것으로 추정되었습니다.할테리아나 파라메시움과 같은 작은 원생동물들은 동물성 플랑크톤에 의해 섭취되는데, 이는 수생 먹이 그물을 통해 바이러스에서 유래된 에너지와 물질의 이동을 나타냅니다.이것은 바이러스 분로가 풀과 미생물의 상호작용을 차단함으로써 먹이 그물 위로 에너지의 이동을 제한한다는 생각과 모순됩니다.전달되는 에너지와 물질의 양은 비리온의 크기와 영양 성분에 따라 달라질 수 있습니다.
생물 지구 화학적 영향
바이러스는 세계 [12][13][14]바다에서 가장 풍부한 생물체입니다.분석 바이러스의 수명 주기는 용해된 유기물과 입자 유기물, 즉 바이러스 [12][13]션트의 순환을 위한 세계 바다 내의 중요한 과정입니다.바이러스 입자 자체는 또한 용해된 유기물 풀 내의 질소와 인이 풍부한 입자의 많은 부분을 차지하는데, 이는 그것들이 지질, 아미노산, 핵산, 그리고 숙주 [12][13]세포로부터 통합된 탄소로 구성되어 있기 때문입니다.바이러스를 섭취하면 풀을 뜯는 식단을 보완할 수 있고 미생물이 [14]감염되지 않은 것으로 간주됩니다.
바이러스에 대한 일반적인 방목은 해양 환경 전반에 걸쳐 널리 퍼져 있으며,[12] 방목률은 하루에 90.3mL에-1-1 이릅니다.박테리아와 바이러스가 모두 존재할 때,[2] 바이러스는 박테리아와 비슷한 속도로 섭취될 수 있습니다.
Oikopleura dioica와 Equid alpha herpes virus 1 (EhV)을 모델로 사용하여,[12] 과학자들은 바이러스로부터 영양적 이득을 추정했습니다.
작은 방목장에서 바이러스는 잠재적으로 숙주의 [12]영양에 더 큰 영향을 미칠 수 있다고 제안되었습니다.예를 들어, 나노 편모충류의 추정 기여도는 탄소 9%, 질소 14%,[12] 인 28%입니다.
작은 박테리아가 크기와 탄소 함량 때문에 풀을 뜯는 사람들에게 이상적인 음식 공급원인 반면, 바이러스는 작고 운동성이 없으며 풀을 뜯는 사람들에게 매우 풍부하여 대체 영양학적 [14]선택이 될 수 있습니다.일반 방목자들은 박테리아로부터 얻은 것과 같은 양의 탄소를 바이러스로부터 얻기 위해서는 1000배의 바이러스를 [14]소비해야 합니다.이것은 바이러스를 방목자들에게 이상적인 탄소 공급원으로 만들지 않습니다.하지만, 바이러스를 소비하는 데에는 성장 외에도 다른 이점들이 있습니다.연구들은 소화된 바이러스 입자들이 풀을 뜯는 사람이 그들 자신의 폴리펩타이드 [14]합성 동안 사용할 수 있는 아미노산을 방출을 보여줍니다.
바이러스 소탕.
방목자, 박테리아, 바이러스 사이의 영양적 상호작용은 영양소와 유기물 순환을 [14]조절하는 데 중요합니다.바이러스 소탕은 풀을 뜯는 사람들이 바이러스 [12]입자를 섭취함으로써 탄소를 다시 전통적인 먹이 그물로 순환시키는 메커니즘입니다.숙주 세포의 감염은 바이러스 자손의 방출로 이어지고, 그 후 풀을 뜯는 [12]사람들에 의해 소비됩니다.풀벌레는 더 높은 영양 유기체에 의해 소비되고, 따라서 바이러스로부터 탄소를 다시 고전적인 먹이 그물로 그리고 더 높은 영양 [12]수준으로 순환시킵니다.
바이러스 소탕은 바이러스 [12]입자의 크기와 풍부함과 같은 많은 요인에 의해 영향을 받을 수 있습니다.바이러스의 크기는 바이러스 [13]입자의 원소 함량에 영향을 미칠 것입니다.예를 들어, 캡시드가 더 큰 바이러스는 더 많은 탄소를 기여하고, 게놈이 더 큰 바이러스는 증가된 [13]핵산의 결과로 더 많은 질소와 인을 기여합니다.또한 바이러스에 감염된 박테리아를 먹이로 하는 방목자를 고려할 [14]경우 바이러스 소탕의 영향이 더 클 수 있습니다.전반적으로, 박테리아와 바이러스를 소비함으로써, 방목자들은 [14]탄소를 순환시키는 데 중요한 역할을 합니다.
바이러스 방목
바이러스의 소비는 주로 유기체의 먹이 행동에 기초합니다.
필터 공급
필터 공급은 서스펜션 [15]공급의 일종입니다.필터 피더는 보통 섬모, 털, 점액 또는 다른 [15]구조물에서 하나의 음식 입자를 능동적으로 포착합니다.연구원들은 바이러스의 풍부함의 변화를 관찰하기 위해 Salpingeoca를 모델 필터 공급자로 사용했습니다.살핑거카는 그들이 [14]기질에 부착하는 것을 돕기 위해 로리카를 생산합니다.그들은 또한 작은 가짜 동물이 먹이 [14]입자를 집어삼키는 곳으로 작은 입자를 운반하는 물의 흐름을 만들기 위해 편모를 하나 가지고 있습니다.바이러스가 Salpingeoca와 함께 배양되었을 때, 90일 동안 바이러스 함량이 꾸준히 감소하여 필터 먹이가 [14]바이러스를 먹이로 하는 효과적인 메커니즘임을 보여주었습니다.
퇴적물 입자에 대한 방목
방목자들은 이동하면서 [15]음식을 모으고 섭취하기 위해 표면 위로 이동합니다.연구원들은 바이러스의 [14]풍부함의 변화를 관찰하기 위해 Thaumatomonas coloniensis를 모델 방목자로 사용했습니다.T. coloniensis는 [14]기질을 따라 미끄러지면서 기질과 관련된 입자를 집어삼키는 데 사용되는 필로포디아를 생성합니다.90일 동안, T. coloniensis와 함께 배양했을 때 바이러스의 풍부함은 꾸준히 감소했고, 방목이 [14]바이러스를 먹이로 하는 효과적인 메커니즘이라는 것을 보여주었습니다.
랩토리아식
랩토리아 먹이는 유기체가 [14]먹이를 찾는 능동적인 먹이 공급의 한 형태입니다.연구원들은 고니오모나스 트라우카타를 랩탑 [14]먹이의 모델로 사용했습니다.G. truncata는 두 개의 편모가 있는 크립토마돈으로, 먹이를 찾아 기질 가까이로 헤엄치는 데 사용되며, 먹이를 섭취하는 [14]데 도움이 되는 액포를 가지고 있습니다.G. truncata가 있는 경우, 바이러스 [14]함량은 90일 동안 현저하게 감소하지 않았습니다.하지만, 이것은 바이러스 입자가 흡수된 후 다시 [14]환경으로 방출될 가능성을 배제하지 않습니다.이 데이터는 랩터 먹이를 주는 것이 바이러스 방목의 방법이 아닐 수도 있지만, 바이러스 전염 측면에서 다른 생태학적 의미를 가질 수도 있다는 것을 보여줍니다.
선택적 방목
바이러스를 방목하는 것은 바이러스마다 다르기 때문에 선택적으로 먹이를 줍니다.편모충류는 다양한 크기의 많은 바이러스를 섭취할 수 있으며, 가장 작은 바이러스는 섭취율이 [2]가장 낮습니다.해양 바이러스 사이에는 크기, 모양, 형태 및 선택에 영향을 미칠 수 있는 표면 전하를 포함하여 매우 다양하며 따라서 섭취 속도가 다릅니다.[2]또한, 동일한 편모충에 의한 다른 바이러스의 소화율은 가변적이었습니다.이것은 바이러스를 [2]풀링할 때 선택을 의미합니다.예를 들어, 프로토타입을 13가지 종류의 [16]바이러스와 함께 배양했을 때 테트라히메나 피리포르미스에 의한 바이러스 제거에서 상당한 차이가 관찰되었습니다.또한 프로토스트를 [16]여러 바이러스와 동시에 배양할 때 특정 바이러스의 제거율이 유지되었습니다.T. 피리포미는 바이러스를 음식으로 식별할 수 있었는데, 이는 특정 바이러스의 이동과 소비를 다른 것들보다 더 많이 유도하여 일부 원생 동물들이 선택적인 [16]방목을 할 수 있다는 생각을 뒷받침합니다.
바이러스 감염이 방목에 미치는 영향
바이러스는 감염 동안 숙주 세포의 방목에 영향을 미치는 능력을 가지고 있으며, 바이러스 감염이 선택적 [17][18]방목에서 역할을 한다는 것을 보여줍니다.
요각류는 1차 생산과 2차 생산을 더 높은 영양 [17]수준과 연결하기 때문에 해양 먹이 그물의 핵심 연결고리입니다.식물성 플랑크톤 Emiliania huxleyi가 Cocclithovirus EhV-86에 감염되었을 때, Calanoid copepod Acartia tonsa에 의한 감염된 세포의 섭취는 감염되지 않은 세포에 비해 현저하게 감소하여 감염된 [17]세포에 대한 선택적 방목을 나타냈습니다.이러한 결과는 바이러스 감염이 방목을 줄이고, 탄소를 바이러스 션트-미생물 루프 내에 유지하고, 탄소가 더 높은 영양 [17]수준으로 이동하는 것을 억제함으로써 잠재적으로 먹이 그물 효율성을 감소시킬 수 있음을 시사합니다.이것은 탄소를 더 높은 영양 수준으로 순환시키기 위한 바이러스 소탕의 중요성을 강조합니다.
반대로, 옥시리스 마리나는 바이러스에 감염된 에밀리아니아 [18]헉슬리를 방목하는 것을 선호했습니다.감염되지 않은 세포보다 감염된 세포를 선호하는 것은 숙주 [18]세포의 생리적 변화나 크기의 변화 때문인 것으로 보입니다.O. 마리나는 더 큰 세포에서 풀을 뜯는 것을 선호하는데, 왜냐하면 그것들은 소비하는 [18]데 같은 양의 에너지를 필요로 하는 작은 세포에 비해 잠재적으로 더 큰 영양가를 얻을 수 있기 때문입니다.감염된 E. huxleyi는 감염되지 않은 것에 비해 세포 크기가 증가하여 O. [18]marina의 이상적인 먹이가 됩니다.감염된 E. huxleyi는 또한 감염 [18]중에 생리적 변화의 결과로서 그들의 입맛에 맞는 것으로 선택될 수 있습니다.예를 들어, 감염된 세포는 감염되지 않은 세포에 비해 핵산 함량이 높아 방목자의 [18]영양적 이득을 향상시킬 수 있습니다.또한, O. marina의 방목 활동은 잠재적으로 독성이 있는 화합물 [18]아크릴레이트를 덜 생산하기 때문에 DMSP lyase(디메틸설포니오프로피오네이트 분해효소) 활성이 낮은 먹이와 관련이 있습니다.바이러스에 감염된 E. huxleyi는 DMS 분해 효소 활성 수준이 감소하여 유해 화합물에 [18]대한 노출을 줄임으로써 O. marina에 매력을 느끼게 합니다.마지막으로, 감염 중에 디메틸 황화물과 과산화수소의 방출과 같은 화학적 신호는 그레이디언트를 생성하여 O. 마리나가 감염된 E. 헉슬리를 [18]더 쉽게 찾을 수 있게 합니다.감염된 세포를 우선적으로 방목하면 탄소를 미립자 [18]형태로 격리하여 더 높은 영양 수준으로 사용할 수 있습니다.
전반적으로 바이러스 입자와 바이러스에 감염된 세포를 방목하는 것은 선택적 방목의 대상입니다.
생태학적 의의
연구들은 바이러스가 풀을 뜯는 [14][19]사람들에 의해 섭취되고 소화되거나, 섭취되고 환경으로 다시 방출될 수 있다는 것을 보여주었습니다.풀을 뜯는 사람들이 잠재적으로 섭취 후 바이러스를 환경으로 다시 방출할 수 있다는 관찰은 상당한 생태학적 [19]영향을 미칠 수 있습니다.
변속기 모드
바이러스의 섭취와 방출은 해양 [19]환경에서 바이러스의 전염과 확산을 중재할 수 있습니다.Frada 등은 모델 전달 벡터로 요각류를 사용하고, 모델 바이러스로 EhV를 사용하여 해양 [19]환경에서 바이러스 분산의 잠재적 메커니즘을 확인했습니다.
EhV 입자는 개별 비리온 입자로 또는 숙주 세포 감염(이 경우 감염된 Emiliania huxleyi)[19]을 통해 요각류에 의해 소비될 수 있습니다.감염된 E. 헉슬리가 요각류와 함께 배양되었을 때 요각류에 의해 생성된 분변 펠릿은 펠릿 [19]당 평균 4500 EhV를 포함했습니다.펠릿을 포함한 이 비리온은 E. huxleyi의 신선한 배양과 함께 배양되었고 숙주 세포의 빠른 바이러스 매개 용해가 [19]관찰되었습니다.EhV 입자 단독으로 요각류와 공동 배양했을 때, 즉 E. Huxleyi가 없을 때, 수집된 대변 입자는 비리온 [19]입자를 포함하지 않았습니다.하지만, 그들이 EhV와 EhV의 숙주 범위 밖에 있는 규조류인 Thalassiosira Weissflogii를 먹였을 때,[19] 수집된 대변 펠릿은 펠릿당 200 EhV를 포함했습니다.이 알갱이들은 신선한 E. huxleyi 배양균과 함께 배양되었을 때 매우 전염성이 강했고 [19]배양균을 완전히 죽였습니다.유일한 EhV 배양에서 생성된 분변 펠릿에 비리온 입자가 없다는 것은 방목자들이 바이러스에 대한 선택적 방목을 보인다는 생각을 뒷받침합니다.EhV는 숙주 세포 감염을 통해 그리고 이상적인 음식 [19]공급원이 있을 때 여전히 요각류에 의해 흡수될 수 있습니다.바이러스의 풍부함은 박테리아의 풍부함을 따르기 때문에,[20] 바이러스가 방목자들의 유일한 영양 공급원이 될 수 있는 해양 환경은 없을 것 같습니다.
이 실험의 결과는 생태학적으로 상당한 영향을 미칩니다.요각류는 물기둥 위와 아래로 이동할 수 있고, 먹이를 주는 [19][21]지역 사이의 짧은 거리를 이동할 수 있습니다.특히, 요각류와 EhV의 경우, 요각류의 이동은 바이러스를 E. Huxleyi의 새롭고 감염되지 않은 개체군으로 이동시켜 꽃의 [19]소멸을 촉진할 수 있습니다.게다가, 대변 알갱이들은 여러 번 [21]동화될 수 있는 혼합된 층에서 바다의 더 깊은 부분으로 가라앉을 수 있습니다.이 두 시나리오는 바이러스가 새로운 해양 환경에 도입될 수 있는 잠재적인 메커니즘을 나타냅니다.
비숙주 생물
물기둥에서 바이러스를 제거할 수 있는 유기체는 방목자만이 아닙니다.아네모네, 폴리카에타 유충, 멍게, 게, 꼬막, 굴, 해면동물과 같은 숙주가 아닌 유기체는 모두 바이러스의 [22]풍부함을 현저하게 감소시킬 수 있습니다.해면은 [22]바이러스를 제거할 수 있는 가장 큰 잠재력을 가지고 있는 것으로 밝혀졌습니다.
비숙주 유기체가 바이러스-숙주 접촉을 방해하는 방법은 전달 [22]간섭으로 알려져 있습니다.비숙주 생물은 숙주 생물을 제거함으로써 직접적인 영향을 미치거나 [22]바이러스를 제거함으로써 간접적인 영향을 미칠 수 있습니다.이러한 메커니즘은 바이러스-호스트 접촉률의 감소를 유발하여 지역 미생물 집단 [22]역학에 상당한 영향을 미칠 수 있습니다.
숙주가 아닌 유기체는 천연 음식 입자, 박테리아 세포, 조류 세포와 비슷한 속도로 바이러스를 제거할 수 있는데, 이는 바이러스 제거율이 약 4%[2][22]인 방목자와 비교했을 때 더 높습니다.해안 및 열대 지역과 같이 스펀지 밀도가 높은 지역에서는 바이러스 제거율이 [22]과소평가되었을 가능성이 높습니다.바이러스의 효과적인 제거는 [22]인식되지 않은 세계적인 생태학적 영향을 미칠 가능성이 높습니다.
레퍼런스
- ^ Government of Canada, Public Services and Procurement Canada (2019-12-06). "-vore – Writing Tips Plus – Writing Tools – Resources of the Language Portal of Canada – Canada.ca". www.noslangues-ourlanguages.gc.ca. Retrieved 2023-04-13.
- ^ a b c d e f g González, Juan M.; Suttle, Curtis A. (1993). "Grazing by marine nanoflagellates on viruses and virus-sized particles: Ingestion and digestion" (PDF). Marine Ecology Progress Series. 94 (1): 1–10. Bibcode:1993MEPS...94....1G. doi:10.3354/meps094001.
- ^ a b Gowing, Marcia M (1993). "Large virus-like particles from vacuoles of phaeodarian radiolarians and from other marine samples" (PDF). Marine Ecology Progress Series. 101: 33–42. Bibcode:1993MEPS..101...33G. doi:10.3354/meps101033.
- ^ a b Deng, Li; Krauss, Steffen; Feichtmayer, Judith; Hofmann, Roland; Arndt, Hartmut; Griebler, Christian (2014). "Grazing of heterotrophic flagellates on viruses is driven by feeding behaviour". Environmental Microbiology Reports. 6 (4): 325–330. doi:10.1111/1758-2229.12119. PMID 24992530.
- ^ a b Brown, Julia M.; Labonté, Jessica M.; Brown, Joseph; Record, Nicholas R.; Poulton, Nicole J.; Sieracki, Michael E.; Logares, Ramiro; Stepanauskas, Ramunas (2020). "Single Cell Genomics Reveals Viruses Consumed by Marine Protists". Frontiers in Microbiology. 11: 524828. doi:10.3389/fmicb.2020.524828. PMC 7541821. PMID 33072003.
- ^ a b Olive, Margot; Moerman, Felix; Fernandez-Cassi, Xavier; Altermatt, Florian; Kohn, Tamar (2022). "Removal of Waterborne Viruses by Tetrahymena pyriformis Is Virus-Specific and Coincides with Changes in Protist Swimming Speed". Environmental Science & Technology. 56 (7): 4062–4070. Bibcode:2022EnST...56.4062O. doi:10.1021/acs.est.1c05518. PMC 8988290. PMID 35258957.
- ^ a b c d DeLong, John P.; Van Etten, James L.; Al-Ameeli, Zeina; Agarkova, Irina V.; Dunigan, David D. (2023-01-03). "The consumption of viruses returns energy to food chains". Proceedings of the National Academy of Sciences. 120 (1): e2215000120. Bibcode:2023PNAS..12015000D. doi:10.1073/pnas.2215000120. ISSN 0027-8424. PMID 36574690. S2CID 255219850.
- ^ a b Hadas, Eran; Marie, Dominique; Shpigel, Muki; Ilan, Micha (2006). "Virus predation by sponges is a new nutrient-flow pathway in coral reef food webs". Limnology and Oceanography. 51 (3): 1548–1550. Bibcode:2006LimOc..51.1548H. doi:10.4319/lo.2006.51.3.1548.
- ^ a b Welsh, Jennifer E.; Steenhuis, Peter; de Moraes, Karlos Ribeiro; van der Meer, Jaap; Thieltges, David W.; Brussaard, Corina P. D. (2020). "Marine virus predation by non-host organisms". Scientific Reports. 10 (1): 5221. Bibcode:2020NatSR..10.5221W. doi:10.1038/s41598-020-61691-y. PMC 7089979. PMID 32251308.
- ^ Fuhrman JA (June 1999). "Marine viruses and their biogeochemical and ecological effects". Nature. 399 (6736): 541–548. doi:10.1038/21119. PMID 10376593. S2CID 1260399.
- ^ Suttle, Curtis A. (2007). "Marine viruses — major players in the global ecosystem". Nature Reviews Microbiology. 5 (10): 801–812. doi:10.1038/nrmicro1750. ISSN 1740-1534.
- ^ a b c d e f g h i j k l m n Mayers KM, Kuhlisch C, Basso JT, Saltvedt MR, Buchan A, Sandaa RA (February 2023). Prasad VR (ed.). "Grazing on Marine Viruses and Its Biogeochemical Implications". mBio. 14 (1): e0192121. doi:10.1128/mbio.01921-21. PMC 9973340. PMID 36715508.
- ^ a b c d e Jover LF, Effler TC, Buchan A, Wilhelm SW, Weitz JS (July 2014). "The elemental composition of virus particles: implications for marine biogeochemical cycles". Nature Reviews. Microbiology. 12 (7): 519–528. doi:10.1038/nrmicro3289. PMID 24931044. S2CID 17421986.
- ^ a b c d e f g h i j k l m n o p q r s t Deng L, Krauss S, Feichtmayer J, Hofmann R, Arndt H, Griebler C (August 2014). "Grazing of heterotrophic flagellates on viruses is driven by feeding behaviour". Environmental Microbiology Reports. 6 (4): 325–330. doi:10.1111/1758-2229.12119. PMID 24992530.
- ^ a b c "Feeding Stategies". depts.washington.edu. Retrieved 2023-03-29.
- ^ a b c Olive M, Moerman F, Fernandez-Cassi X, Altermatt F, Kohn T (April 2022). "Removal of Waterborne Viruses by Tetrahymena pyriformis Is Virus-Specific and Coincides with Changes in Protist Swimming Speed". Environmental Science & Technology. 56 (7): 4062–4070. doi:10.1021/acs.est.1c05518. PMC 8988290. PMID 35258957.
- ^ a b c d Vermont AI, Martínez Martínez J, Waller JD, Gilg IC, Leavitt AH, Floge SA, et al. (September 2016). "Virus infection of Emiliania huxleyi deters grazing by the copepod Acartia tonsa". Journal of Plankton Research. 38 (5): 1194–1205. doi:10.1093/plankt/fbw064.
- ^ a b c d e f g h i j k Evans C, Wilson WH (2008). "Preferential grazing of Oxyrrhis marina on virus infected Emiliania huxleyi". Limnology and Oceanography. 53 (5): 2035–2040. doi:10.4319/lo.2008.53.5.2035. S2CID 16440441.
- ^ a b c d e f g h i j k l m Frada MJ, Schatz D, Farstey V, Ossolinski JE, Sabanay H, Ben-Dor S, et al. (November 2014). "Zooplankton may serve as transmission vectors for viruses infecting algal blooms in the ocean". Current Biology. 24 (21): 2592–2597. doi:10.1016/j.cub.2014.09.031. PMID 25438947. S2CID 2682946.
- ^ Hevroni G, Flores-Uribe J, Béjà O, Philosof A (November 2020). "Seasonal and diel patterns of abundance and activity of viruses in the Red Sea". Proceedings of the National Academy of Sciences of the United States of America. 117 (47): 29738–29747. doi:10.1073/pnas.2010783117. PMC 7703586. PMID 33172994.
- ^ a b Belcher A, Manno C, Ward P, Henson SA, Sanders R, Tarling GA (2017-03-24). "Copepod faecal pellet transfer through the meso- and bathypelagic layers in the Southern Ocean in spring". Biogeosciences. 14 (6): 1511–1525. doi:10.5194/bg-14-1511-2017. ISSN 1726-4170.
- ^ a b c d e f g h i Welsh JE, Steenhuis P, de Moraes KR, van der Meer J, Thieltges DW, Brussaard CP (March 2020). "Marine virus predation by non-host organisms". Scientific Reports. 10 (1): 5221. doi:10.1038/s41598-020-61691-y. PMC 7089979. PMID 32251308.
진일보한 내용
- Criado, Miguel Ángel (12 January 2023). "Virivores, the organism can eat up to a million viruses a day". EL PAÍS English.
- Schrage, Scott (3 January 2023). "Eating viruses can power growth, reproduction of microorganism". Nebraska Today.