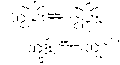판크라티스타틴
Pancratistatin | |
| 식별자 | |
|---|---|
| |
| CAS 번호 | |
| 펍켐 CID | |
| 켐스파이더 | |
| 화학 및 물리적 데이터 | |
| 공식 | C14H15NO8 |
| 어금질량 | 325.271 g·2011−1 |
| 3D 모델(JSmol) | |
| |
| |
| (iii) | |
판크라티스타틴(PST)은 아마릴리디아과[2](AMD) 계열의 하와이 토착 식물인 [1]거미 백합에서 처음 추출한 천연 화합물이다.
발생
판크라티스타틴은 아마릴리디아과 내의 꽃식물인 하와이 거미 백합에서 자연적으로 발생한다.판크라티스타틴은 대부분 거미 백합의 구근 조직에서 발견된다.대기 중 CO가2 농축되면 이들 식물에서 판크라티스타틴을 포함한 항바이러스 2차 대사물의 생성을 향상시킬 수 있다는 것이 밝혀졌다.[3]판크라티스타틴은 하와이 야생형에서 전구를 구하면 히메노칼리스 리토랄리스의 열대 전구와 100~150mg/kg의 순서로 분리할 수 있다.그러나 이 화합물은 현장 및 온실 재배 전구 또는 예를 들어 아리조나에서 재배된 조직 배양액에서 상업적으로 추출해야 하며, 이는 10월 성수기에도 낮은 수준의 판크라티스타틴(최대 22mg/kg)을 생성한다.전구가 잠잠해지는 10월 이후에는 판크라티스타틴 수치가 떨어져 5월까지 4mg/kg에 불과하다.월별 판크라티스타틴 함량 변화를 보여주는 현장 재배 전구는 같은 기간 재배한 온실에서 재배한 전구보다 다소 적은 양(2~5mg/kg)을 생산한다.[4]전세계적으로 약 40종의 거미 백합이 있으며 그들은 주로 남아메리카의 안데스 산맥이 원산지다.
제약연구
판크라티스타틴은 특히 암 치료 분야에서 [5]신약 개발의 기초로서 잠재력이 있다고 생각된다.[6]
생합성
판크라티스타틴 생물 합성에 대한 정확한 해명은 없을 수 있지만, 구조 면에서 판크라티스타틴과 매우 유사한 나르시클라신, 리코리시딘의 생합성에 대한 추측이 있어 왔다.생합성은 O-메틸노르벨라딘 4에서 파라-파라 페놀 커플링에 의한 합성을 통해 이루어지며 중간으로서 비타틴 5를 얻는다.이후 두 개의 탄소 원자와 화합물 5(비타틴)의 히드록실화(hydroxylation)를 제거하면 나르시클라신(narciclasine.[7]
총합성
경주용 (+/-) 판크라티스타틴의 최초의 총합성은 사무엘 다니셰프스키와 정연 리가 제안했는데, 이 총합성은 매우 복잡하고 긴 (40단계) 총합성을 수반했다.다니셰프스키와 정에 따르면, 이 합성에는 실망스러운 낮은 합성수율을 야기하는 몇 가지 약한 단계가 있었다.가장 어려운 문제들 중, Moffatt 전치 및 정형외과적 문제는 특히 C, 하이드록실 그룹을 재분배하기 위해 차단 기동을 필요로 하는 심각한 경우로 간주되었다.그러나, Danishevsky와 Yon Lee 모두 PST 총합성에 대한 그들의 접근방식이 장점이 없는 것은 아니라고 말했고, 그들의 연구가 PST 총합성을 위한 훨씬 더 실질적이고 효율적인 방법을 구축하기 위해 다른 의약 과학자들에게 흥미를 줄 것이라고 믿었다.[9][10]
다니셰프스키와 융의 작품은 2006년 리, 엠.가 예언한 PST의 또 다른 총합성을 위한 토대를 제공했다.이 방법은 그것의 스테레오센서가 판크라티스타틴의 C-링에 있는 것과 정확히 같다는 피니톨 30을 시작으로, 보다 정교한 접근법을 채택했다.[11]화합물 30의 diol 기능 보호는 화합물 31을 제공했다.이것의 자유 히드록실(hydroxyl)은 이후 아지드화(Azide)로 대체되어 32를 주었다.실릴 기능을 제거한 후 주기적인 황산염을 설치하여 제품 33을 획득하였다.스타우딩거 반응은 아지드 33에서 아민 34를 공짜로 주었다.34와 35 사이의 결합 반응은 적당한 수율을 가진 화합물 36을 주었다.아미드와 프리페놀의 메톡시메틸 방지는 화합물 37을 주었다.이 후자의 제품은 t-BuLi로 처리한 후 염화 세륨을 첨가하여 혼합물 38을 제공했다.상용화된3 피니톨에서 12단계로 전체 수율 2.3% 20의 판크라티스타틴 3을 12단계에 걸쳐 BBr과 메탄올의 38을 완전히 제거했다.[12]
판크라티스타틴의 가장 최근 및 최단 합성은 데이비드 사를라와 공동작업자에 의해 달성되어 각각 (+---)판크라티스타틴과 (---7)7데옥시판크라티스타틴의 비대칭 합성을 7단계와 6단계로 완료하였다.[13]이 합성의 핵심 단계는 98:2 er에 아민과 카타콜 링을 직접 설치한 벤젠의 니켈 촉매 디로믹스였다. 에폭시디화 이후 디엔의 디히드록실화는 4개의 히드록실 그룹을 제공했다.합성은 아민의 절제 및 코발트 촉매 CO 삽입으로 완료되어 락탐을 공급했다. (+-7-deoxypancratistatin)은 62%의 수율에서 직접 산화되어 (+--Pancratistatin)을 제공할 수 있다.이 합성은 판크라티스타틴과 아날로그의 생물학적 평가에 필수적일 수 있는 최종 제품의 여러 그램을 산출했다.
스테레오콘 팬크라티스타틴 합성에 대한 매우 최근의 접근은 서울 국립대학교의 김상희에 의해 이루어졌는데, 클라이센의 디히드롭리아네틸렌 재배열과 주기적인 황산염 제거반응이 21일에 채용되었다.
페난트리돈의 B 링(세 개의 막이 있는 질소 헤테로사이클릭 링)은 비슐러-나피에랄스키 반응을 이용하여 형성된다.C 링에 스테레오센트가 있는 n 전구체 3은 시스 분해 시클로헥센 4에서 입체적으로 합성된다.화합물 4에 불포화 카보닐이 존재함에 따라 3,4-디하이드로-2H-피라닐틸렌의 클라이센 재배치를 사용할 수 있게 되었다.[14]
합성은 과도한 트리메틸 인산염으로 6을 치료하는 것으로 시작한다.이 반응은 97%의 수율에 인산염 7을 제공한다.THF 양식(E)-올레핀 5의 LHMDS 앞에서 7과 acrolein dimmer 8 사이의 Horner-Wadsworth-Emons reaction을 사용하며, 60%의 수율에서 매우 높은 입체감을 지닌다.최종 제품에서 (Z)올레핀의 1% 미만이 검출되었다.디히드롭라넷하이렌의 클라이센 재배열은 78%의 수율에서 단일 이소머로서 시스분산 사이클로헥센을 형성한다.
합성의 다음 단계는 NaClO를2 사용한 화합물 4의 알데히드를 해당 카르복실산 9에 90% 수율의 산화를 포함한다.9의 요오드올락톤화 및 환류 벤젠에서 DDU를 이용한 후속 치료는 78%의 수율에서 자전거 레이시톤을 발생시킨다.NaOMe과 함께 락톤 10의 메타노리시스 분해는 히드록실 에스테르 11과 그것의 C-4a 에피머 (Pancratistatin numbering)의 혼합물을 형성한다.LiOH를 포함한 메틸 에스테르 11의 사포닌화는 이소시아네이트 중간값을 지불하기 위해 톨루엔을 역류하는 디페닐인스포릴 아지드를 함유한 결과산 12를 커티우스 재배열한 후, NaOMe/MeOH로 처리하면 82%의 수율에 해당하는 카바메이트 13을 형성한다.
합성의 다음 단계는 C-3 히드록실 그룹의 역행성 제거와 주기적인 황산염 제거에 의해 달성된 후속 불활성화를 포함한다.Diol 16은 티오닐 염화물로 치료해야 하며, RuCl을3 통한 추가 산화는 83%의 수율에서 순환 황산염 17을 제공한다.[15]DDBU를 이용한 주기성 황산염의 치료는 원하는 아군 알코올 18(수율 67%)을 산출한다.
OsO와의4 반응은 88%의 수율에서 단일 Isomer 19를 형성한다.밴웰의 변형된 비슐러-나피에랄스키 반응에 수반되는 19 (수율 77%)의 과민화는 소량의 이성질체 21 (7:1 역률)으로 복합 20을 형성한다.NaOMe/MeOH를 사용한 보호 그룹 제거는 83%의 Pancratistatin을 형성한다.
참고 항목
참조
- ^ 시들라코프스키, P.; 맥라클란-부르그네스; 그리핀, C.; 티루말라이; 맥널티, J.; 판디, S. 판디, S. 미토콘드리아를 표적으로 하여 폐암을 유도하는 유방암 세포에 대한 판크라티스타틴과 타목시펜의 시너지.암 비올. 2008년 7월 376-384년.
- ^ Shnyder, S. D.; Cooper, P. A.; Millington, N. J.; Gill, J. H.; Bibby, M. C. Sodium Pancratistatin 3,4-O-Cyclic Phosphate, a Water-Soluble Synthetic Derivative of Pancratistatin, Is Highly Effective in a Human Colon Tumor Model.J. Nat. 2008년 7월 31일 321-324
- ^ 지스카, L.; 엠슈, S.; 존슨, E. 대기 이산화탄소와 공기 온도 상승의 함수로서 선택된 알칼로이드의 생산과 농도의 변화: 에토노-약물학에 대한 시사점.Global Change Biology 2005, 11, 1798-1807
- ^ Ingrassia, L.; Lefranc, F.; Mathieu, V.; Darro, F.; Kiss, R. Amaryllidae과 이소카르보스티릴 알칼로이드와 그 유도체들이 유망한 항균제로서의 역할을 한다.번역하다. 2008년 온콜, 1, 1-13.
- ^ Nair JJ, Bastida J, Codina C, Viladomat F, van Staden J (September 2013). "Alkaloids of the South African Amaryllidaceae: a review". Nat Prod Commun (Review). 8 (9): 1335–50. PMID 24273880.
- ^ Nair JJ, Bastida J, Viladomat F, van Staden J (December 2012). "Cytotoxic agents of the crinane series of amaryllidaceae alkaloids". Nat Prod Commun (Review). 7 (12): 1677–88. PMID 23413581.
- ^ 푸간티, C; 스툰턴, J; 타자들비, AR.나르시클라신의 생합성.J. 켐. Soc. D: 화학. 코뮌 1971, 19, 1154–1155.
- ^ Ghavre, Mukund; Froese, Jordan; Pour, Milan; Hudlicky, Tomas (2016). "Synthesis of Amaryllidaceae Constituents and Unnatural Derivatives". Angewandte Chemie International Edition. 55 (19): 5642–5691. doi:10.1002/anie.201508227. PMID 26969844.
- ^ 아니셰프스키, S.; 리, J. Y.(B1)-판크라티스타틴의 총합성.J. Am. Chem. Soc. 1989, 111, 4829-37.
- ^ 리, M; 우, A; 저우, P. 치랄 건축 블록으로 피니톨을 이용한 (+-판크라티스타틴)의 간결한 합성이다.테트라헤드론 2006, 47, 3707–3710.
- ^ 김, S, 고, H, 김, E; 김, D.판크라티스타틴의 입체 합성 총합.조직, 2002년 4월 1343-5일
- ^ Image gallery: a: TIPDSCl2, imidazole, DMAP, DMF, 24%. b: DMP, p-TsOH, acetone, 81%. c: PPh3, DEAD, CH3SO3H, CH2Cl2, 0 °C to r.t. then NaN3, DMF, 60 °C, 72%. d: TBAF, THF, 0 °C to r.t., 100%.e: SOCl2, Et3N, CH2Cl2, 0°C.f: NaIO4, RuCl3, aq CH3CN, 87%(2단계 이상)g: PPh3, aq THF, 0°C ~ r.t, 94%h: Et2O, 35, 0°C, 64%.i: K2CO3, MOMCl, DMF, 84%. j: t-BuLi, CeCl3, ultrasound, THF, −78 °C to r.t., 72%. k: BBr3, CH2Cl2, −78 °C to 0 °C, 1 hour then MeOH, −78 °C to 0 °C, 2 hours, 52%.
- ^ Hernandez, Lucas W.; Pospech, Jola; Klöckner, Ulrich; Bingham, Tanner W.; Sarlah, David (2017-11-08). "Synthesis of (+)-Pancratistatins via Catalytic Desymmetrization of Benzene". Journal of the American Chemical Society. 139 (44): 15656–15659. doi:10.1021/jacs.7b10351. ISSN 0002-7863. PMC 5960067. PMID 29059521.
- ^ 신, K. J.; 문, H. R.; 조지, C.; 마르케즈, V. E. J. Org. 2000년, 65년, 2172년
- ^ Winkler, J. D.; Kim, S.; Harrison, S.; Lewin, N. E.; Blumberg, P. M. J. Am. 1999년 121, 296번지 화학.