뜸부기증
Myxomatosis| 묘소마바이러스 | |
|---|---|
 | |
| 근종바이러스(전송 전자현미경) | |
| 바이러스 분류 | |
| (랭킹되지 않음): | 바이러스 |
| 영역: | 바리드나비리아 |
| 킹덤: | 밤퍼드비래 |
| 망울: | 뉴클레오시토비리코타목 |
| 클래스: | 포케스비리케테스속 |
| 순서: | 치토비라목 |
| 패밀리: | 팍스비르과 |
| 속: | 르포리폭스바이러스 |
| 종: | 묘소마바이러스 |
미소마토증(Myxomatosis)은 레포리포스바이러스 속 포스바이러스인 미소마 바이러스에 의해 발생하는 질환이다.자연 호스트는 남미와 중미의 타페티(실빌라거스 브라실리엔시스)와 북아메리카의 붓토끼(실빌라거스 바흐마니)가 있다.근종 바이러스는 이들 종에서 가벼운 질병만 일으키지만, 유럽 토끼(오릭톨라거스 쿠니큘러스)에서는 심각하고 보통 치명적인 질병을 일으킨다.점막증은 바이러스가 그것에 적응한 종에서 순진한 숙주로 뛰어올랐을 때 생기는 현상을 잘 보여주는 사례로, 이러한 이유로 광범위하게 연구되어 왔다.이 바이러스는 1950년대 호주, 프랑스, 칠레에서 야생 유럽 토끼 개체수를 통제하기 위해 의도적으로 도입되었다.
원인

명종 바이러스는 르포리폭스바이러스속(Poxvirae, subfamily Choodopoxvirinae)에 있다.다른 양귀비루스와 마찬가지로 근종 바이러스는 선형 이중 가닥 DNA를 가진 큰 DNA 바이러스다.바이러스 복제는 세포의 세포질에서 일어난다.자연 호스트는 남미와 중미의 타페티(실빌라거스 브라실리엔시스)와 북아메리카의 붓토끼(실빌라거스 바흐마니)가 있다.근종 바이러스는 이들 종에서 경증만 일으키며, 증상은 피부 결절의 형성에 국한된다.[1]
근종증은 근종 바이러스에 의해 야기되는 유럽 토끼의 심각하고 종종 치명적인 질병의 이름이다.다른 변종들이 존재하는데 그 변종은 그들의 정력에 다양하다.미국 서부해안과 멕시코 바하에 서식하는 캘리포니아 변종은 발병률이 100%로 보고돼 가장 치명적이다.남아메리카와 중앙 아메리카에 존재하는 남아메리카 변종은 약간 덜 치명적이며 보고된 사망률은 99.8%이다.유럽과 오스트레일리아에 존재하는 균주는 감소되었고, 보고된 사망률은 50-95%로 나타났다.유럽과 호주의 야생 토끼들은 바이러스에 대한 면역력이 어느 정도 발달한 반면, 이것은 일반적으로 애완 토끼에게는 해당되지 않는다.[2]
전송
균사체는 주로 곤충에 의해 전염된다.질병의 전염은 보통 모기나 벼룩에 물려서 발생하지만, 또한 아라키드 진드기뿐만 아니라 파리와 이도 물어서 발생할 수 있다.근종 바이러스는 이러한 절지동물 숙주에서는 복제되지 않지만, 한 토끼에서 다른 토끼로 절지동물을 물어 물리면서 물리적으로 옮겨진다.계절성은 절지동물 벡터의 가용성과 감염된 야생 토끼의 근접성에 의해 주도된다.[3]
근종 바이러스는 직접 접촉으로도 전염될 수 있다.감염된 토끼는 안구 분비물과 코로 된 분비물과 침식된 피부에서 바이러스를 배출한다.그 바이러스는 정액과 생식기 분비물에도 존재할 수 있다.양귀비는 환경에서 상당히 안정적이며 물병, 사료, 씨징, 사람의 손과 같은 오염된 물체에 의해 퍼질 수 있다.[3]건조에는 내성이 있지만 일부 소독제에는 민감하다.[4]
병리학
유럽 토끼들이 남미 균주의 근종 바이러스에 대한 피내주사를 맞았다는 실험연구는 다음과 같은 질병의 진행을 입증했다.처음에 그 바이러스는 접종 부위의 피부에 증식되었다.접종 후 약 2일 후 인근 림프절에서 바이러스가 발견됐고, 3일 후에는 혈류 및 복부 장기에서 바이러스가 발견됐다.약 4일 동안 그 바이러스는 고환뿐만 아니라 비절연 피부로부터 격리되었다.눈꺼풀이 약간 두꺼워지고 결막액에 바이러스가 있는 것을 5일째에 검출할 수 있었다.고환성 결함은 6일째 되는 날 눈에 띄었다.[5]
유럽 토끼의 임상적 표현
균사체의 임상 징후는 바이러스 변종, 접종 경로, 숙주의 면역 상태에 따라 달라진다.고전적인 결절형 질환의 증상으로는 접종부위의 피하질량, 눈꺼풀과 성기의 붓기와 부종, 우유빛이나 청혈성 안구 분비, 발열, 무기력증, 우울증, 거식증 등이 있다.[citation needed]
메러디스(2013년)에 따르면 이 병의 대표적인 시간 경과는 다음과 같다.[1]
| 감염 후 며칠 | 임상 징후 |
|---|---|
| 2–4 | 감염부위의 붓기 |
| 4 | 열 |
| 6 | 눈꺼풀, 얼굴, 귀밑, 항진부위의 붓기 |
| 6 | 눈꺼풀의 적색 핀포인트 병변 및 신체 부위의 상승된 질량을 포함한 2차 피부 병변 |
| 6–8 | 점액성 및 크러킹이 되는 투명한 안구 및 코 배출 |
| 7–8 | 호흡곤란 |
| 8–9 | 저체온증 |
| 10 | 붓기로 인한 눈꺼풀 완전 폐쇄 |
| 10–12 | 죽음 |
고병원성 변종이 있는 과급성 질환에서는 결막염 이외의 최소한의 임상 징후로 감염 후 5~6일 이내에 사망이 발생할 수 있다.죽음은 보통 10일에서 12일 사이에 일어난다.북아메리카와 남아메리카에 존재하는 것과 같은 매우 치명적인 변종은 기본적으로 100%의 사망률을 가지고 있다.
감쇠하고 덜 치명적인 바이러스 변종에 감염된 토끼의 경우, 보이는 병변이 더 다양하고 일반적으로 온화하며, 시간 경과가 지연되고 길어진다.많은 토끼들이 살아남을 것이고 피부병변은 점차 딱지를 떼고 떨어져 흉터가 남는다.이전에 예방접종을 받은 부분 면역력이 있는 집토끼에서도 가벼운 질환이 나타난다.예방접종을 받은 토끼는 종종 국소적인 딱지 병변으로 코다리나 눈 주위에 자주 나타나거나 몸 위에 여러 개의 피부 덩어리가 나타난다.그들은 여전히 밝고 경각심이 강하며, 간호를 받으며 살아남는 경우가 많다.[1]
호흡기 증상은 균사체 1단계에서 살아남은 토끼에게서 흔히 발견되는 증상이다.점액성 코 배출이 일어나 머리와 목의 연장과 함께 헐떡이며 스투성 호흡으로 이어진다.2차 세균성 폐렴은 많은 경우에 발생한다.코방출과 같은 만성 호흡기 질환은 살아남은 토끼에게 흔하다.회수된 것으로 보이는 토끼에서도 괴사 상태에서 공기가 아닌 액체로 가득 찬 폐엽을 발견하는 것은 드문 일이 아니다.[3]
1970년대 이후 이 병의 "아미크소마토스(amyxomatous)" 형태가 유럽에서 보고되었는데, 이 질병은 myxomatosis의 전형적인 피부 결절이 결여되어 있다.이 형태는 임상적으로 더 온화하고 일반적으로 치명적이지 않다.맑고 깨끗한 비강 분비를 포함한 호흡기 징후가 우세하다.복막부종, 눈꺼풀 부종, 충혈성 표백결막염 등이 일반적으로 남아 있다.이 형태는 야생 토끼에서 관찰되었지만 주로 경작된 토끼에서 중요하다.[1]
진단
유럽산 토끼의 균사체 진단은 흔히 특징적인 임상적 외모를 기준으로 이루어진다.토끼가 고전적인 뜸부기 증상을 보이지 않고 죽거나, 추가 확인이 필요한 경우 여러 실험실 검사를 이용할 수 있다.역사적으로 이것들은 조직병리학, 전자현미경, 바이러스 격리를 포함했다.영향을 받은 피부에 대한 조직병리학적 검사는 일반적으로 뮤신, 염증 세포, 부종의 행렬 안에서 구별되지 않은 중피 세포를 보여준다.표피와 결막 상피에서 내성포착을 볼 수 있다.[6]음극 전자 현미경 검사도 청두의 크기가 크고 독특한 구조 때문에 진단에 사용할 수 있다.이 방법은 양귀비루스의 신속한 가시화를 허용하지만, 바이러스 종이나 변종의 구체적인 검증은 허용하지 않는다.[7]바이러스 격리는 다른 바이러스 검출 방법을 비교하는 "골드 스탠더드"로 남아 있다.이론적으로 적어도 시료에 존재하는 하나의 실행 가능한 바이러스는 배양 세포에서 배양될 수 있으므로, 이를 확대하여 더 상세한 특성화를 허용할 수 있는 충분한 물질을 생산할 수 있다.[8]
최근 중합효소 연쇄반응(PCR)과 실시간 중합효소 연쇄반응 측정과 같은 분자법이 발전하면서 균사체 바이러스 식별의 더 빠르고 정확한 방법이 만들어졌다.[7]실시간 PCR은 코, 안구 또는 생식기 면봉에 대한 신속한 검사를 가능하게 하여 근막증 진단을 단순화한다.파라핀이 배합된 조직 샘플에도 사용되어 Myxoma 바이러스의 유무를 확인하고 바이러스 변종을 확인할 수 있다.[9]
치료
현재, 근막염에 대한 구체적인 치료법은 존재하지 않는다.치료를 시도하겠다는 결정이 내려지면 고통의 장기화를 피하기 위해 세심한 모니터링이 필요하다.이전에 백신을 접종한 토끼나 감쇠된 변종에 감염된 토끼는 액체, 식품 및 광범위한 스펙트럼 항바이러스제를 사용하여 치료하면 회복될 수 있다.음식과 물 섭취의 중단, 지속적인 심각한 체중 감소 또는 37C(98.6F) 미만의 직장 온도가 안락사를 고려해야 하는 이유다.[3]
예방
예방접종
일부 국가에서는 균사병 예방 백신을 사용할 수 있다.모두 감쇠된 근종 바이러스 변종이나 교차 면역성을 제공하는 밀접한 관련이 있는 쇼페 피브로마 바이러스에 기반한 변형된 살아있는 백신이다.균사체가 풍토병인 세계 각지의 모든 토끼는 벡터나 찜기에 의해 바이러스가 안으로 옮겨지는 능력 때문에 실내에 두더라도 일상적으로 예방접종을 받는 것이 좋다.토끼가 일상적으로 예방접종을 하지 않는 집단 상황에서는 발병시 예방접종이 병인과 사망률을 제한하는 데 도움이 된다.[1]백신은 100% 보호를 제공하지 않기 때문에 야생 토끼와 곤충 벡터와의 접촉을 막는 것이 여전히 중요하다.[3]균사체 백신은 반드시 정기적으로 증식해야 효과가 유지되며, 보통 매년 예방접종을 하는 것이 좋다.[1]
유럽과 영국에서는 균사체와 토끼의 출혈성 질병으로부터 모두 보호하는 노비바크 마이소-RHD라고[10] 불리는 이분법 백신이 이용 가능하다.이 백신은 생후 5주 이상 토끼의 면역접종 허가를 받았으며 면역 시작은 약 3주가 걸린다.균사체 및 토끼출혈성 질환에 대한 보호는 12개월간 면역기간이 있으며, 지속적인 보호를 위해 연간 예방접종을 권고한다.그 백신은 폐렴의 사망률과 임상적 징후를 감소시키는 것으로 밝혀졌다.[11]
호주에서는 현재 야생 토끼로 백신 바이러스가 전파돼 균사체에 대한 면역력이 높아질 수 있다는 우려 때문에 균사병 예방접종이 금지돼 있다.호주의 야생 토끼는 이미 많은 환경 피해를 입히고 있기 때문에, 이 우려는 정부에 의해 심각하게 받아들여지고 있다.[12]호주의 많은 애완 토끼들이 면역력 부족으로 인해 근종증으로 계속 죽어가고 있다.[13]애완동물에게 백신을 허용하기 위한 캠페인이 적어도 한 번은 있다.[14]호주 수의학회는 애완용 토끼를 위한 안전하고 효과적인 균사병 백신 도입을 지지하고 있으며,[15] 호주 RSPCA는 이용 가능한 균사종 바이러스 백신에 대한 검토와 호주 환경에 미칠 수 있는 영향에 대한 과학적 평가를 거듭 요구해 왔다.[16]
비록 멕시코와 미국의 일부 지역에서 균사체가 만연해 있지만, 이들 두 나라에는 상업적으로 구할 수 있는 백신이 없다.최근 미국에서 보고된 사례에 대한 정보는 하우스 래빗 협회에서 확인할 수 있다.[17]미국에서 백신 수입은 농림부의 일부인 동물 및 식물 건강 검사 서비스에 의해 감독된다.[18]
기타 예방조치
균사체가 만연되어 있지만 백신이 없는 곳에서는 균사종 바이러스에 대한 노출을 막는 것이 매우 중요하다.백신을 접종한 토끼도 보호가 필요한데, 백신은 100% 효과가 없기 때문이다.야생토끼와의 접촉을 막고, 토끼를 실내(선호)나 화면 뒤에 두어 모기 노출을 방지하고, 벼룩, 이, 진드기를 치료하고 예방하는 토끼안심제를 사용함으로써 반려동물의 균사병에 걸릴 위험을 줄일 수 있다.노출됐을 가능성이 있는 새 토끼는 모두 격리하고, 균사체가 의심되는 토끼는 진단이 배제될 때까지 즉시 격리해야 한다.질병이 확인되면 오염된 우리, 접시 또는 다른 물체를 표백제 10%, 수산화나트륨 10%, 포르말린 1%–1.4%로 소독해야 한다.[19]
모집단 제어 에이전트로 사용
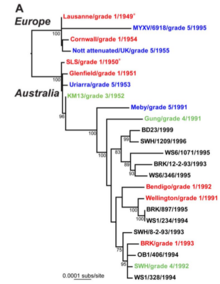
근종 바이러스는 척추동물 해충, 즉 호주와 유럽의 유럽 토끼를 퇴치하기 위한 목적으로 야생에 의도적으로 유입된 최초의 바이러스였다.이 전략의 장기적 실패는 토끼와 바이러스 개체군에 대한 자연 선택적 압력에 기인해 왔으며, 이로 인해 균사병 저항성이 있는 동물이 출현하고 바이러스 변형이 약화되었다.이 과정은 병원체의 이종 간 전송에 따른 호스트-병원성 공진화의 전형적인 예로 간주된다.[20]
호주.

유럽 토끼는 1788년 초기 영국 정착민들에 의해 호주로 데려왔다(호주의 토끼 참조).처음에는 식량원료로 사용되었고, 나중에는 야생화되었고 그 수는 급증했다.1937년 11월 오스트레일리아 과학산업연구협의회는 와당섬을 이용하여 균사병 첫 현장실험을 실시하였는데, 이로 인해 전국에 균사종 바이러스가 성공적으로 방출될 수 있는 방법론이 확립되었다.[21]1950년 남미 타페티(Sylvilagus brasiliensis)에서 발생한 균사종 바이러스의 SLS 변종이 야생 토끼에 대한 생물학적 통제제로 호주에서 방출되었다.그 바이러스는 처음에는 치사율이 매우 높았고, 추정 치사율은 99.8%에 가까웠다.그러나 몇 년 안에 이 변종은 덜 독성이 강한 변종으로 대체되었고, 이로 인해 감염된 토끼의 생존 기간이 길어지고 질병 전염이 강화되었다.그 바이러스는 균사체에 내성이 있는 토끼의 진화를 위해 강한 선택 압력을 만들었다.토끼가 더 저항적이 될수록 바이러스 변종은 덜 치명적이 됨으로써 반응했다.[2]토끼 출혈성 질병 바이러스는 1995년부터 호주에서 야생 토끼 개체수를 조절하는데도 이용되어 왔다.[22]
유럽
1952년 6월 프랑스 북서부의 한 부동산 소유주인 폴 펠릭스 아르망델릴레는 두 마리의 야생 토끼에게 근종 바이러스를 주사했다.[23]재산상 토끼만 박멸하자는 취지였지만 병은 서유럽과 아일랜드, 영국 등을 통해 빠르게 퍼졌다.[24]1953년 영국으로의 도입과 1954년 아일랜드로의 도입과 같이 바이러스의 일부 보급은 분명히 계획적인 것처럼 보였다.[25]그러나 호주와는 달리 유럽에서의 확산을 막기 위해 많은 노력을 기울였다.이러한 노력은 허사로 판명되었다.추정치에 따르면 영국의 야생 토끼 개체수는 99% 감소한 반면 프랑스는 90%에서 95%로, 스페인은 95%로 감소했다.이것은 차례로 이베리아 스라소니나 스페인 제국 독수리 같은 전문 토끼 포식자들을 멸종 직전까지 몰았다.[26][27]야생토끼 개체수와 천연 포식자의 개체수를 감소시킬 뿐만 아니라, 균사병은 고기와 털을 얻기 위한 집토끼를 생산하는 대규모 토끼 사육 산업에 상당한 영향을 미쳤다.[28]근종 바이러스의 로잔느 변종은 다른 변종에서는 볼 수 없는 큰 보라색 피부 노눈의 형성을 일으킨다.호주에서 일어났듯이, 그 바이러스는 일반적으로 덜 치명적이 되었고 야생 토끼의 개체수는 그 후에 더 저항적이 되었다.[24]
뉴질랜드
급증하는 토끼 문제를 통제하기 위해 1952년 뉴질랜드에 myxomatosis를 도입하는 것은 벡터가 없어서 실패했다.[29]
남아메리카
1936년 푼타 산타마리아에서 두 쌍의 유럽산 토끼가 출몰하자 티에라 델 푸에고 북반구에 퍼졌다.더 많은 토끼들이 1950년 아르헨티나 해군과 민간 토끼 농부에 의해 우슈아 근처로 소개되었다.토끼들은 순식간에 해충이 되어 땅바닥을 구멍으로 쓸어버리고 풀도 없이 내버려두었다.1953년까지 토끼 인구는 약 3천만 명에 달했다.1954년 칠레 당국은 티에라 델 푸에고에게 브라질의 근종 바이러스를 도입했는데, 이 바이러스는 토끼를 매우 낮은 인구 수준으로 데려오는 데 성공했다.[30]
진화 모델로 사용
질병 출현, 병원체 발생, 약물 내성, 백신 효능에 대한 바이러스 진화의 중요성을 고려할 때 이론가나 실험가들에 의해 잘 연구되어 왔다.호주와 프랑스의 유럽 토끼 개체군에 균사체 바이러스가 유입되면서 독성 진화에 자연적인 실험이 이루어졌다.[31]초기 바이러스 변종은 매우 치명적이었지만, 감쇠된 변종은 곧 현장에서 회복되었다.토끼가 더 오래 생존할 수 있게 했던 이러한 감쇠된 변종은 더 쉽게 전염되기 때문에 지배하게 되었다.복수의 근종 변종의 게놈 서열 전부가 발표되면서 과학자들은 근종 바이러스의 독성과 행동의 변화에 어떤 유전자가 작용하는지 정확히 파악할 수 있었다.[32]
소설로
묘목증은 리처드 애덤스의 소설 워터쉽 다운의 토끼 캐릭터들에 의해 "백맹"이라고 일컬어지는데, 이야기에서 토끼 족장이 괴로워하는 것 같은 토끼를 모두 쫓아냈다.토끼 영웅 엘아흐라이라에 관한 소설의 민화 중 하나에서 병의 전염은 토끼 저승의 영주 인레의 검은 토끼에 의해 설명된다("토끼의 귀에 있는 벼룩에 의해 옮겨지며, 아픈 토끼의 귀에서 동료의 귀로 전달된다").[33]
참조
- ^ a b c d e f Meredith, A (2013). "Viral skin diseases of the rabbit". Veterinary Clinics of North America: Exotic Animal Practice. 16 (3): 705–714. doi:10.1016/j.cvex.2013.05.010. PMID 24018033.
- ^ a b Kerr, P (2017). "Genomic and phenotypic characterization of myxoma virus from Great Britain reveals multiple evolutionary pathways distinct from those in Australia". PLOS Pathogens. 13 (3): e1006252. doi:10.1371/journal.ppat.1006252. PMC 5349684. PMID 28253375.
- ^ a b c d e Kerr, P (2013). "Viral Infections of Rabbits". Veterinary Clinics of North America: Exotic Animal Practice. 16 (2): 437–468. doi:10.1016/j.cvex.2013.02.002. PMC 7110462. PMID 23642871.
- ^ "Disinfection". The Center for Food Security and Public Health. Retrieved 21 July 2019.
- ^ Fenner, F; Woodroofe, GM (1953). "The pathogenesis of infectious myxomatosis: the mechanism of infection and the immunological response in the European rabbit (Oryctolagus cuniculus)". The British Journal of Experimental Pathology. 34 (4): 400–411. PMC 2073564. PMID 13093911.
- ^ Quesenberry, K (2012). Ferrets, Rabbits, and Rodents: Clinical Medicine and Surgery (Third ed.). Elsevier Saunders. p. 240. ISBN 978-1-4160-6621-7.
- ^ a b MacLachlan, J (2017). Fenner's Veterinary Virology, 5th Edition. Elsevier. p. 158. ISBN 978-0-12-800946-8.
- ^ MacLachlan, J (2017). Fenner's Veterinary Virology, 5th Edition. Elsevier. p. 112. ISBN 978-0-12-800946-8.
- ^ Albini, S; Sigrist, B; Güttinger, R; et al. (6 December 2011). "Development and validation of a real-time polymerase chain reaction assay" (PDF). Journal of Veterinary Diagnostic Investigation. 24 (1): 135–137. doi:10.1177/1040638711425946. PMID 22362943. S2CID 32171325.
- ^ "Nobivac Myxo RHD". MSD Animal Health. Retrieved 20 July 2019.
- ^ "Nobivac Myxo RHD Data Sheet". European Medicine Agency. Retrieved 20 July 2019.
- ^ "A Statement from the Chief Veterinary Officer (Australia) on myxomatosis vaccine availability in Australia". Australian Government Department of Agriculture. Retrieved 20 July 2019.
- ^ "The Rabbit Sanctuary Myxomatosis Hotline". Myxomatosis. Retrieved 20 July 2019.
- ^ "Myxo Campaign". Myxomatosis. Retrieved 20 July 2019.
- ^ "Myxomatosis vaccination of pet rabbits". Australian Veterinary Association. Retrieved 20 July 2019.
- ^ "Why can't I vaccinate my rabbit against Myxomatosis?". Royal Society for the Prevention of Cruelty to Animals. Retrieved 20 July 2019.
- ^ "Myxomatosis in the US". House Rabbit Society. Retrieved 23 August 2019.
- ^ "Veterinary Biologics". United States Department of Agriculture, Animal and Plant Health Inspection Service. Retrieved 23 July 2019.
- ^ Oglesbee, B (2011). Blackwell's Five-Minute Veterinary Consult: Small Mammal (Second ed.). West Sussex, UK: Wiley-Blackwell. p. 455. ISBN 978-0-8138-2018-7.
- ^ MacLachlan, J (2017). Fenner's Veterinary Virology, 5th Edition. Elsevier. p. 168. ISBN 978-0-12-800946-8.
- ^ "Rabbits around a waterhole at the enclosed trial site at Wardang Island, 1938". National Archives of Australia. Retrieved 28 July 2019.
- ^ Mahar JE, Read AJ, Gu X, Urakova N, Mourant R, Piper M, Haboury S, Holmes EC, Strive T, Hall RN (January 2018). "Detection and Circulation of a Novel Rabbit Hemorrhagic Disease Virus in Australia". Emerg Infect Dis. 24 (1): 22–31. doi:10.3201/eid2401.170412. PMC 5749467. PMID 29260677.
- ^ Davis, J. "Darwin's rabbit is revealing how the animals became immune to myxomatosis". Natural History Museum. Retrieved 14 August 2019.
- ^ a b Kerr, P; Liu, J; Cattadori, I; et al. (6 March 2015). "Myxoma Virus and the Leporipoxviruses: An Evolutionary Paradigm". Viruses. 7 (3): 1020–1061. doi:10.3390/v7031020. PMC 4379559. PMID 25757062.
- ^ Bartrip, P (2008). Myxomatosis: A History of Pest Control and the Rabbit. London, UK: Tauris Academic Studies. ISBN 978-1845115722.
- ^ Gil-Sánchez, JM; McCain, EB (14 October 2011). "Former range and decline of the Iberian lynx (Lynx pardinus) reconstructed using verified records". Journal of Mammalogy. 92 (5): 1081–1090. doi:10.1644/10-MAMM-A-381.1.
- ^ Sánchez, B. "Action plan for the Spanish imperial eagle (Aquila adalberti) in the European Union" (PDF). European Commission. Retrieved 14 August 2019.
- ^ Cadogan, S (23 March 2017). "How a thriving food industry faded away to nothing in the 1960s". The Irish Examiner. Cork. Retrieved 15 October 2017.
- ^ Peden, Robert (24 November 2008). "Rabbits - Biological control". Te Ara - the Encyclopedia of New Zealand. Retrieved 9 March 2021.
Myxomatosis (a viral disease of rabbits, caused by the myxoma virus) had been introduced to New Zealand in 1952, but failed to become established as there was no vector to spread it through the rabbit population.
- ^ Jaksic, F (1983). "Rabbit and Fox Introductions in Tierra del Fuego: History and Assessment of the Attempts at Biological Control of the Rabbit Infestation". Biological Conservation. 26 (4): 369–370. doi:10.1016/0006-3207(83)90097-6.
- ^ Bull, JJ; Lauring, AS; Condit, RC (2014). "Theory and Empiricism in Virulence Evolution". PLOS Pathogens. 10 (10): e1004387. doi:10.1371/journal.ppat.1004387. PMC 4207818. PMID 25340792.
- ^ Burgess, HM; Mohr, I (2016). "Evolutionary clash between myxoma virus and rabbit PKR in Australia". Proceedings of the National Academy of Sciences. 113 (15): 3912–3914. Bibcode:2016PNAS..113.3912B. doi:10.1073/pnas.1602063113. PMC 4839419. PMID 27035991.
- ^ Cassidy, A (2019). Vermin, Victims and Disease: British Debates Over Bovine Tuberculosis and Badgers. Springer Nature. p. 178. ISBN 9783030191863.
추가 읽기
- Deane, C.D. (1955). "Note on myxomatosis in hares". Bulletin of the Mammal Society of the British Isles. 3: 20. OCLC 1224626693.
- Fenner, Frank; Ratcliffe, F.N. (1965). Myxomatosis. Cambridge University Press. ISBN 978-0521049917.
외부 링크
| 위키미디어 커먼스는 Myxomatosis와 관련된 미디어를 가지고 있다. |