이중층(표면과학)
Double layer (surface science)
이중층(DL, 전기적 이중층이라고도 함, EDL)은 물체가 유체에 노출되었을 때 물체의 표면에 나타나는 구조다. 그 물체는 고체 입자, 기체 거품, 액체 방울 또는 다공성 몸일 수 있다. DL은 물체를 둘러싸고 있는 두 개의 병렬 전하층을 가리킨다. 첫 번째 층인 표면 전하(양전하 또는 음전하)는 화학적 상호작용 때문에 물체에 흡착된 이온으로 구성된다. 두 번째 층은 쿨롱 힘을 통해 표면 전하에 끌리는 이온으로 구성되어 있으며, 첫 번째 층을 전기적으로 선별한다. 이 두 번째 층은 물체와 느슨하게 연관되어 있다. 단단히 고정되기보다는 전기의 매력과 열운동의 영향을 받아 유체 안에서 움직이는 자유 이온으로 만들어진다. 그래서 "diffuse layer"라고 불린다.
계면 DL은 마이크로미터에서 나노미터까지의 눈금에 입자나 모공을 가진 콜로이드나 다공성 몸체와 같이 표면적 대 부피 비율이 큰 시스템에서 가장 잘 나타난다. 그러나 DL은 전극의 전기화학적 거동과 같은 다른 현상에 중요하다.
DL은 많은 일상 물질에서 근본적인 역할을 한다. 예를 들어, 균질화된 우유는 지방 방울이 버터로 응고되는 것을 방지하는 DL로 덮여 있기 때문에 존재한다. DL은 혈액, 페인트, 잉크, 세라믹 및 시멘트 슬러리와 같은 사실상 모든 이기종 유체 기반 시스템에 존재한다.
DL은 전기 운동 현상과 전기 음향 현상과 밀접하게 관련되어 있다.
(중간) 복층 개발
헬름홀츠
전자 도체가 고체 또는 액체 이온 도체(전극)와 접촉하면 두 단계 사이의 공통 경계(인터페이스)가 나타난다. 헤르만 폰 헬름홀츠는[1] 전해액 용액에 담근 전하 전극이 전하의 공이온을 밀어내면서 표면에 반항을 유도한다는 사실을 최초로 깨달았다. 전극과 전해질 사이의 인터페이스에서 반대 극성의 두 층이 형성된다. 1853년에 그는 전기 이중층(DL)이 본질적으로 분자 유전체라는 것을 보여주었고 정전기적으로 전하를 저장한다.[2] 전해질의 분해 전압 이하에서는 저장된 전하가 인가 전압에 따라 선형적으로 달라진다.
이 초기 모델은 전해질 용매의 유전체 상수와 이중 레이어의 두께에 따라 전하 밀도와 독립적인 일정한 차동 캐패시턴스를 예측했다.[3][4][5]
인터페이스 설명에 대한 좋은 기초를 가진 이 모델은 용액 내 이온의 확산/믹스화, 표면으로의 흡착 가능성, 용제 쌍극자 모멘트와 전극 사이의 상호작용을 포함한 중요한 요인을 고려하지 않는다.
구이-합만
1910년 루이스 조르주 구이와 1913년 데이비드 레너드 채프먼은 모두 정전용량이 상수가 아니며 적용된 전위와 이온 농도에 의존한다고 관찰했다. "구이-샤프만 모델"은 DL의 확산 모델을 도입하여 상당한 개선을 이루었으며, 이 모델에서는 금속 표면으로부터의 거리 함수로 이온의 전하 분배가 맥스웰-볼츠만 통계를 적용할 수 있도록 하였다. 따라서 전위는 유체 덩어리의 표면에서 떨어져서 기하급수적으로 감소한다.[3][6]
선미
Gouy-Chapman 모델은 고화질 DL에 대해 실패한다. 1924년 오토 스턴은 헬름홀츠 모델과 구이-캡만 모델을 결합할 것을 제안했다: 스턴의 모델에서는 일부 이온이 헬름홀츠가 제안한 대로 전극에 들러붙어 내부 스턴 층을 주는 반면, 어떤 이온은 구이-캡만 확산 층을 형성한다.[7]
Stern 층은 이온의 유한 크기를 설명하며, 결과적으로 이온의 전극에 가장 가까운 접근은 이온 반경의 순서에 있다. 스턴 모델은 이온을 점 전하를 효과적으로 취급하고 확산층의 모든 유의미한 상호작용을 쿨롬빅으로 가정하며, 유전적 허용률을 이중층 전체에 걸쳐 일정하게 가정하며, 유체 점도가 일정한 평면이라는 자체 한계를 가지고 있다.[8]
그라함
D. C. 그라함은 1947년에 스턴 모델을 개조했다.[9] 그는 비록 전극에 가장 가까운 접근은 일반적으로 용제 분자가 차지하고 있지만, 일부 이온성 또는 충전되지 않은 종은 스턴 층을 관통할 수 있다고 제안했다. 이는 이온이 전극에 접근하면서 용해 껍질이 유실될 경우 발생할 수 있다. 그는 전극과 직접 접촉하는 이온을 "특이적으로 흡착된 이온"이라고 불렀다. 이 모델은 3개 지역의 존재를 제안했다. 내부 헬름홀츠 평면(IHP)은 특별히 흡착된 이온의 중심을 통과한다. 외부 헬름홀츠 평면(OHP)은 용해된 이온의 중심을 전극에 가장 가깝게 접근한 거리에서 통과한다.[10] 마지막으로 확산 층은 OHP를 벗어난 지역이다.
보크리스/데바나단/뮬런(BDM)
1963년 J. O'M. Bockris, M. A. V. Devanathan, 클라우스[11] 뮐러는 인터페이스에 용제의 작용을 포함하는 이중 레이어의 BDM 모델을 제안했다. 그들은 물과 같은 용제의 부착된 분자가 전극 표면에 고정된 정렬을 가질 것을 제안했다. 이 용제 분자의 첫 번째 층은 전하에 따라 전기장에 강한 방향을 나타낸다. 이 방향은 자기장 강도에 따라 변하는 용매의 허용성에 큰 영향을 미친다. IHP는 이들 분자의 중심을 통과한다. 특히 흡착된 부분 용융 이온은 이 층에 나타난다. 전해질의 용해된 이온은 IHP 외부에 있다. 이온의 중심을 통해 OHP를 통과한다. 확산층은 OHP를 벗어난 지역이다.
트라사티/부잔카
1971년 세르히오 트라사티와 조반니 부즈칸카에 의해 이산화 루테늄 필름에 이중 층을 가진 추가 연구는 특정 흡착 이온을 가진 저전압에서 이들 전극의 전기화학적 거동이 콘덴서와 같다는 것을 보여주었다. 이 전위 영역에서 이온의 특정 흡착은 또한 이온과 전극 사이의 부분 전하 전달을 수반할 수 있다. 그것은 유사성을 이해하기 위한 첫걸음이었다.[4]
콘웨이
1975년과 1980년 사이에 브라이언 에반스 콘웨이는 루테늄 산화물 전기화학 콘덴서에 대한 광범위한 기초 및 개발 연구를 수행했다. 1991년에 그는 전기화학 에너지 저장에서 '슈퍼캐패시터'와 '배터리' 행동의 차이를 설명했다. 1999년에 그는 슈퍼캐패시터라는 용어를 만들어 전극과 이온 사이의 전하를 이용한 전극과 이온 사이의 전극 전하를 이용한 표면 리독스 반응에 의한 캐패시턴스의 증가를 설명하였다.[12][13]
그의 "슈퍼캐패시터"는 부분적으로 전하를 헬름홀츠 2중층에 저장했으며, 전극과 전해질 사이의 전자와 양성자의 "사극성" 전하 전달에 대한 패러다틱 반응의 결과 부분적으로 전하를 저장했다. 유사포착제의 작용 메커니즘은 리독스 반응, 상호교정 및 전기회절이다.
마르쿠스
전자 전하 전달의 물리적, 수학적 기초는 화학적 결합이 없어 가성파시턴스로 이어지는 것으로 루돌프 A가 개발했다. 마커스 마르쿠스 이론은 전자 전달 반응의 비율, 즉 한 화학 종에서 다른 종으로 전자가 이동할 수 있는 비율에 대해 설명한다. 원래는 두 화학종이 전하에서만 변하는 외부구 전자전달반응을 전자점프로 다루기 위해 만들어졌다. 결합을 만들거나 끊지 않는 리독스 반응에 대해, 마르쿠스 이론은 구조 변화에 대한 반응을 위해 도출된 헨리 에이링의 전환 상태 이론을 대신한다. 마커스는 이 이론으로 1992년에 노벨 화학상을 받았다.[14]
수학적 설명
콜로이드와 인터페이스 과학과[15][16][17] 마이크로스케일 유체 운송에 관한 많은 저서에서 인터페이스 DL에 대한 자세한 설명이 있다.[18][19] 또한 계면 이중층 및 관련 전기동학적 현상을 주제로 한 최근의 IUPAC 기술 보고서가 있다[20].
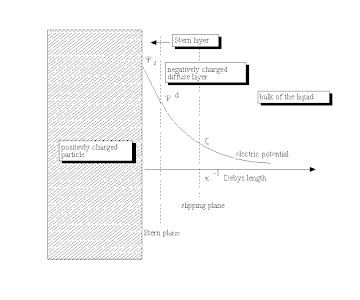
리클마(Lyklema)에서 말한 바와 같이 "안정" ("평형") 이중층이 형성되는 이유는 표면에 대한 전하 결정 이온의 비전기 친화성 때문..."[21] 이 과정은 보통 C/m으로2 표현되는 전기 표면 전하의 축적을 이끈다. 이 표면 전하를 통해 정전기장이 생성되어 액체의 대부분을 차지하는 이온에 영향을 미친다. 이 정전기장은 이온의 열 운동과 결합하여 역전하를 만들어 전기 표면전하를 차단한다. 이 선별 확산 층의 순전력은 순 표면 전하와 크기가 동일하지만 극성은 반대다. 그 결과, 전체 구조물은 전기적으로 중립적이다.
확산층 또는 그 중 적어도 일부는 접선 스트레스의 영향을 받아 움직일 수 있다. 표면에 부착된 유체와 이동식 유체를 분리하는 미끄러짐 평면이 전통적으로 도입된다. 이 평면의 전위를 전기전위 또는 제타전위(전위전위라고도 함)[22][23]라고 한다.
Stern 층의 외부 경계에서 전위 대 벌크 전해액에 대한 전위를 Stern 전위라고 한다. 유체 덩어리와 표면 사이의 전위차를 전기 표면 전위차라고 한다.
일반적으로 제타 전위는 DL 충전 정도를 추정하는데 사용된다. DL에서 이 전위의 특성 값은 25mV이며 최대값은 약 100mV(전극의[19][24] 경우 최대 몇 볼트)이다. ζ-전위가 0인 표본의 화학적 조성을 0 전하점 또는 등전점이라고 한다. 양자와 히드록실 이온은 대부분의 표면에서 전하 결정 이온이기 때문에 일반적으로 용액 pH 값에 의해 결정된다.[19][21]
제타 전위는 전기영동, 전기음향 현상, 스트리밍 전위, 전기전자 흐름을 사용하여 측정할 수 있다.
DL의 특징적인 두께는 데비 길이 ,이다−1. 이온 농도 C의 제곱근에 역비례한다. 수용액에서 그것은 일반적으로 몇 나노미터의 척도로 되어 있고, 전해질의 농도가 증가함에 따라 두께가 감소한다.
DL 내부의 전기장 강도는 0에서 10V9/m 이상일 수 있다. 이러한 가파른 전기적 잠재적 구배는 DL이 중요한 이유다.
평탄한 표면과 대칭적인 전해질[21] 이론은 보통 구이-갑만 이론이라고 한다. 확산층 σ에서d 전하와 Stern probled potentiald 사이에서 간단한 관계를 산출한다.[25]
혼합 전해질, 곡면 또는 심지어 구면 입자에 대한 일반적인 분석 용액은 없다. 저전하 DL을 가진 구형 입자에 대한 점증적 용액이 있다. DL에 대한 전위가 25mV 미만인 경우, 이른바 데비-후켈 근사치가 유지된다. 입자 중심으로부터의 거리 r의 함수로서 구형 DL의 전위 potential에 대해 다음과 같은 식을 산출한다.
계면 DL과 관련된 이론적 발전에 중요한 역할을 하는 몇 가지 점증적 모델이 있다.
첫번째는 "씬 DL"이다. 이 모델은 DL이 콜로이드 입자나 모세혈관 반지름보다 훨씬 얇다고 가정한다. 이것은 다음과 같이 데비 길이와 입자 반경의 값을 제한한다.
이 모델은 많은 후속 애플리케이션에 대해 엄청난 단순화를 제공한다. 전기영양론은 단지 하나의 예일 뿐이다.[26] 전기음향현상설도 또 다른 예다.[27]
얇은 DL 모델은 대부분의 수성 시스템에 유효하다. 왜냐하면 데비 길이도 그러한 경우 몇 나노미터밖에 되지 않기 때문이다. 물에 가까운 이온 강도를 가진 용액의 나노콜로이드에 대해서만 분해된다.
반대편 "thick DL" 모델은 Debye 길이가 입자 반지름보다 크다고 가정한다.
이 모델은 데비예 길이가 훨씬 큰 일부 나노 콜로이드와 비극성 액체에 유용할 수 있다.
마지막 모델은 "오버랩된 DL"을 도입한다.[27] 이것은 입자 사이의 거리가 데비 길이와 유사하게 될 때 집중 분산과 유화에서 중요하다.
전기 이중층
전기적 이중층(EDL)은 표면 근처의 전위 변동의 결과로서, 용액이나 고체 상태의 고속 이온 도체와 접촉하는 콜로이드 및 기타 표면의 거동에 상당한 영향을 미친다.
전극의 이중층과 인터페이스의 1차적 차이는 표면 전하 형성 메커니즘이다. 전극으로 외부 전위를 가하여 표면 전하를 조절할 수 있다. 그러나 콜로이드와 다공성 이중층에서는 이 적용이 불가능한데, 콜로이드 입자의 경우 전위차를 적용하기 위해 입자의 내부에 접근할 수 없기 때문이다.
차동 캐패시턴스
EDL에는 특성화를 정의하는 추가 매개변수인 차동 캐패시턴스가 있다. C로 표시된 차동 캐패시턴스는 아래 방정식으로 설명된다.
전기이중층에서의 전자전달
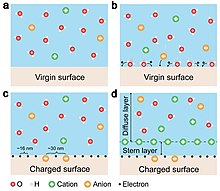
전기적 이중층(EDL)의 형성은 전통적으로 이온 흡착과 재분배에 의해 완전히 지배된다고 가정되어 왔다. 고형질 간 접촉전선이 전자전달에 의해 지배된다는 점을 감안하여 EDL은 2단계 공정에 의해 형성된다는 것이 왕 교수의 제언이다.[28] 첫 번째 단계에서, 용액의 분자가 먼저 기존의 표면 전하가 없는 처녀 표면에 접근할 때, 용액의 원자/분자가 고체 표면의 원자와 직접 상호작용하여 전자 구름의 강한 중첩을 형성할 가능성이 있다. 전자 전이가 먼저 일어나 고체 표면의 "중립" 원자를 전하가 되게 한다. 즉, 이온의 형성을 말한다. 두 번째 단계에서, 만약 H+와 OH-와 같이 액체에 이온이 존재한다면, 용액의 느슨하게 분포된 음이온이 정전기 상호작용에 의해 표면 결합 이온 쪽으로 이동하도록 유인되어 EDL을 형성하게 될 것이다. 전자전달과 이온전달 모두 액체 고체 인터페이스에서 공존한다.[29]
참고 항목
| Wikimedia Commons에는 Electrical double layer와 관련된 미디어가 있다. |
- 고갈 부위(반도체 접합부 구조)
- DLVO 이론
- 전기전자펌프
- 인터페이스와 콜로이드 과학
- 나노플루이드학
- 포아송-볼츠만 방정식
- 슈퍼캐패시터
참조
- ^ Helmholtz, H. (1853), "Ueber einige Gesetze der Vertheilung elektrischer Ströme in körperlichen Leitern mit Anwendung auf die thierisch-elektrischen Versuche", Annalen der Physik und Chemie (in German), vol. 165, no. 6, pp. 211–233, Bibcode:1853AnP...165..211H, doi:10.1002/andp.18531650603
- ^ "The electrical double layer". 2011. Archived from the original on 31 May 2011. Retrieved 23 April 2013.
- ^ a b Adam Marcus Namisnyk. "A survey of electrochemical supercapacitor technology" (PDF). Archived from the original (PDF) on 2014-12-22. Retrieved 2012-12-10.
- ^ a b Srinivasan S. (2006) 연료 전지, 기초부터 용도에 이르기까지, 스프링거 전자책, ISBN 978-0-387-35402-6, 제2장, 전극/전극 인터페이스: 전하 전달의 구조 및 동력학. (769 kB)
- ^ 탄소 나노튜브 전극 구조를 이용한 전기화학 2층 캐패시터.
- ^ Ehrenstein, Gerald (2001). "Surface charge" (PDF). Archived from the original (PDF) on 28 September 2011. Retrieved 30 May 2011.
- ^ Stern, O. (1924). "Zur Theorie der Elektrolytischen Doppelschicht". Zeitschrift für Elektrochemie. 30: 508. doi:10.1002/bbpc.192400182 (inactive 31 October 2021).
{{cite journal}}: CS1 maint : 2021년 10월 현재 DOI 비활성화(링크) - ^ SMIRNOV, Gerald (2011). "Electric Double Layer". Retrieved 23 April 2013.
- ^ Grahame, David C. (1947). "The Electrical Double Layer and the Theory of Electrocapillarity". Chemical Reviews. 41 (3): 441–501. doi:10.1021/cr60130a002. ISSN 0009-2665. PMID 18895519.
- ^ Nakamura, Masashi; Sato, Narumasa; Hoshi, Nagahiro; Sakata, Osami (2011). "Outer Helmholtz Plane of the Electrical Double Layer Formed at the Solid Electrode-Liquid Interface". ChemPhysChem. 12 (8): 1430–1434. doi:10.1002/cphc.201100011. ISSN 1439-4235. PMID 21557434.
- ^ J. O’m. Bockris; M. A. V. Devanathan; K. Müllen (1963). "On the structure of charged interfaces". Proceedings of the Royal Society of London. Series A. Mathematical and Physical Sciences. 274 (1356): 55–79. Bibcode:1963RSPSA.274...55B. doi:10.1098/rspa.1963.0114. ISSN 2053-9169. S2CID 94958336.
- ^ Conway, B.E. (May 1991), "Transition from 'Supercapacitor' to 'Battery' Behavior in Electrochemical Energy Storage", Journal of the Electrochemical Society (in German), vol. 138, no. 6, pp. 1539–1548, Bibcode:1991JElS..138.1539C, doi:10.1149/1.2085829
- ^ A.K. 슈클라, T.P. 쿠마르, 전기화학 백과사전, 현대 전기화학 백과사전: 2013년 8월 20일 웨이백머신 중앙전기화학연구소에 보관된 짧은 역사(2008년 11월)
- ^ 루돌프 A. 마커스: 1992년 노벨 화학상
- ^ 덕힌, S.S. & Derjaguin, B.V. "전동 현상", J.윌리와 선즈, 1974년
- ^ 러셀, W.B., 사빌, D.A. 및 W.R. "Colloidal Dispersions", 캠브리지 대학 출판부, 1989)
- ^ H.R. "콜로이드 사이언스", 엘스비에: 제1권, 되돌릴 수 없는 시스템, (1952)
- ^ Bruus, H. (2007). Theoretical Microfluidics.
- ^ a b c Kirby, B.J. (2010). Micro- and Nanoscale Fluid Mechanics: Transport in Microfluidic Devices. Cambridge University Press. ISBN 978-0-521-11903-0.
- ^ 국제 순수 및 응용 화학 연합 기술 보고서인 "전기 키네틱 현상의 측정 및 해석"은 순수 응용 분야로 출판되었다.Chem, vol 77, 10, pp.1753-1805, 2005(pdf)
- ^ a b c Lyklema, J. "인터페이스와 콜로이드 사이언스의 재무", vol.2, 페이지.3.208, 1995
- ^ Morrison, Ian D.; Ross, Sydney (2002). Colloidal dispersions : suspensions, emulsions, and foams (2nd ed.). New York, NY: Wiley. ISBN 978-0-471-17625-1.
- ^ Jiang, Jingkun; Oberdörster, Günter; Biswas, Pratim (25 June 2008). "Characterization of size, surface charge, and agglomeration state of nanoparticle dispersions for toxicological studies". Journal of Nanoparticle Research. 11 (1): 77–89. Bibcode:2009JNR....11...77J. doi:10.1007/s11051-008-9446-4. S2CID 95536100.
- ^ V.S. 보고츠키, 전기 화학의 기초, Wiley-Interscience, 2006.
- ^ Hanaor, D.A.H.; Ghadiri, M.; Chrzanowski, W.; Gan, Y. (2014). "Scalable Surface Area Characterization by Electrokinetic Analysis of Complex Anion Adsorption" (PDF). Langmuir. 30 (50): 15143–15152. arXiv:2106.03411. doi:10.1021/la503581e. PMID 25495551. S2CID 4697498.
- ^ 헌터, R.J. "콜로이드 사이언스 창립", 옥스퍼드 대학 출판부, 1989년
- ^ a b A. S.와 괴츠, P. J. 초음파, 엘스비어, 2017 ISBN 978-0-444-63908-0을 이용한 액체, 나노 및 미세 입자 및 다공성 신체의 특성
- ^ Wang, Z.L.; Wang, A.C. (2019). "On the origin of contact electrification". Materials Today. 30: 34. doi:10.1016/j.mattod.2019.05.016. S2CID 189987682.
- ^ Lin, S.Q.; Xu, L.; Wang, A.C.; Wang, Z.L. (2020). "Quantifying electron-transfer and ion-transfer in liquid-solid contact electrification and the formation mechanism of electric double-layer". Nature Communications. 11 (1): 399. doi:10.1038/s41467-019-14278-9. PMC 6972942. PMID 31964882.
추가 읽기
- Stillinger, Frank H.; Kirkwood, John G. (1960). "Theory of the Diffuse Double Layer". The Journal of Chemical Physics. 33 (5): 1282–1290. Bibcode:1960JChPh..33.1282S. doi:10.1063/1.1731401. ISSN 0021-9606.
- Paul C. Hiemenz (1986). Principles of Colloid and Surface Chemistry. M. Dekker. ISBN 978-0-8247-7476-9.
- Paul C. Hiemenz; Raj Rajagopalan (18 March 1997). Principles of Colloid and Surface Chemistry, Third Edition, Revised and Expanded. CRC Press. ISBN 978-0-8247-9397-5.