비리딘
Viridin | |
| 이름 | |
|---|---|
| 우선 IUPAC 이름 (1S,2S,11bR)-1-히드록시-2-메톡시-11b-메틸-1,7,8,11b-테트라히드로시클로펜타[7,8]페난트로[10,1-bc]프랑-3,6,9(2H)-트리온 | |
| 식별자 | |
3D 모델(JSmol) | |
| 첸블 | |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.019.989 |
| EC 번호 |
|
PubChem CID | |
| 유니 | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| C20H16O6 | |
| 몰 질량 | 352.337 g mol−1 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
Viridin은 [1]1945년에 처음 보고된 Gliocladium virens의 항진균 대사물입니다.플라노스테로이드로 알려진 분자의 종류에 속하며 스테로이드 골격의 C-4와 C-6 사이에 융합된 특징적인 고응력 친전자성 프랑환을 가지고 있다.보르트마닌을 포함한 이 과의 구성원은 포스포이노시티드 3-키나아제(PI3Ks)[2]의 강력하고 비가역적인 공유가 억제제인 것으로 알려져 있다.
생합성
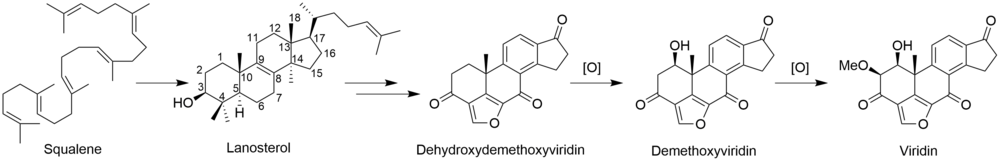
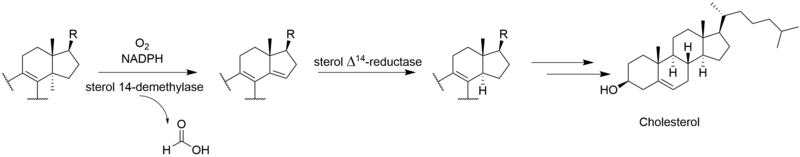
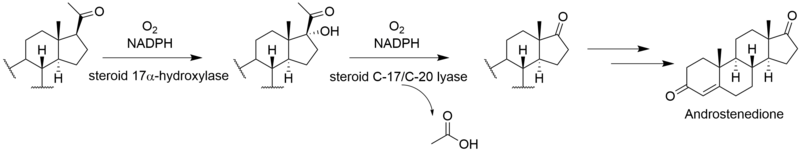
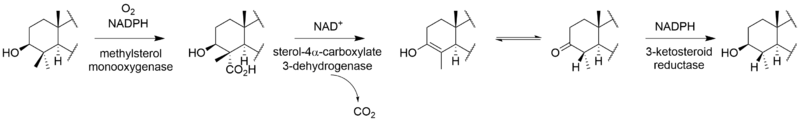
비리딘의 완전한 생합성은 알려지지 않았다.[2-C14]메발론산 라벨링 연구를 통해 비리딘은 디테르페노이드 [3]경로가 아닌 스쿠알렌에서 시작되는 트리테르페노이드 경로에서 생합성되는 것으로 나타났다.비리딘에 라노스테롤의 혼입이 [4]설명되었다.라노스테롤에서 비리딘에 이르는 나머지 단계의 메커니즘과 순서는 확실하지 않지만 푸란환의 형성, C-13 및 C-14 메틸기의 손실, C-링의 방향족화, 측쇄의 제거, A-링의 산화를 포함한다.이러한 단계 중 일부는 다른 스테로이드제의 경로와 유사할 수 있다.C-14 메틸기를 제거하는 동안 C-15로부터 수소 원자가 손실되는 것은 다른 스테로이드 [5]생합성체의 경로와 유사한 경로를 시사한다.C-14 메틸기는 콜레스테롤 경로와 마찬가지로 스테롤 14-데메틸라아제의 [6]작용에 의해 포름산으로서 소실된다.알도스테론의 경로에서 C-13 메틸기는 제거되지 않지만, 비리딘은 C-18에서 유사한 산화를 거쳐 포름산의 손실 또는 C-13 메틸을 제거하기 위한 탈카복실화를 겪을 수 있다.측쇄의 제거는 포유류의 [7]경로를 따르는 것으로 나타났다.안드로스테디온의 경로를 따르며 아세트산으로서의 측쇄를 산화적으로 제거하여 [6]D-링에 케톤을 생성한다.C-4에서 퓨란 고리의 "추가" 탄소는 메발론산의 3' 위치에서 유래하며 라노스테롤의 [5]C-4β-메틸기를 나타낸다.C-4α-메틸기의 산화 및 탈카복실화는 정상적인 포유류의 스테로이드 경로와 일치하지만, 다른 메틸기를 제거하기 위해 이러한 단계를 반복하는 대신, 제2산화메틸기가 미지의 메커니즘에 의해 차단되어 프랑환을 형성할 가능성이 있다.C-링의 방향족화는 골격 [5]재배열 없이 진행된다는 연구결과가 있다.
글리오클라듐 델리켄스에 의한 비리디올 생합성에서는 3β-OH 환원형 비리딘, 스쿠알렌, 라노스테롤, 데히드록시데톡시비리딘 및 데메톡시비리딘의 혼입이 [8][9]보고되었다.이는 C-1과 C-2에서의 근산소가 히드록실화를 수반하는 독립적 단계임을 시사한다.
레퍼런스
- ^ BRIAN, P. W.; MCGOWAN, J. G. (4 August 1945). "Viridin: a Highly Fungistatic Substance Produced by Trichoderma viride". Nature. 156 (3953): 144–145. Bibcode:1945Natur.156..144B. doi:10.1038/156144a0. S2CID 4077467.
- ^ Yano, H; Nakanishi, S; Kimura, K; Hanai, N; Saitoh, Y; Fukui, Y; Nonomura, Y; Matsuda, Y (Dec 5, 1993). "Inhibition of histamine secretion by wortmannin through the blockade of phosphatidylinositol 3-kinase in RBL-2H3 cells". The Journal of Biological Chemistry. 268 (34): 25846–56. doi:10.1016/S0021-9258(19)74466-4. PMID 7503989.
- ^ Blight, Margaret M.; Coppen, J. J. W.; Grove, John Frederick (1968). "The biogenesis, from mevalonic acid, of the steroidal antifungal metabolite viridin". Chemical Communications (London) (18): 1117. doi:10.1039/C19680001117.
- ^ Golder, Walter S.; Watson, Thomas R. (1980). "Lanosterol derivatives as precursors in the biosynthesis of viridin. Part 1". Journal of the Chemical Society, Perkin Transactions 1: 422. doi:10.1039/P19800000422.
- ^ a b c Hanson, James R.; O'Leary, Margaret A.; Wadsworth, Harry J. (1983). "Studies in terpenoid biosynthesis. Part 28. The acetate and mevalonate labelling patterns of the steroid, demethoxyviridin". Journal of the Chemical Society, Perkin Transactions 1: 867. doi:10.1039/P19830000867.
- ^ a b Dewick, Paul M. (2009). Medicinal natural products : a biosynthetic approach (3rd ed.). Chichester: A John Wiley & Sons. ISBN 978-0-470-74167-2.
- ^ Hanson, James R.; O'Leary, Margaret A.; Wadsworth, Harry J. (1980). "Fungal cleavage of the sterol side chain". Journal of the Chemical Society, Chemical Communications (18): 853. doi:10.1039/C39800000853.
- ^ Hanson, James R.; O'leary, Margaret A.; Wadsworth, Harry J.; boon, leng yeoh (1988). "The biosynthesis of the steroid, viridiol, by Gliocladium deliquescens". Phytochemistry. 27 (2): 387–389. doi:10.1016/0031-9422(88)83104-2.
- ^ Jones, Richard (1987). "Conversion of viridin to viridiol by viridin-producing fungi". Canadian Journal of Microbiology. 33 (11): 963–966. doi:10.1139/m87-169. PMID 3447692.