피신오르토바이러스
Piscine orthoreovirus| 피신오르토바이러스 | |
|---|---|
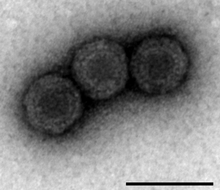 | |
| 투과전자현미경(Scale bar 100 nm)을 이용한 PRV-1 분석 | |
| 바이러스 분류 | |
| (순위 미지정): | 바이러스 |
| 영역: | 리보비리아 |
| 왕국: | 오르토나비라과 |
| 문: | 듀플로나비리코타 |
| 클래스: | 레소바이러스 |
| 주문: | 리바이랄레스 |
| 패밀리: | 레오바이러스과 |
| 속: | 오르토 바이러스 |
| 종류: | 피신오르토바이러스 |
피신 오르토 바이러스(PRV)는 어류만을 감염시키는 오르토 바이러스속 종으로, PRV는 2010년 심장과 골격근 염증(HSMI)을 보이는 양식 대서양 연어에서 처음 발견되어 다양한 질병을 [1]가진 어류에서 고농도로 검출되고 있다.이러한 질병에는 HSMI, 황달 증후군, 증식성 암화 증후군, 적혈구 체내 포섭 [1][2][3][4]증후군이 포함된다.PRV는 주로 양식 어류 및 양식 어류에 영향을 미치는 것으로 생각되며, 최근 연구는 야생 어류의 민감성에 초점을 맞추고 있다.그러나 PRV가 HSMI에 관해 독성이 있는지는 여전히 [5]논쟁의 주제이다.PRV는 주로 [1]HSMI를 나타내는 양식 대서양 연어와의 잠재적 연관성 때문에 대중의 주목을 받고 있다.오픈 오션넷 양식장의 PRV가 야생 연어 개체군에 전달되어 [6]개체수 감소의 요인이 될 가능성에 대한 대중의 우려가 제기되어 왔다.PRV는 야생 연어 재고에서 병원성이 있는 것으로 확인되지 않았다.
분류
PRV 게놈의 각 세그먼트에 대한 계통학적 분석은 알려진 리오바이러스에 [1]대한 배열과 구조적 유사성에 기초해 초기에 리오바이러스과(Reoviridae) 하위 패밀리인 스피나레오바이러스아과(Spinareovirinae)에 PRV를 배치했다.발견 시 계통발생학적 배열 분석 결과 PRV는 Orthore virus 및 Aquare [1]virus 속 바이러스와 동등하게 관련이 있는 것으로 나타났습니다.그 결과, PRV는 Spinareovirinae 아과에서 Orthore virus와 Aquare virus에 관련된 공통 조상과 별도로 진화한 것으로 추정되었다.
현재, PRV는 공식적으로 오르토 [7]바이러스로서 분류되고 있다.Orthore virus속으로의 배치는 다음과 같은 이유로 주장되어 왔다.
- 상동 시퀀스[8] 내에서의 높은 시퀀스 충실도
- 아쿠아레오바이러스의 11과 비교하여 10이라는 동일한 세그먼트 번호입니다.
- 아쿠아레오바이러스에 [9]거의 보편적으로 존재하는 단백질인 융해성 관련 소막 통과 단백질(FAST)의 결핍.이것은 또한 정형 바이러스가 감염된 세포들 사이에서 신세포 형성을 일으키지 않는다는 것을 의미한다.
- 섬유 바이러스 부착[10] 단백질 존재
- GC 뉴클레오시드 비율은 47%로 아쿠아레바이러스 범위(52~60%)[10]가 아닌 오르토레오바이러스 범위(44~48%)에 해당한다.
오르토 바이러스 배치에 대한 반대 주장입니다
- 다른 유일한 비퓨전성 오르토 바이러스 종은 포유류 오르토 바이러스(MRV)로 포유류 숙주만 가지고 있다.
- 많은 아쿠아레오바이러스가 물고기를 감염시키는 반면, PRV는 물고기를 [11][12]감염시키는 유일한 것으로 알려져 있다.
- PRV의 S1과 S4 시퀀스는 두[1] 속 모두에 대해 알려진 상동성이 없다.
- 거의 모든 정형외과 바이러스와 아쿠아레오바이러스는 바이러스 부착 단백질을 위한 바이시스트론인 반면 PRV는 단일istronic입니다.[13][10]
- PRV는 어느 한 [1]속에도 맞지 않는 세그먼트(segment)에 5' 말단 시퀀스를 나타냅니다.
- GCRV104와 GCRVGD108을 [14]포함하여 비퓨전성으로 식별된 아쿠아로바이러스 종이 있다.
- PRV의 외측 클램프 단백질은 폴리시스트론 세그먼트에서 [9]이 단백질을 코드하는 것으로 알려진 오르토바이러스 또는 아쿠아레오바이러스 중 첫 번째인 바이시스트론 세그먼트 S1에서 발견된다.
게놈 및 구조
게놈
피신 오르토 바이러스에는 10개의 개별 선형 세그먼트로 구성된 분할된 dsRNA 게놈이 있으며 누적 측정치는 약 23,[1][10]600bp이다.GC 함량은 47%입니다.각 세그먼트에는 보존된 단말 시퀀스가 있습니다.3' 말단 배열(UCAUC-3')은 오르토 바이러스 및 아쿠아레 바이러스와 동일하다.5' 엔드 시퀀스(5'-GAUAAA/U)는 PRV에 [1][11]고유합니다.Orthorevirus 및 Aquarevirus의 상동성 세그먼트와의 비교와 길이를 기준으로 L1-3(긴 길이), M1-3(중간), S1-4(짧은 길이)라고 한다.L1이 3916bp로 가장 길고 S4가 1040bp로 [1][10][8]가장 짧습니다.
11개의 단백질이 [10]암호화되어 있는 것이 확인되었다.S1은 2개의 열린 판독 프레임이 겹치는 이중성을 나타내며, 나머지 단백질은 단일 전자로 확인되거나 추가 [8][9][10]증거 없이 이중 전자로 생각되어 왔다.각 세그먼트가 코드하는 단백질은 레오바이러스 [10][13]속 전체에 걸쳐 표준화된 명명 시스템을 사용하여 다음과 같습니다.
- L1-33 - 쉘단백질(내부캡시드단백질)
- L2-δ2 - 터렛 단백질, 구아닐전달효소 및 메틸트란페라아제, 게놈 압출.[10]
- L3 - 1 1 : RdRP
- M1-μ2 - NTPase
- M2-μ1 - 외측캡시드단백질
- M3-μNS - 알려지지 않은 기능, 바이러스 공장 [15]형성에 도움이 된다고 가정함.
- S1-33 - 외부 클램프 단백질(캡시드 단백질) 및 p13 - 세포독성 비구조 단백질[16]
- S2-22 - 코어 클램프 단백질
- S3-δNS - 알 수 없는 기능, 비구조적.
- S4-11: 바이러스 부착[10] 단백질
소분할
피신 오르토레바이러스는 배열의 다양성에 근거해 복수의 다른 유전자형으로 분류되었다.PRV를 세분화하는 여러 방법이 [3]제안되었지만, 문헌에서 가장 자주 사용되는 시스템은 PRV를 Ia와 Ib, 그리고 [17][2][18][19]IIa와 IIb로 각각 더 세분화된 유전자형 I와 II로 세분한다.이러한 분할과 분할은 세그먼트 S1 [18][8]내의 시퀀스 다양성에 기초한다.
유전자형 I(PRV-1)
Ia
이 PRV의 아 유전자형은 주로 노르웨이, 칠레, 캐나다에서 양식된 대서양 연어에서 발견된다.황달증후군을 보이는 캐나다의 양식 치누크 연어, 칠레와 [20]캐나다의 양식 레인보우 트라우트, 코호에서 HSMI 유사 증상을 보이는 등 HSMI 개체군과 관련이 있다.
Ib
이 PRV의 아 유전자형은 주로 양식된 대서양 연어와 노르웨이와 칠레의 코호 연어에서 발견되며,[4] 추가로 양식된 칠레의 레인보우 송어에서 발견됩니다.HSMI를 가진 많은 연어에게 존재하며 황달증후군을 보이는 Coho 개체군에서도 발견되었습니다.
유전자형 II
유전자형 II는 칠레에서 양식된 대서양 연어의 S1 염기서열을 비교했을 때 처음 발견되었고, M2와 전체 [21][17]게놈 분석에서 더욱 반복되었다.하나의 유전자형 안에 있음에도 불구하고, 하위 유전자형 IIa와 IIb는 Ia와 Ib보다 훨씬 높은 배열 간 다양성을 보인다.
IIa(PRV-3)
PRV-3는 무지개 [22][17]송어의 병적인 심장 병변과 관련이 있다.북유럽과 [19]칠레에서 HSMI를 보이는 양식 코호 살몬, 갈색 송어, 레인보우 송어 등에서도 발견됐다.그것은 또한 [16]중앙유럽의 증식성 흑색증식증후군을 가진 야생 갈색 송어에서도 발견되었다.PRV-2와의 비교에서 뉴클레오티드와 아미노산은 각각 [23]80.1%, 90.5% 유사성을 보인다.PRV-1과의 비교 결과 뉴클레오티드 배열 유사성은 72.9%, 아미노산 배열 유사성은 80.0%로 나타났다.
IIb(PRV-2)
PVR-2는 적혈구 포섭체 증후군(EIBS)[2]을 보이는 일본 양식 코호 연어에서만 발견됐다.지금까지 PRV-2의 게놈은 1개뿐이어서 계통학적 위치에 [9]대한 신뢰도가 낮아졌다.PRV-1과 비교한 결과, 뉴클레오티드 배열과 아미노산 배열에서 [23]각각 73.4%, 80.3%의 유사성을 보였다.
구조.
오르토 바이러스속의 일원으로서, PRV의 비리온형은 외측과 코어, 2층의 비포장 20면체 캡시드이다.외부층을 둘러싼 전체 비리온의 지름은 약 70nm이며, 내부 코어층의 [24]지름은 약 39nm이다.
내부층은 껍질단백질 δ3과 내부클램프단백질 δ2로 구성되어 있으며, 이 내부클램프단백질은 20면체의 [25]구조적 안정화에 역할을 하는 것으로 생각된다.외층은 내측 Capsid를 안정화시키는 역할을 하는 것으로 생각되며 μ1(Outer Capsid 단백질)과 δ3(Outer Clamp 단백질)로 구성되어 있다.또한 외층은 바이러스 부착 및 숙주 진입을 매개하는 섬유단백질(θ1)을 가지고 있다.
PRV는 내부 캡시드 20면체의 [10][26]5배 축에 터렛 단백질(θ2)을 나타내는 터렛형 레오바이러스이다.MRV 및 ARV의 L2에 대한 상동 단백질은 구아닐전달효소 및 메틸전달효소 활성을 모두 가지고 있다.완전히 보존된 것은 아니지만 (λ2)의 활성 영역은 MRV 및 ARV 배열에 충실함을 나타내며, 이는 suggest2가 터렛 단백질이며 전사된 바이러스 mRNA의 5' 캡핑에서 유사한 역할을 한다는 것을 시사한다.
검출
PRV는 2010년 높은 처리량 DNA 염기서열 분석 및 생물정보학 접근방식을 통해 처음 확인되었으며, 이는 바이러스가 심장 및 골격근 염증(HSMI)의 영향을 받는 양식화된 대서양 연어에 존재한다고 판단했으며, PRV 확산 제어가 권고되었지만 PRV와 HSMI 사이의 인과 관계는 입증되지 않았다.t time (시간.[1]
2012년 노르웨이 해안의 몇몇 야생 어종이 PRV 양성 반응을 보였지만, 대부분의 샘플 테스트에서는 노르웨이 [27]해안에서 PRV의 낮은 유병률을 나타내는 음성 결과가 나왔다.
PRV 1a가 북대서양에서 북미 서해안으로 유입됐다는 추측이 제기돼 왔다.PRV 1a는 북태평양 및 북대서양 [21]소스로부터 칠레에 도입되었다.
분배
PRV는 영국, 아일랜드 및 노르웨이 대서양 연안뿐만 아니라 북미 및 남미 대서양 연안 및 태평양 연안 어업에서 PRV의 존재를 감지하는 다양한 연구로 거의 전 세계에 분포하는 것으로 밝혀졌다.PRV는 북쪽 알래스카와 남쪽 [8][21][28]칠레까지 태평양 양식과 야생 어종에서 검출되었다.
PRV-1은 양식 연어보다 야생 연어에게 덜 흔하며, 야생 송어는 PRV-3 감염을 보이는 경향이 있지만, 야생 대서양 연어 [21]개체군에게는 같은 말을 할 수 없습니다.
호스트와의 상호 작용
감염 역학
PRV 감염의 역학은 세 가지 단계로 구분된다.
- 초기 숙주 진입, 숙주 인식 없는 초기 복제 및 혈액 세포에 바이러스의 조직적 전파가 발생합니다.
- 그 후 전신 복제 피크, 부하 의존 숙주 인식 및 세포질 바이러스 포접[30] 형성이 일어난다.
- 제한된 복제와 함께 장기간 높은 부하 바이러스 지속성이 발생하며, 경미한 심장 염증이 발생할 수 있습니다.
- 이 지속 기간은 호스트 및/또는 PRV 유전자형에 따라 달라집니다.PRV의 전신 숙주 인식은 거의 일어나지 않으며 적혈구 내의 바이러스 포함물은 사라진다.이 말기 감염 단계에서 감염된 적혈구의 세포질에는 아직 적당한 양의 감염성 PRV가 존재하지만 감소 또는 비증식 상태에 있다.바이러스의 유출은 미미하며 시간이 [29][21][32]지남에 따라 완전히 멈출 수 있다.
- 심장 염증은 바이러스 부하가 최고조에 이른 직후 또는 감염 피크 중에 발생할 수 있습니다.많은 요인에 따라, 이 염증은 몇 달 동안 지속될 수 있지만, PRV 감염이 [21]남아 있더라도 사라질 수 있다.
PRV 감염의 가능한 결과를 결정하는 데는 복잡성이 있다.각각의 유전자형은 순환기 질환으로 이어지는 것으로 나타났지만, 고부하 PRV 감염은 질병이 없는 연어와 [21]송어에서도 발생했다.
질병
PRV 및 HSMI
노르웨이 PRV 변종이 HSMI의 발생을 초래했지만, HSMI가 [24][33]없는 것처럼 보이는 데도 불구하고 다양한 연어와 송어가 PRV 감염을 감지하는 것이 발견되었기 때문에 HSMI가 북미 PRV 변종에 감염되어 발병하는지는 불확실하다.
노르웨이 연구는 HSMI를 보이는 물고기의 조직을 건강한 물고기에 주입하는 것이 HSMI로 이어진다는 것을 보여주었지만,[34] 이 인과 관계를 캐나다 서해안에서 발견된 PRV 변이체에서는 증명하기가 더 어려워 보인다.지금까지 노르웨이에서는 대서양 연어만이 원인이 입증됐고 다른 사례에서는 질병과의 상관관계가 밝혀졌지만 아직 원인은 [33]입증되지 않았다.코호, 치누크, 소키예 등 브리티시컬럼비아산 야생연어는 PRV에 감염되기 쉽고 양식된 대서양산 연어와 유사한 바이러스 부하를 보이지만 HSMI [35]증상을 보이는 것으로 보고되지는 않았다.
질병 예방
HSMI는 노르웨이의 대서양 연어 양식업에서 가장 중요한 질병 중 하나이다.이 질병을 완화하기 위한 노력으로, 비활성화된 바이러스 입자를 사용하여 PRV-1을 목표로 하는 백신과 PRV에서 파생된 배열로 단백질을 코드하는 DNA를 개발하려는 시도가 있었다. 두 치료법 모두 PRV에 의한 감염을 막지는 못했지만 HSMI의 효과는 두 치료법 모두 감소하였다.HSMI의 중증도를 낮추기 위해 다양한 식이 제제가 시도되었고,[21] 내성을 주는 유전자 변형을 가진 물고기를 선택하기 위한 노력이 이루어졌다.
한 가지 질병 예방 방법은 양식장에 도입하기 전에 어란 표면을 소독하는 것일 수 있습니다.어란 후 제한 시스템에서 PRV를 제거하기 위해서는 엄격한 소독, 숙주 없는 시스템 유지 및 철저한 정기 [21]테스트가 필요하기 때문입니다.
양식업의 보급
PRV는 유럽 및 아메리카 대륙에서 가장 널리 사용되고 있으며 아시아에서는 상대적으로 보고가 적은 것으로 나타났습니다.PRV의 유병률은 지역과 숙주종에 따라 크게 다르다.PRV 감시는 북미와[21] 노르웨이에서 가장 크게 이루어집니다.
유럽:
PRV-1은 대략 1988년부터 노르웨이에서 양식된 대서양 연어에 존재해 왔다. 나머지 유럽 국가에서는 PRV가 일반적인 것으로 의심되지만 일부 국가의 보고는 여전히 제한적이다.아이슬란드는 대서양 연어에서 높은 PRV-1 유병률을 발견했다고 보고했다.2018년에 덴마크와 [21]독일의 브라운 트라우트와 레인보우 트라우트 양식장에서 PRV-3가 보고되었다.
북미:
PRV는 북미에서 높은 감염성을 보이는 것으로 보이며, 한 마리의 감염된 물고기가 종종 양식장 전체로 감염된다.PRV-1은 해수에서 양식된 연어가 돌아온 후 초기에 검출되는 경향이 있다.PRV-1은 북미에서 수십 년 또는 그 [21]이상 존재했을 가능성이 있습니다.
남미:
칠레에서는 양식된 대서양 연어가 PRV-1 감염률이 높은 반면 야생어 개체군은 감염률이 낮습니다.무지개 송어는 PRV-1에 [21]감염되는 비율이 높다.
아시아:
아시아에서 PRV-2는 일본에서만 발견되며, 양식된 코호 [21]살몬의 적혈구 포섭체 증후군(EIBS)과 관련이 있다.
호스트 범위
PRV는 다음과 [33]같은 다양한 수생/야생 숙주 종에서 발견되었습니다.
- 송어(Ocorhynchus clarkii)
- 치누크살몬(온코린쿠스차)
- 소키에 연어 (온코린쿠스 네르카)
- 레인보우 트라우트(온코린쿠스 마이키스
- 코호살몬 (온코린쿠스 키서치)
- 참살몬(온코린쿠스케타)
- 핑크살몬 (온코린쿠스 고르부스카)
- 대서양 연어(살모살라)
- Sea-Trout (살모 트루타)
- 그레이트 실버 빙어 (아르헨티나 실러스)
- 대서양 전갱이(Trachurus trachurus)
- 대서양청어(Clupea harengus)
- 카펠린 (말로투스 빌로수스)
레퍼런스
- ^ a b c d e f g h i j k Palacios G, Lovoll M, Tengs T, Hornig M, Hutchison S, Hui J, et al. (July 2010). "Heart and skeletal muscle inflammation of farmed salmon is associated with infection with a novel reovirus". PLOS ONE. 5 (7): e11487. doi:10.1371/journal.pone.0011487. PMC 2901333. PMID 20634888.
- ^ a b c Takano T, Nawata A, Sakai T, Matsuyama T, Ito T, Kurita J, et al. (2016-10-27). "Full-Genome Sequencing and Confirmation of the Causative Agent of Erythrocytic Inclusion Body Syndrome in Coho Salmon Identifies a New Type of Piscine Orthoreovirus". PLOS ONE. 11 (10): e0165424. doi:10.1371/journal.pone.0165424. PMC 5082797. PMID 27788206.
- ^ a b Garseth ÅH, Ekrem T, Biering E (2013-12-11). "Phylogenetic evidence of long distance dispersal and transmission of piscine reovirus (PRV) between farmed and wild Atlantic salmon". PLOS ONE. 8 (12): e82202. doi:10.1371/journal.pone.0082202. PMC 3859594. PMID 24349221.
- ^ a b Cartagena J, Jiménez C, Spencer E (November 2020). "Detection of Piscine orthoreoviruses (PRV-1b AND PRV-3a) in farmed Coho salmon with jaundice syndrome from Chile". Aquaculture. 528: 735480. doi:10.1016/j.aquaculture.2020.735480. ISSN 0044-8486.
- ^ Zhang Y, Polinski MP, Morrison PR, Brauner CJ, Farrell AP, Garver KA (2019). "High-Load Reovirus Infections Do Not Imply Physiological Impairment in Salmon". Frontiers in Physiology. 10: 114. doi:10.3389/fphys.2019.00114. PMC 6425399. PMID 30930782.
- ^ Noakes DJ, Beamish RJ, Kent ML (March 2000). "On the decline of Pacific salmon and speculative links to salmon farming in British Columbia". Aquaculture. 183 (3–4): 363–386. doi:10.1016/s0044-8486(99)00294-x. ISSN 0044-8486.
- ^ "ICTV". talk.ictvonline.org. Retrieved 2021-03-16.
- ^ a b c d e f Kibenge MJ, Iwamoto T, Wang Y, Morton A, Godoy MG, Kibenge FS (July 2013). "Whole-genome analysis of piscine reovirus (PRV) shows PRV represents a new genus in family Reoviridae and its genome segment S1 sequences group it into two separate sub-genotypes". Virology Journal. 10 (1): 230. doi:10.1186/1743-422X-10-230. PMC 3711887. PMID 23844948.
- ^ a b c d Key T, Read J, Nibert ML, Duncan R (May 2013). "Piscine reovirus encodes a cytotoxic, non-fusogenic, integral membrane protein and previously unrecognized virion outer-capsid proteins". The Journal of General Virology. 94 (Pt 5): 1039–1050. doi:10.1099/vir.0.048637-0. PMID 23343626.
- ^ a b c d e f g h i j k Markussen T, Dahle MK, Tengs T, Løvoll M, Finstad ØW, Wiik-Nielsen CR, et al. (2013-07-29). "Sequence analysis of the genome of piscine orthoreovirus (PRV) associated with heart and skeletal muscle inflammation (HSMI) in Atlantic salmon (Salmo salar)". PLOS ONE. 8 (7): e70075. doi:10.1371/journal.pone.0070075. PMC 3726481. PMID 23922911.
- ^ a b Attoui H, Fang Q, Jaafar FM, Cantaloube JF, Biagini P, de Micco P, de Lamballerie X (August 2002). "Common evolutionary origin of aquareoviruses and orthoreoviruses revealed by genome characterization of Golden shiner reovirus, Grass carp reovirus, Striped bass reovirus and golden ide reovirus (genus Aquareovirus, family Reoviridae)". The Journal of General Virology. 83 (Pt 8): 1941–1951. doi:10.1099/0022-1317-83-8-1941. PMID 12124458.
- ^ Duncan R (August 1999). "Extensive sequence divergence and phylogenetic relationships between the fusogenic and nonfusogenic orthoreoviruses: a species proposal". Virology. 260 (2): 316–28. doi:10.1006/viro.1999.9832. PMID 10417266.
- ^ a b Yan X, Parent KN, Goodman RP, Tang J, Shou J, Nibert ML, et al. (August 2011). "Virion structure of baboon reovirus, a fusogenic orthoreovirus that lacks an adhesion fiber". Journal of Virology. 85 (15): 7483–95. doi:10.1128/JVI.00729-11. PMC 3147939. PMID 21593159.
- ^ Nibert ML, Duncan R (2013-07-04). "Bioinformatics of recent aqua- and orthoreovirus isolates from fish: evolutionary gain or loss of FAST and fiber proteins and taxonomic implications". PLOS ONE. 8 (7): e68607. doi:10.1371/journal.pone.0068607. PMC 3701659. PMID 23861926.
- ^ Haatveit HM, Nyman IB, Markussen T, Wessel Ø, Dahle MK, Rimstad E (January 2016). "The non-structural protein μNS of piscine orthoreovirus (PRV) forms viral factory-like structures". Veterinary Research. 47 (1): 5. doi:10.1186/s13567-015-0302-0. PMC 4705589. PMID 26743679.
- ^ a b Kuehn R, Stoeckle BC, Young M, Popp L, Taeubert JE, Pfaffl MW, Geist J (2018-10-22). "Identification of a piscine reovirus-related pathogen in proliferative darkening syndrome (PDS) infected brown trout (Salmo trutta fario) using a next-generation technology detection pipeline". PLOS ONE. 13 (10): e0206164. doi:10.1371/journal.pone.0206164. PMC 6197672. PMID 30346982.
- ^ a b c Godoy M, Medina DA, Suarez R, Valenzuela S, Romero J, Kibenge M, et al. (January 2021). "Extensive Phylogenetic Analysis of Piscine Orthoreovirus Genomic Sequences Shows the Robustness of Subgenotype Classification". Pathogens. 10 (1): 41. doi:10.3390/pathogens10010041. PMC 7825714. PMID 33430212.
- ^ a b c Godoy MG, Kibenge MJ, Wang Y, Suarez R, Leiva C, Vallejos F, Kibenge FS (June 2016). "First description of clinical presentation of piscine orthoreovirus (PRV) infections in salmonid aquaculture in Chile and identification of a second genotype (Genotype II) of PRV". Virology Journal. 13 (1): 98. doi:10.1186/s12985-016-0554-y. PMC 4906990. PMID 27296722.
- ^ a b Kibenge FS (February 2019). "Emerging viruses in aquaculture". Current Opinion in Virology. Emerging viruses: intraspecies transmission • Viral Immunology. 34: 97–103. doi:10.1016/j.coviro.2018.12.008. PMID 30711892.
- ^ Di Cicco E, Ferguson HW, Kaukinen KH, Schulze AD, Li S, Tabata A, et al. (2018-10-01). "The same strain of Piscine orthoreovirus (PRV-1) is involved in the development of different, but related, diseases in Atlantic and Pacific Salmon in British Columbia". FACETS. 3 (1): 599–641. doi:10.1139/facets-2018-0008. ISSN 2371-1671.
- ^ a b c d e f g h i j k l m n o Polinski MP, Vendramin N, Cuenca A, Garver KA (November 2020). "Piscine orthoreovirus: Biology and distribution in farmed and wild fish". Journal of Fish Diseases. 43 (11): 1331–1352. doi:10.1111/jfd.13228. PMID 32935367.
- ^ Vendramin N, Kannimuthu D, Olsen AB, Cuenca A, Teige LH, Wessel Ø, et al. (February 2019). "Piscine orthoreovirus subtype 3 (PRV-3) causes heart inflammation in rainbow trout (Oncorhynchus mykiss)". Veterinary Research. 50 (1): 14. doi:10.1186/s13567-019-0632-4. PMC 6380033. PMID 30777130.
- ^ a b Dhamotharan K, Vendramin N, Markussen T, Wessel Ø, Cuenca A, Nyman IB, et al. (April 2018). "Molecular and Antigenic Characterization of Piscine orthoreovirus (PRV) from Rainbow Trout (Oncorhynchus mykiss)". Viruses. 10 (4): 170. doi:10.3390/v10040170. PMC 5923464. PMID 29614838.
- ^ a b Wessel Ø, Braaen S, Alarcon M, Haatveit H, Roos N, Markussen T, et al. (2017-08-25). "Infection with purified Piscine orthoreovirus demonstrates a causal relationship with heart and skeletal muscle inflammation in Atlantic salmon". PLOS ONE. 12 (8): e0183781. doi:10.1371/journal.pone.0183781. PMC 5571969. PMID 28841684.
- ^ Zhou ZH, Zhang H, Jakana J, Lu XY, Zhang JQ (June 2003). "Cytoplasmic polyhedrosis virus structure at 8 A by electron cryomicroscopy: structural basis of capsid stability and mRNA processing regulation". Structure. 11 (6): 651–63. doi:10.1016/s0969-2126(03)00091-1. PMID 12791254.
- ^ Miyazaki N, Uehara-Ichiki T, Xing L, Bergman L, Higashiura A, Nakagawa A, et al. (November 2008). "Structural evolution of reoviridae revealed by oryzavirus in acquiring the second capsid shell". Journal of Virology. 82 (22): 11344–53. doi:10.1128/JVI.02375-07. PMC 2573255. PMID 18787002.
- ^ Wiik-Nielsen CR, Løvoll M, Sandlund N, Faller R, Wiik-Nielsen J, Bang Jensen B (January 2012). "First detection of piscine reovirus (PRV) in marine fish species". Diseases of Aquatic Organisms. 97 (3): 255–8. doi:10.3354/dao02425. PMID 22422096.
- ^ Siah A, Morrison DB, Fringuelli E, Savage P, Richmond Z, Johns R, et al. (2015-11-04). "Piscine Reovirus: Genomic and Molecular Phylogenetic Analysis from Farmed and Wild Salmonids Collected on the Canada/US Pacific Coast". PLOS ONE. 10 (11): e0141475. doi:10.1371/journal.pone.0141475. PMC 4633109. PMID 26536673.
- ^ a b c Polinski MP, Marty GD, Snyman HN, Garver KA (March 2019). "Piscine orthoreovirus demonstrates high infectivity but low virulence in Atlantic salmon of Pacific Canada". Scientific Reports. 9 (1): 3297. doi:10.1038/s41598-019-40025-7. PMC 6416343. PMID 30867461.
- ^ Wessel Ø, Olsen CM, Rimstad E, Dahle MK (March 2015). "Piscine orthoreovirus (PRV) replicates in Atlantic salmon (Salmo salar L.) erythrocytes ex vivo". Veterinary Research. 46 (1): 26. doi:10.1186/s13567-015-0154-7. PMC 4350956. PMID 25888832.
- ^ Haatveit HM, Wessel Ø, Markussen T, Lund M, Thiede B, Nyman IB, et al. (March 2017). "Viral Protein Kinetics of Piscine Orthoreovirus Infection in Atlantic Salmon Blood Cells". Viruses. 9 (3): 49. doi:10.3390/v9030049. PMC 5371804. PMID 28335455.
- ^ a b Garver KA, Johnson SC, Polinski MP, Bradshaw JC, Marty GD, Snyman HN, et al. (January 2016). "Piscine Orthoreovirus from Western North America Is Transmissible to Atlantic Salmon and Sockeye Salmon but Fails to Cause Heart and Skeletal Muscle Inflammation". PLOS ONE. 11 (1): e0146229. doi:10.1371/journal.pone.0146229. PMC 4701501. PMID 26730591.
- ^ a b c Government of Canada, Fisheries and Oceans Canada (2018-04-03). "Piscine Orthoreovirus (PRV) and Heart and Skeletal Muscle Inflammation (HSMI)". www.dfo-mpo.gc.ca. Retrieved 2021-03-13.
- ^ Garver, Kyle A.; Johnson, Stewart C.; Polinski, Mark P.; Bradshaw, Julia C.; Marty, Gary D.; Snyman, Heindrich N.; Morrison, Diane B.; Richard, Jon (2016-01-05). "Piscine Orthoreovirus from Western North America Is Transmissible to Atlantic Salmon and Sockeye Salmon but Fails to Cause Heart and Skeletal Muscle Inflammation". PLOS ONE. 11 (1): e0146229. doi:10.1371/journal.pone.0146229. ISSN 1932-6203. PMID 26730591.
- ^ Purcell, M K; Powers, R L; Evered, J; Kerwin, J; Meyers, T R; Stewart, B; Winton, J R (February 2018). "Molecular testing of adult Pacific salmon and trout ( Oncorhynchus spp.) for several RNA viruses demonstrates widespread distribution of piscine orthoreovirus in Alaska and Washington". Journal of Fish Diseases. 41 (2): 347–355. doi:10.1111/jfd.12740.






