막구 인신매매
Membrane vesicle trafficking진핵 동물 세포의 막 방광 밀거래는 골기 체내의 합성 포장 위치에서 분비 세포의 플라즈마 막 내부의 특정 방출 위치로 생화학적 신호 분자를 이동시키는 것을 포함한다.골지막 결합 마이크로 사이즈의 베시클, 일명 MV(Meminal Vesicle) 형태로 진행된다.null
이 과정에서, 포장된 세포 제품들은 혈장 막을 가로질러 세포 바깥에서 방출되거나 분비된다.반면에 배액막은 분비 세포에 의해 보존되고 재활용된다.이 현상은 시냅스 신경전달, 내분비분비, 점액분비, 중성미자에 의한 미세한 제품분비, 기타 현상에 큰 역할을 한다.이 발견의 배후에 있는 과학자들은 2013년 노벨상을 받았다.null
원핵, 그램 음성의 박테리아 세포에서 막막 거래는 박테리아 외막(OMV)이라고 불리는 박테리아 외막 경계가 있는 나노 크기의 소막을 통해 매개된다.그러나 이 경우 OMV 막은 분비 활성 박테리아 외부로 OMV 성분과 함께 분비된다.이 다른 현상은 호스트-병원성 상호작용, 환자의 내독성 쇼크, 동물이나 식물의 침입과 감염, 종간 박테리아 경쟁, 정족수 감지, 외세포증, 그 밖의 다른 영역에 큰 역할을 한다.null
진핵 세포 내의 운동
일단 소포가 소포체 내경에서 생산되고 골지체에서 변형되면 그들은 세포 내의 다양한 목적지로 이동한다.Vesicle은 먼저 골지체를 떠나 싹트기라고 하는 과정에서 세포질 속으로 방출된다.그리고 나서 Vesicle은 운동 단백질에 의해 목적지 쪽으로 이동된다.일단 vesicle이 목적지에 도착하면, 그것은 퓨전이라고 불리는 과정에서 바이립 층과 결합한 다음, 그것의 내용물을 방출한다.null
새싹
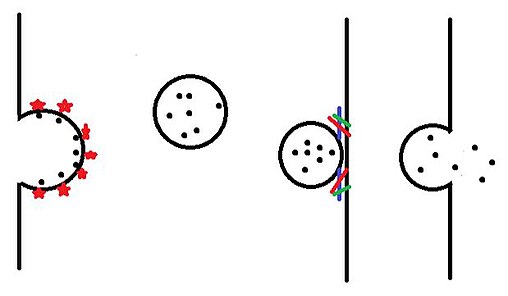
골지 본체의 막에 내장된 수용기는 특정 화물(도파민 등)을 방광의 내강 쪽에 묶는다.이 화물 수용체들은 다른 화물 수용체들과 clathrin, COPI, COPII와 같은 코팅 단백질들을 포함한 다양한 단백질을 모집한다.이러한 코팅 단백질들이 점점 더 많이 모이면, 그들은 베시클이 바깥쪽으로 싹을 틔우고 결국 세포질에 자유롭게 침입하게 된다.그리고 나서 코팅 단백질은 재활용되고 재사용되기 위해 세포질에 버려진다.[1]null
셀 구획간 운동성
세포 내의 서로 다른 구획들 사이의 이동을 위해, vesicle은 운동 단백질 myosin, kinesin (주로 terograde transport), dynein (주로 역행 운송)에 의존한다.운동 단백질의 한쪽 끝은 소두막에 부착되고 다른 쪽 끝은 미세관이나 마이크로필름에 부착된다.그리고 나서 운동 단백질은 ATP를 가수분해하여 움직인다. ATP는 vesicle을 목적지 쪽으로 밀어낸다.[2]null
도킹 및 퓨전
소변기가 의도된 위치에 가까워질 때, 소변 막의 RAB 단백질은 목적지에서의 도킹 단백질과 상호작용한다.이러한 도킹 단백질은 대상 막에서 발견된 DLOG 콤플렉스와 상호작용하기 위해 Vesicle을 더 가깝게 만든다.DRIG 콤플렉스는 배실막에서 발견된 시냅토브레빈과 반응한다.[3]이것은 대상 복합체의 막(또는 세포의 바깥쪽 막)에 방광막을 대고 두 개의 막이 융합되게 한다.소변과 대상 콤플렉스가 융합되는지 아니면 외부 막이 융합되는지에 따라 소변 내용물은 이후 대상 콤플렉스로 방출되거나 세포 외부로 방출된다.[4]null
eukaryotes의 예
- 세포내 밀거래는 골지 시스테르네와 같은 세포하 구획과 수용성 단백질을 MV로 운반하기 위한 다발성 내시경 사이에 발생한다.
- 혈장 막에서 직접 MV를 분비 세포 외부에 방출되는 미세 입자로 만드는 것.
- 엑소솜은 다발성 내시경처럼 내부 구획 안에서 형성될 수 있는 MV이다.엑소솜은 결국 세포의 플라즈마 막과 이 엔도솜의 융합으로 방출된다.
- 레트로바이러스와 같은 일부 바이러스에 의한 외부 기계의 납치, 여기서 바이러스는 다발성 내분체 안에서 싹이 트고 이후에 엑소좀으로 분비된다.
진핵 세포에서 일어나는 이러한 모든 형태의 세포막 염좌 밀거래는 도식적으로 설명되어 왔다.[5]null
원핵생물에서
진핵생물에서와 달리, 원핵생물의 세포막-구획화가 결여되어 있기 때문에 원핵생물의 세포막 내(quorum sensing)와 호스트-병원체 인터페이스에서의 종간신호화를 위한 쌍방향 생물학에서 막 염기 밀거래는 신흥 영역이다.세포 표면을 따라 생기는 박테리아 막의 소변 분포를 사람의 장에서 흔히 볼 수 있는 균등균인 살아있는 대장균에서 측정했다.항생제 처리는 베시클 역학, 베시클-메브레인 친화력, 세포막의 표면 특성을 변화시켰고, 일반적으로 박테리아 막의 표면을 따라 베시클 이동을 강화시켰으며, 그들의 운동 특성이 항생제 스트레스의 표식이 될 수 있음을 시사했다.[6]null
40년 이상 동안 그램 음성 미생물의 문화는 나노 크기의 막이 존재한다는 것을 밝혀냈다.1970년대 이후 전자현미경 검사로 진기발광판(gingival flack)에서 관찰된 병원성 과정에서 막구슬의 역할이 의심받고 있다.[7]이 염소는 숙주의 상피 세포 표면에 박테리아 유착을 촉진하는 것으로 의심되었다.[8]그리고 나서 그들의 체내 동물 숙주 세포의 침입에 대한 역할이 증명되었다.[9]박테리아 간 상호작용에서, Phyomonas Aeruginosa 미생물에 의해 방출된 OMV는 박테리아 분해를 유발하는 다른 그램의 음성 미생물의 외부 막과 융합하는 것으로 나타났다; 이러한 OMV는 그램 양성 미생물도 또한 분비할 수 있다.[10]인간의 위와 매우 유사한 모델로서 인간 1차 항상피세포의 헬리코박터 파일로리 감염에서 OMV의 역할은 또한 H. 실로리에 감염된 인간의 위 점막에서도 VacA 함유 OMV가 검출될 수 있다는 것이[11] 확인되었다.[12]살모넬라 OMV는 또한 1993년(ref 4) 이후, 방어 대식세포가 병원체 복제를 위한 서브서비스로 탈취되고 장티푸스 유사 동물 감염에서 감염된 대식세포의 결과적으로 사멸에 직접적인 역할을 하는 것으로 나타났다.[13]이러한 연구들은 OMV에 초점을 맞춘 막구밀매매를 유발했고, 유전자 변형, 정족수 감지, 미생물들 사이의 경쟁 무기 등, 그리고 동물 숙주의 침입, 감염, 면역 변조 등과 같은 다방면의 과정에 관여하는 이러한 현상을 보여주었다.[7]그램 음성 미생물에 의한 OMV 생성, 박테리아 세포 분비물 축적에 의한 페리플라즘(이름, periplasmic organells)의 포켓 확대, 거품관을 가진 '비포성 거품' 형성의 라인에서 외막 경계 vesicles(OMVs)으로 핀칭하는 메커니즘이 이미 제안되었다.호스트/대상 셀에 의한 확산 OMV의 융합 또는 흡수(그림 2).[14]null

결론적으로, 그람 음성 유기체의 OMV를 통한 방광 밀거래는 세포 대 세포 신호의 영역에서 식물 왕국을[15] 포함한 종과 왕국을 가로지른다.null
참고 항목
참조
- ^ Bonifacino, Juan (January 2004). "The Mechanisms of Vesicle Budding and Fusion". Cell. 116 (2): 153–166. doi:10.1016/S0092-8674(03)01079-1. PMID 14744428.
- ^ Hehnly H, Stamnes M (May 2007). "Regulating cytoskeleton-based vesicle motility". FEBS Letters. 581 (11): 2112–8. doi:10.1016/j.febslet.2007.01.094. PMC 1974873. PMID 17335816.
- ^ Nanavati C, Markin VS, Oberhauser AF, Fernandez JM (October 1992). "The exocytotic fusion pore modeled as a lipidic pore". Biophysical Journal. 63 (4): 1118–32. Bibcode:1992BpJ....63.1118N. doi:10.1016/S0006-3495(92)81679-X. PMC 1262250. PMID 1420930.
- ^ Papahadjopoulos D, Nir S, Düzgünes N (April 1990). "Molecular mechanisms of calcium-induced membrane fusion". Journal of Bioenergetics and Biomembranes. 22 (2): 157–79. doi:10.1007/BF00762944. PMID 2139437.
- ^ Théry C, Ostrowski M, Segura E (August 2009). "Membrane vesicles as conveyors of immune responses". Nature Reviews. Immunology. 9 (8): 581–93. doi:10.1038/nri2567. PMID 19498381.
- ^ Bos J, Cisneros LH, Mazel D (January 2021). "Real-time tracking of bacterial membrane vesicles reveals enhanced membrane traffic upon antibiotic exposure". Science Advances. 7 (4). doi:10.1126/sciadv.abd1033. PMC 7817102.
- ^ a b Ellis TN, Kuehn MJ (March 2010). "Virulence and immunomodulatory roles of bacterial outer membrane vesicles". Microbiology and Molecular Biology Reviews. 74 (1): 81–94. doi:10.1128/MMBR.00031-09. PMC 2832350. PMID 20197500.
- ^ Halhoul N, Colvin JR (February 1975). "The ultrastructure of bacterial plaque attached to the gingiva of man". Archives of Oral Biology. 20 (2): 115–8. doi:10.1016/0003-9969(75)90164-8. PMID 1054578.
- ^ YashRoy RC (1993). "Electron microscope studies of surface pili and vesicles of Salmonella 3,10:r:- organisms". Indian Journal of Animal Sciences. 63 (2): 99–102.
- ^ Kadurugamuwa JL, Beveridge TJ (May 1996). "Bacteriolytic effect of membrane vesicles from Pseudomonas aeruginosa on other bacteria including pathogens: conceptually new antibiotics". Journal of Bacteriology. 178 (10): 2767–74. doi:10.1128/jb.178.10.2767-2774.1996. PMC 178010. PMID 8631663.
- ^ Heczko U, Smith VC, Mark Meloche R, Buchan AM, Finlay BB (November 2000). "Characteristics of Helicobacter pylori attachment to human primary antral epithelial cells". Microbes and Infection. 2 (14): 1669–76. doi:10.1016/s1286-4579(00)01322-8. PMID 11137040.
- ^ Fiocca R, Necchi V, Sommi P, Ricci V, Telford J, Cover TL, Solcia E (June 1999). "Release of Helicobacter pylori vacuolating cytotoxin by both a specific secretion pathway and budding of outer membrane vesicles. Uptake of released toxin and vesicles by gastric epithelium". The Journal of Pathology. 188 (2): 220–6. doi:10.1002/(sici)1096-9896(199906)188:2<220::aid-path307>3.0.co;2-c. PMID 10398168.
- ^ Yashroy RC (2000). "Hijacking of macrophages by Salmonella (3,10:r:-) through 'type-III' secretion-like exocytotic signaling: a mechanism for infection of chicken ileum". Indian Journal of Poultry Science. 35 (3): 276–281.
- ^ YashRoy RC (June 2003). "Eucaryotic cell intoxication by gram-negative pathogens: a novel bacterial outermembrane-bound nanovesicular exocytosis model for type-III secretion system". Toxicology International. 10 (1): 1–9.
- ^ Bahar O, Pruitt R, Luu DD, Schwessinger B, Daudi A, Liu F, Ruan R, Fontaine-Bodin L, Koebnik R, Ronald P (2014). "The Xanthomonas Ax21 protein is processed by the general secretory system and is secreted in association with outer membrane vesicles". PeerJ. 2: e242. doi:10.7717/peerj.242. PMC 3897388. PMID 24482761.