유럽제약산업협회
European Federation of Pharmaceutical Industries and Associations유럽제약산업협회(EFPIA)는 브뤼셀에 본부를 둔 무역협회 및 로비단체로 1978년에 설립되어 유럽에서 활동하고 있는 연구기반 제약산업을 대표한다.
36개 국가협회와 39개 주요 제약회사들의 회원 가입을 통해 EFPIA는 새로운 치료법을 연구, 개발, 제조하는 분야에서 1,900개의 EU 기업을 대표하고 있다.
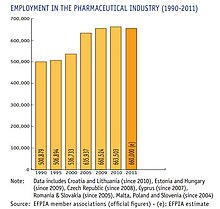
유럽위원회(Eurostat)가 2008년 발표한 수치를 보면 제약산업이 연구개발(R&D)에 가장 많이 투자하는 산업 분야임을 알 수 있다.[citation needed] 2011년에는 유럽에 약 27,5억 유로를 연구개발에 투자했다. 66만 명을 직접 고용해 간접 고용(상류·하류)의 3~4배에 달하는 고용을 창출했다.[citation needed]
연구에 기반을 둔 제약산업이 의료진행에 기여한 핵심적 기여는 기초연구를 사람들이 더 오래 살고 더 건강해질 수 있도록 돕는 것을 목표로 환자들이 폭넓게 이용할 수 있고 접근할 수 있는 혁신적인 치료법으로 바꾸는 것이다. 고혈압과 심혈관계 질환은 고혈압약과 콜레스테롤을 낮추는 약으로 조절할 수 있으며 무릎이나 고관절 치환술은 환자가 움직이지 못하게 하며, 일부 암은 새로운 표적 의약품 덕분에 조절되거나 치료될 수 있다. 그러나 알츠하이머, 다발성 경화증, 많은 암, 고아병과 같은 많은 질병 분야에는 큰 어려움이 남아 있다.
EFPIA는 또한 백신과 생명공학에 초점을 맞춘 두 개의 전문 그룹을 포함한다.
EFPIA 우선 순위
업계의 노력은 AIMS - 액세스, 혁신, 동원, 보안의 우선순위 로드맵[1] 프로그램의 네 가지 핵심 분야에 집중되어 있다.
- 접근은 신약에 대한 규제 승인 및 보상 절차를 가속화하고, 보상되지 않는 의약품에 대한 정부 통제를 폐지하며, 건강 기술 평가(HTA)가 시장 접근의 네 번째 장애물이 되지 않도록 하기 위해 지속적으로 노력할 필요가 있음을 의미한다.
- 혁신은 유럽에 강력한 과학 기반을 조성하고 유럽을 최고의 연구자들에게 매력적인 장소로 만들기 위한 노력에 초점을 맞춘다; 점진적인 혁신과 높은 수준의 지적재산권 보호를 포함한 기술혁신에 대한 공정한 보상을 보장한다.
- 동원은 노령화 인구의 과제를 해결하고 현대적이고 지속 가능한 의료 서비스를 제공하기 위해 주요 이해당사자들과 힘을 합치는 것, 비용 절감 정책에 맞서 싸우는 것, 환자와 시민이 다양한 출처의 정보에 더 잘 접근함으로써 자신의 건강 관리에 적극적인 역할을 할 수 있도록 하는 것, 그리고 highling에 이르는 것이다.iight 산업은 개발도상국에 영향을 미치는 질병에 대한 연구에 대한 새로운 인센티브를 촉진하고 의약품에 대한 접근에 기여한다.
- 보안이란 병행무역의 안전성 우려 해소, 위폐 위험에 대한 국민의 인식 제고, 의약품의 추적성 제고 등을 통해 의약품 공급망의 건전성과 투명성을 강화해야 할 필요성을 말한다.
연구개발(R&D)
2010년에 제약 산업은 유럽의 연구개발에 약 2,7,8억 유로를 투자했다. 1995~2005년 미국을 향한 경제 및 제약 연구 활동의 큰 전환을 이끈 10년간의 미국 시장 지배력 강화 이후, 유럽은 또한 신흥 경제국들과의 경쟁 심화에 직면해 있다.[citation needed] 오늘날 브라질, 중국, 인도와 같은 신흥 경제국들의 시장과 연구 환경이 급속도로 성장하여, 유럽 이외의 지역에서 경제 및 연구 활동이 이러한 급속한 성장 시장으로 추가적으로 이동되고 있다. 제약 시장의 지리적 균형, 그리고 궁극적으로는 R&D 기반이 신흥국 쪽으로 점차 옮겨갈 가능성이 높다.
시장에 소개된 모든 신약은 제약회사들이 시행하는 장기적이고 비용이 많이 들며 위험한 연구개발(R&D)의 결과물이다.
- 약용품이 시장에 도달할 때까지 새로운 활성 물질의 최초 합성 이후 평균 12~13년이 경과할 것이다.
- 새로운 화학적 또는 생물학적 실체를 연구하고 개발하는 비용은 2005년 10억5900만 유로(2005년 13억1800만 달러)로 추정되었다(Di Masi J, Tufts University, Centre for the Drug Development, 2007).
- 평균적으로 실험실에 합성된 물질 1만개당 1~2개만이 모든 단계를 성공적으로 통과해 시장성 있는 의약품이 될 것이다.
중국 인도 등 신흥국의 연구환경이 급성장하고 있다. 유럽의 연구개발(R&D) 사이트를 폐쇄하고 아시아에 신규 사이트를 개설하려는 현재의 경향은 EU의 제약 발견 전문지식을 유지하는 데 극적인 효과를 보일 것이다. 미국은 여전히 바이오의약품 분야를 지배하고 있으며, 세계 생명공학 수입과 연구개발 지출의 3/4를 차지하고 있다.
2007년 세계 의약품 매출의 45.9%를 차지한 북아메리카는 유럽이 31.1%를 차지했다. IMS Health 자료에 따르면 2004~2008년 출시한 신약 판매의 66%가 미국 시장에서 발생했으며, 유럽 시장에서는 26%가 발생하였다.
혁신적인 의약품 이니셔티브
혁신 의약품 이니셔티브(IMI)는 유럽위원회와 EFPIA가 설계한 민관 협력 기관이다. 대형 바이오의약품 기업, 중소기업(SME), 환자단체, 학계, 병원, 공공기관 등이 한자리에 모이는 범유럽 합작품이다. 이 시책은 의약품 개발 과정에서 병목현상을 제거함으로써 더 나은 의약품의 발견과 개발을 가속화하는 것을 목표로 한다. 구체적이고 새로운 의약품을 개발하는 것보다 약물 개발 과정을 개선하고 개선하는 더 나은 방법과 도구를 만드는 데 초점을 맞추고 있다.
유럽위원회와 EFPIA는 공동으로 새로운 비영리 유럽 공동체 기구를 설립했다. 이 기관은 IMI 연구 안건의 권고사항 이행에 초점을 맞춘 혁신적인 연구 프로젝트를 수행하는 유럽 민관협력에 연구 보조금을 지급할 법적 권한을 갖는다.
IMI 연구 안건은 유럽 전역의 광범위한 이해관계자들과 집중적인 협의를 거쳐 업계가 주도하는 가운데 제정되었다. 바이오의약품 연구개발 프로세스의 주요 연구 병목현상을 파악하고, 다음 4가지 분야에 초점을 맞춰 이러한 병목현상을 극복하기 위한 권고안을 제시한다.
- 안전성 예측: 이는 개발 프로세스의 임상 전 단계 동안 화합물의 안전성 평가와 관련된 병목 현상을 해결하지만 임상 개발의 후기 단계에도 영향을 미친다.
- 효능 예측: 이것은 약물이 인간에게 어떻게 상호작용할 것인지 그리고 그것이 어떻게 기능 변화를 만들어낼 수 있는지를 예측하는 능력의 병목 현상을 해결한다.
- 지식 관리: 이것은 안전성과 유효성을 예측하기 위한 정보와 데이터의 보다 효과적인 사용을 다룬다.
- 교육 및 훈련: 이것은 약물 개발 과정의 기존 훈련 격차를 줄여준다.
IMI는 바이오의약품 연구개발(R&D) 투자에 유럽을 더욱 매력적으로 만들고 유럽 생명과학 연구개발(R&D) 경쟁력을 끌어올릴 것이다. IMI는 유럽에서 바이오의약품 부문이 직면한 과제를 직접 해결함으로써 다음과 같은 가능성을 가지고 있다.
- 의약품의 개발을 현대화하다.
- 유럽에 바이오의약품 연구개발(R&D) 투자를 유치하기 위해 유럽의 전문지식과 신기술 노하우를 확대한다.
- 유럽에 연구개발(R&D) 업무를 앵커로 하고 두뇌 유출을 역추진하다.
- 바이오의약품 산업의 여건을 개선하고 모든 이해관계자의 협업을 강화하여 유럽의 경제를 향상시킨다.
논란
1991년부터 1998년까지 에머 쿡은 EFPIA의 이사회 멤버였다.[1] 그녀는 2020년 11월 유럽 연합(EU)의 약품 평가와 감독을 담당하는 기관인 유럽의약품청(EMA)의 전무이사가 되었다.[2]
2021년 4월 1일 오스트리아 의회 의원 제럴드 하우저(Jerald Hauser)의 회기는 그녀가 과거 EFPIA의 로비스트로 일했던 바로 그 산업에서 일하면서 논란이 되고 있는 옥스퍼드-아스트라제네카 COVID-19 백신의 승인을 허용함으로써 잠재적인 이해 상충을 공개적으로 비판했다.[3][4]
참고 항목
- 유럽 및 개발도상국 임상시험 파트너십(EDCTP)
- 유로파비오
- 유럽 생명공학 연맹(EFB)
- 국제 의약품 제조업체 협회(IFPMA)
- 미국의 제약 연구 및 제조업체(PhRMA)
- 제약회사
- 포르투갈 제약산업협회
참조
- ^ https://www.who.int/blueprint/about/emer-cook/en/
- ^ https://www.ema.europa.eu/en/news/emer-cooke-takes-office-head-ema
- ^ https://www.ots.at/presseaussendung/OTS_20210401_OTS0032/fpoe-hauser-ema-direktorin-hat-ihr-ganzes-arbeitsleben-mit-lobbying-fuer-die-pharmaindustrie-verbracht
- ^ https://www.youtube.com/watch?v=oqH9CoXXYIs