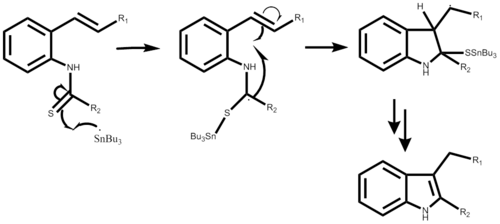
후쿠야마 인돌 합성
Fukuyama indole synthesis후쿠야마 인돌 합성은 2,3-디치환 인돌을 [1]형성하는 다목적 주석 매개 화학 반응이다.이치환 인돌 [2]생성에 유용한 실용적인 원포트 반응입니다.환원제로는 트리부틸틴 하이드라이드가 가장 일반적으로 사용되며 라디칼 개시제로는 아조비소뷰티로니트릴(AIBN)이 사용된다.트리에틸보란은 라디칼 개시제로도 [3]사용될 수 있다.반응은 오르토 이소시아노스티렌 유도체 또는 2-알케닐티오아닐리드 유도체로 시작할 수 있으며, 둘 다 α-스탠노이미도일 래디칼을 [4]통한 라디칼 환화를 통해 인돌을 형성한다.R 그룹은 에스테르, THP 에테르 및 β-락탐과 같은 염기성 및 산성에 민감한 기능군의 범위가 될 수 있습니다.또한 시스와 트랜스 아이소폼을 모두 사용하여 원하는 생성물을 [5]얻을 수 있다는 점에서 이 반응은 입체특이적이지 않다.
메커니즘
반응 메커니즘은 AIBN 또는 트리에틸보란 중 하나를 사용하여 트리부틸 주석 래디칼을 생성하는 것으로 시작되며, 어느 단계적 메커니즘에서도 나타나지 않습니다.래디컬 공격에 이어 o-이소시아노 탄소가 알파-스탠노이미도일 래디칼을 생성한다.래디칼 환화를 통해 5개의 멤버버링이 형성되고 이어서 새로운 주석 래디칼이 전파됩니다.마지막 단계는 원하는 반응 결과에 따라 달라집니다.이 반응은 1포트 합성이며 [1]치환기에 따라 50% ~ 98%의 생산량을 얻을 수 있다.
2-알케닐티오아닐라이드를 사용하는 메커니즘은 매우 유사하며, 또한 주석 래디칼과 유황 사이의 결합 형성에서 시작됩니다.이어서 유사한 라디칼 환화를 통해 5개의 멤버버링이 생성되며, 새로운 주석 라디칼이 생성되어 원래의 공격 라디칼이 유황 치환기에 의해 이탈한다.단계별 메커니즘의 이 부분은 아직 자세히 설명되지 않았습니다.반응 수율은 원하는 치환기에 따라 40%에서 93% 사이일 수 있습니다.
파생상품
후쿠야마 인돌 합성은 고리 내 질소에 대한 보호기 없이는 이전에는 도달할 수 없었던 2,3 위치에서 다양한 치환기를 생성할 수 있다.그러한 예 중 하나는 2-요오드인돌 유도체이며, 이는 다양한 N-비보호 2,3 치환 인돌로 이어질 수 있다.이 화합물이 발견되기 전에는 N-비보호 2,3-스타닐린돌을 실질적으로 합성할 방법이 없었기 때문에 2-스타닐린돌과 관련된 화학이 개발되지 않았다.하나는 스틸 [6]커플링으로 알려진 프로세스에 의한 금속화를 통한 N-보호 2-스탠닐린돌 생산으로 제한되었습니다.후쿠야마 합성에 의해 생성된 N-비보호 2-스탠닐린돌은 2-요오드인돌을 시작 시약으로 하는 다양한 화합물의 합성을 가능하게 하는 화학 영역을 여는 요오드에 의해 쉽게 산화될 수 있다.이 요오드 치환 유도체는 할로겐화 아릴, 요오드화 비닐, 삼산 비닐, 브롬화 벤질 등으로 이어질 수 있습니다.
두 번째 [5]위치에는 아세틸렌(소노가시라 커플링)과 아크릴레이트(헥 반응)가 있다.
적용들
합성은 다치환 인돌을 만드는 가장 간단한 방법 중 하나이며, 이 절차는 아스피도피틴,[7] 빈블라스틴 [8]및 스트리치닌을[9] 포함한 수많은 천연물 합성에 사용되어 왔다.
아래는 후쿠야마 인돌 합성을 이용하여 이치환 인돌을 생성하는 (+)-빈블라스틴 합성의 네 번째 단계이다.
또한 후쿠야마 반응은 인돌로카르바졸,[5] [5]비인돌릴의 합성 및 빈카디프포르민과 타베르소닌의 [10]전합성에도 관여한다.
레퍼런스
- ^ a b Fukuyama, T.; Chen, X.; Peng, G. (1994). "A Novel Tin-Mediated Indole Synthesis". J. Am. Chem. Soc. 116 (7): 3127–8. doi:10.1021/ja983681v.
- ^ Pindur, U.; Adam, R. (1998). "Synthetically attractive indolization processes and newer methods for the preparation of selectively substituted indoles". J. Heterocycl. Chem. 25 (1): 1–8. doi:10.1002/jhet.5570250101.
- ^ Tokuyama, H.; Yamashita, T.; Reding, M. T.; Kaburagi, Y.; Fukuyama, T. (1999). "Radical Cyclization of 2-Alkenylthioanilides: A Novel Synthesis of 2,3-Disubstituted Indoles". J. Am. Chem. Soc. 121 (15): 3791–2. doi:10.1021/ja983681v.
- ^ Gribble, G. (2000). "Recent developments in indole ring synthesis—methodology and applications". J. Chem. Soc. Perkin Trans. 1. 2000 (7): 1045–75. doi:10.1039/a909834h.
- ^ a b c d Kobayashi, T.; Fukuyama, T. (1998). "Development of a novel indole synthesis". J. Heterocycl. Chem. 35 (5): 1043–56. doi:10.1002/jhet.5570350504.
- ^ Trost, B. M.; Fortunak, J. M. (1982). "Cyclizations initiated by a Pd2+-Ag+ mixed-metal system". Organometallics. 1 (7): 7–10. doi:10.1021/om00061a003.
- ^ Sumi, S.; Matsumoto, K.; Tokuyama, H.; Fukuyama, T. (2003). "Enantioselective Total Synthesis of Aspidophytine". Org. Lett. 5 (11): 1891–3. doi:10.1021/ol034445e. PMID 12762679.
- ^ Yokoshima, S.; Ueda, T.; Kobayashi, S.; Sato, A.; Kuboyama, T.; Tokuyama, H.; Fukuyama, T. (2002). "Stereocontrolled Total Synthesis of (+)-Vinblastine". J. Am. Chem. Soc. 124 (10): 2137–9. CiteSeerX 10.1.1.414.6638. doi:10.1021/ja0177049. PMID 11878966.
- ^ Kaburagi, Y.; Tokuyama, H.; Fukuyama, T. (2004). "Total Synthesis of (−)-Strychnine". J. Am. Chem. Soc. 126 (33): 10246–7. doi:10.1021/ja046407b. PMID 15315428.
- ^ Kobayashi, S.; Peng, G.; Fukuyama, T. (1999). "Efficient total syntheses of (±)-vincadifformine and (−)-tabersonine". Tetrahedron Lett. 40 (8): 1519–22. doi:10.1016/S0040-4039(98)02667-7.