아마바딘
Amavadin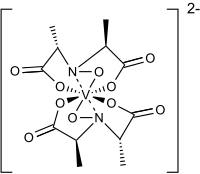 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 bis[N-[(1S)-1-(카복시-κO)ethyl]-N-(히드록시-κO)-L-알라니나토(2-)κN,κO]-바나듐 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 |
|
펍켐 CID |
|
| 유니 | |
| |
| |
| 특성. | |
| [V{NO[CH(CH3)CO2]2}2]2− | |
| 어금질량 | 398.94 g/190 |
| 외관 | 연한 청색의 용액 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
아마바딘은 독성이 있는 아마니타 버섯의 세 종류에서 발견되는 바나듐 함유 음이온으로, A. 무스카리아, A. 레갈리스, A. 벨라티페스 등이 있다.[1]아마바딘은 1972년 크나이펠과 바이엘에 의해 처음 격리되어 확인되었다.[2]푸른 해법으로 나타나는 이 음이온은 8개의 좌표로 이루어진 바나듐 복합체다.[1]Ca2+ cation은 좋은 품질의 X선 회절을 얻기 위해 아마바딘을 결정화하는데 종종 사용된다.[1]산화 아마바딘은 그것의 PPh4+ 소금으로 분리될 수 있다.산화 형태는 NMR 스펙트럼 획득에 사용할 수 있는 바나듐(V)을 함유하고 있다.[3]
준비
아마바딘의 형성은 두 개의 사방산염 리간드가 형성되면서 시작된다.[3]
- 2 HON(CH(CH3)COH2)2 + VO2+ → [V{NO[CH(CH3)CO2]}]222− + HO2 + 4+ H
구조 및 특성
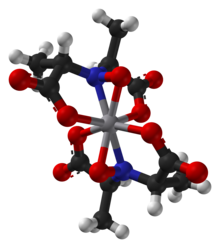
아마바딘에서 발견된 리간드는 1954년에 처음 합성되었다.[4]아마바딘은 바나듐(IV)을 함유하고 있다.처음에 아마바딘은 바나딜, VO2+, 중심을 가진 것으로 생각되었다.1993년 결정학적 특성화에 의해 아마바딘이 바나딜 이온화합물이 아님을 밝혀냈다.대신 옥타코오티드 바나듐()IV) 복합체.이 단지는 N-hydroxymino-2'-dipropionic acid, HIDPA3, ligands에서 파생된 2개의 사방산 리간드에 접합되어 있다.[5]리간드는 질소와 세 개의 산소 중심을 통해 조정된다.
아마바딘(Amavadin)은 2전하를 갖는2 C-대칭 음이온이다.두 개의 축은 두 개의 NO 리간드에 수직인 바나듐 원자를 이등분한다.음이온은 바나듐에 1개, S 입체화학이 있는 4개의 탄소 원자에 5개의 치랄 중심을 가지고 있다.[1]리간드에는 (S,S)-(S,S)-Δ 및 (S,S)-RW의 두 가지 가능한 분무기가 있다.
생물 함수
아마바딘의 생물학적 기능은 아직 알려져 있지 않지만, 손상된 조직의22 재생에 도움을 주기 위해 HO를 사용하고 과산화효소 역할을 하는 것으로 생각되어 왔다.[3]아마바딘은 버섯 보호를 위한 독소 역할을 할 수 있다.[6]
참조
- ^ a b c d Berry, R.E.; Armstrong, E.M.; Beddoes, R.L.; Collison, D.; Ertok, S.N.; Helliwell, M.; Garner, C.D. (1999). "The Structural Characterization of Amavadin". Angew. Chem. Int. Ed. 38 (6): 795–797. doi:10.1002/(SICI)1521-3773(19990315)38:6<795::AID-ANIE795>3.0.CO;2-7. PMID 29711812.
- ^ 크나이펠, H.; 바이엘, E. "강화학과 아마바딘의 총합성, 아마니타 무스카리아의 자연발생 바나듐 음이온"J. Am. Chem. Soc. 1986, 108:11, 페이지 3075–3077.
- ^ a b c Hubregtse, T.; Neeleman, E.; Maschmeyer, T.; Sheldon, R.A.; Hanefeld, U.; Arends, I.W.C.E. (2005). "The first enantioselective synthesis of the amavadin ligand and its complexation to vanadium". J. Inorg. Biochem. 99 (5): 1264–1267. doi:10.1016/j.jinorgbio.2005.02.004. PMID 15833352.
- ^ Fu, S-C.J.; Birnbaum, S.M.; Greenstein, J.P. (1954). "Influence of Optically Active Acyl Groups on the Enzymatic Hydrolysis of N-Acylated-L-amino Acids". J. Am. Chem. Soc. 76 (23): 6054–6058. doi:10.1021/ja01652a057.
- ^ Armstrong, E.M.; Beddoes, R.L.; Calviou, L.J.; Charnock, J.M.; Collison, D.; Ertok, N.; Naismith, J.H.; Garner, C.D. (1993). "The Chemical Nature of Amavadin". J. Am. Chem. Soc. 115 (2): 807–808. doi:10.1021/ja00055a073.
- ^ Garner, C.D.; Armstrong, E.M.; Berry, R.E.; Beddoes, R.L.; Collison, D.; Cooney, J.J.A.; Ertok, S.N.; Helliwell, M. (2000). "Investigations of Amavadin". J. Inorg. Biochem. 80 (1–2): 17–20. doi:10.1016/S0162-0134(00)00034-9. PMID 10885458.





