과산화세슘
Caesium peroxide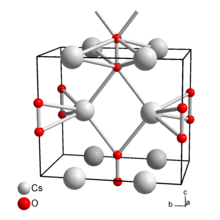 | |
| 식별자 | |
|---|---|
| 특성. | |
| Cs2O2 | |
| 외관 | 옐로우시[1] |
| 구조 | |
| 정형외과[2] | |
| 관련 화합물 | |
기타 양이온 | 과산화리튬 과산화나트륨 과산화칼륨 과산화 루비듐 |
| 아산화 세슘 일산화탄소 세슘 세슘세쿼이옥사이드 과산화세슘 오조나이드 세슘 | |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
과산화세슘 또는 과산화세슘은 세슘과 산소의 화합물이다.암모니아 용액에 스토오치메트릭을 첨가하거나 고체 금속을 직접 산화시켜 세슘 금속으로 형성할 수 있다.[1]
- 2Cs + O2 → Cs2O2
- 2CsO2 → Cs2O2 + O2
650°C까지 가열하면 화합물이 일산화탄소와 원자 산소로 분해된다.[4]
과산화 세슘은 과산화 이온이 존재하기 때문에 743 cm의−1 라만 진동을 나타낸다.[5]이 화합물은 작업 기능이 낮기 때문에 종종 복사기의 코팅으로 사용된다.[6]
참조
- ^ a b I. I. Volnov (2012). Peroxides, Superoxides, and Ozonides of Alkali and Alkaline Earth Metals. Springer. p. 45. ISBN 9781468482522.
- ^ Band, A.; Albu-Yaron, A.; Livneh, T.; Cohen, H.; Feldman, Y.; Shimon, L.; Popovitz-Biro, R.; Lyahovitskaya, V.; Tenne, R. (2004-07-27). "Characterization of Oxides of Cesium". The Journal of Physical Chemistry B. American Chemical Society (ACS). 108 (33): 12360–12367. doi:10.1021/jp036432o. ISSN 1520-6106.
- ^ Berardinelli, S. P.; Kraus, D. L. (1974-01-01). "Thermal decomposition of the higher oxides of cesium in the temperature range 320-500.deg". Inorganic Chemistry. American Chemical Society (ACS). 13 (1): 189–191. doi:10.1021/ic50131a037. ISSN 0020-1669.
- ^ Zefirov, Nikolaj (1995). Chimičeskaja ėnciklopedija : v pjati tomach (in Bosnian). Moskva: Izdat. p. 658. ISBN 5-85270-092-4. OCLC 258155382.
- ^ Livneh, Tsachi; Band, Alisa; Tenne, Reshef (2002). "Raman scattering from the peroxide ion in Cs2O2". Journal of Raman Spectroscopy. Wiley. 33 (8): 675–676. Bibcode:2002JRSp...33..675L. doi:10.1002/jrs.900. ISSN 0377-0486.
- ^ Sun, Yun; Liu, Zhi; Pianetta, Piero; Lee, Dong-Ick (2007). "Formation of cesium peroxide and cesium superoxide on InP photocathodes activated by cesium and oxygen". Journal of Applied Physics. AIP Publishing. 102 (7): 074908–074908–6. Bibcode:2007JAP...102g4908S. doi:10.1063/1.2786882. ISSN 0021-8979.
![{\displaystyle {\mathsf {Cs_{2}O_{2}\rightarrow Cs_{2}O+[O]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5bfc00de3ed210e6a65dcb79d54797364926bfd4)


