아브라모프 반응
Abramov reaction| 아브라모프 반응 | |
|---|---|
| 이름을 따서 명명됨 | 바실리 S.아브라모프 |
| 반응형 | 커플링 반응 |
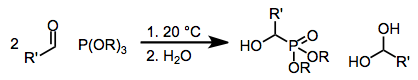
아브라모프 반응은 카보닐 화합물을 첨가하여 트릴킬과 α-하이드록시 인산염의 관련 변환이다.메커니즘의 측면에서, 그 반응은 카보닐 카본에 있는 핵 인 원자의 공격을 포함한다.[1]1957년 러시아 화학자 바실리 세메노비치 아브라모프(1904~1968)의 이름을 따서 지은 것이다.[2]
소개
인산염, 인산염, 인산염과 같은 전자가 풍부한 인의 원천은 단순한 카보닐 화합물에서 탄소 원자에 핵포틸을 첨가할 수 있다.완전히 에스테르화된 인산염(Abramov reaction)을 사용할 때, 결과적인 사면중간의 중성화는 보통 인에 부착된 산소에서 새로 생성된 알킬 또는 실일 그룹의 전달을 통해 발생한다.또한 결합 첨가도 가능하며,[3] 그룹 이송 후 γ기능성 카보닐 화합물 또는 에놀 에테르를 제공한다.실록시 함유 인원의 사용은 결과 α-실록시 화합물을 알코올 용제가[4] 있는 상태에서 해당 α-히드록시 유도체로 변환할 수 있기 때문에 이 반응의 범위가 크게 확대되었다.
(1)

메커니즘과 입체화학
우세 메커니즘
인산염은 단순한 카보닐 화합물의 카보닐 탄소에 역방향으로 첨가된다.경미한 조건에서는 출발 물질로의 회귀가 분자간 및 분자내 알킬 그룹 전이보다 빠르다. 즉, 분자내 전달에 대한 4-center 전환 상태는 궤도 오버랩이 불량하다.[5]고온 또는 압력 조건에서 이송을 촉진할 수 있다.알데히드 등가물 2개를 사용할 경우, 알데히드의 두 번째 분자에 사면체 중간을 추가하면 순환 인광체 1 또는 선형 알킬 전달 제품 2로 이어진다.
보다 실용적인 것은 실록성 인 화합물 3을 제공하는 실록성 인 선원의 사용으로, 분자 내 실리성 그룹 전이를 전방 방식으로 거친다.[6]
(3)

범위 및 제한
인 시약
인산염은 일반적으로 α-히드록시 인산염을 생성하는 데 사용된다.알데히드 순환 인산염 1 (등분 3)의 등가물 2개가 있는 경우, 이러한 인산염은 해당 히드록시 인산염을 공급하기 위해 쉽게 가수 분해할 수 있다.[7]
(6)
인산염은 염기성 촉매량이 존재하는 곳에서 사용되면 인산염화물이 발생할 수 있다.인산나트륨 염은 역사적으로 이런 맥락에서 잘 작용해 왔으며, 아미드나트륨과 같은 염기가 사용되어 왔다.[8]그러나 비대칭 유도 및 선택적 직접 첨가(결합 카보닐 화합물의 경우)는 키랄 아민 베이스가 있는 상태에서 달성할 수 있다.[9]
(7)

이 반응에서 실릴린 인 시약의 발견과 사용은 방법론적 진보를 나타냈다.선택적 실릴 그룹 전송은 혼합 시약에서 발생하며, 그 결과 실리콘-산소 결합의 갈라짐은 종종 수력학적으로 이루어져서 α-하이드록시 유도체에 접근할 수 있다.α-실록시 제품의 알킬화는 다른 방법으로는 α-알록시 인 화합물에 접근하기 어려운 편리한 경로를 제공한다.감압 시 아킬 음이온 등가물로 기능할 수 있으며, 기본 조건에서 제거 후 케톤을 투여한다.[10]
(8)

카보닐 기판
단순 케톤과 알데히드는 카보닐 탄소에 인산염의 첨가 과정을 거친다.한 가지 흥미로운 응용에서, 케틴에 더하면, 산 할로겐의 아르부조프 반응과 동일한 제품을 준다.[11]
(9)

α,β-불포화 케톤과 알데히드도 그 반응을 겪는다.디에닐 카보닐 기판은 아래 예시와 같이 1,6의 추가가 발생할 수 있다.[12]
(10)

이미인은 또한 α-알킬아미노 인산염을 공급하면서 반응(푸도빅 반응)을 겪을 수 있다.[13]1차 아민은 중간 테르트-부틸아민의 산성 가수분해 후에만 생산될 수 있다;[14] 미분해 이미인의 사용은 매우 가혹한 조건을 필요로 하고 낮은 수율을 제공한다.
(11)

합성 효용
이 방법에 의해 생성된 α-하이드록시 알킬인스포네이트를 추가 변환에 사용할 수 있다.원래 카보닐 탄소는 인산염 그룹에 근접하여 산성화된다.음이온이 반응한 후 인산염 기능을 제거할 수 있기 때문에 이 위치에서 디프로토닌은 가면을 쓴 아킬 음이온을 생성한다.인광산염 음이온은 알킬화와 올레피화(호너-와드워스-에몬스 반응)를 겪을 수 있다.[15]α-아미노 알킬인스포네이트를 올레피네이션에 채용할 경우, 결과 에나민은 케톤으로 가수분해할 수 있다.
(12)
불포화 카보닐 화합물 및 디프로토닝은 동종 화합물을 제공한다.
다른 방법과의 비교
실릴레이트 인산염 시약은 α-하이드록시인산염의 생산에 가장 효율적인 몇 가지 시약이다.그러나 이러한 화합물을 만들기 위한 몇 가지 다른 방법이 존재한다.예를 들어, 인산염-인산염 재배열은 3-membed 주기적 중간을 통해 α-hydroxyphosphonate를 제공한다.[16]
(13)

실험 조건 및 절차
일반적으로 인 첨가 반응은 수술적으로 간단하다.극지방(아세토나이트릴, 에탄올, 테르트부탄올) 및 극지방(벤젠) 용제의 시약 용액을 사용할 수 있다.인산염 제거기의 추가나 이미인의 상황 형성에 산성 촉매제가 필요할 수 있다.전자의 경우에도 베이스 촉매제를 사용할 수 있다.증류는 일반적으로 순수 제품을 분리하기에 충분하다.
참고 항목
- Michaelis-Arbuzov 반응 - 인산염을 형성하기 위한 삼알킬 인산염과 알킬 할라이드의 반응.
참조
- ^ Engel, R. (2004). "Phosphorus Addition at sp² Carbon". Organic Reactions: 175–248. doi:10.1002/0471264180.or036.02. ISBN 0471264180.
- ^ Аркадий Николаевич Пудовик. iopc.ru
- ^ Sekine, M.; Yamamoto, I.; Hashizume, A.; Hata, T. (1977). "Silyl Phosphites V. The Reactions of Tris(Trimethylsilyl) Phosphite with Carbonyl Compounds". Chem. Lett. 6 (5): 485–488. doi:10.1246/cl.1977.485.
- ^ Ranganathan, D.; Rao, B.; Ranganathan, S. (1979). "Nitroethylene: Synthesis of novel 2-nitroethylphosphonates". J. Chem. Soc., Chem. Commun. (21): 975. doi:10.1039/c39790000975.
- ^ Ginsberg, A.; Jakubovich, Y. (1960). Zh. Obshch. Khim. 30: 3979.
{{cite journal}}: CS1 maint: 제목 없는 정기 간행물(링크) - ^ 소머, H. 스테레오화학, 메커니즘과 실리콘, 맥그라우힐, 1965년, 페이지 176–178.
- ^ Ramirez, F.; Bhatia, B.; Smith, P. (1967). "Reaction of trialkyl phosphites with aromatic aldehydes". Tetrahedron. 23 (5): 2067. doi:10.1016/0040-4020(67)80040-1.
- ^ Pudovik, A.; Arbuzov, A. (1950). Dokl. Akad. Nauk SSSR. 73: 327.
{{cite journal}}: CS1 maint: 제목 없는 정기 간행물(링크) - ^ Wynberg, H.; Smaardijk, A. (1983). "Asymmetric catalysis in carbon-phosphorus bond formation". Tetrahedron Lett. 24 (52): 5899. doi:10.1016/S0040-4039(00)94232-1.
- ^ Horner, H.; Roder, H. (1970). "Phosphororganische Verbindungen, 67. Notiz über die reduktive Umwandlung von Carbonsäuren in ihre Aldehyde". Chem. Ber. 103 (9): 2984. doi:10.1002/cber.19701030936.
- ^ Mirsalikhova, M.; Baranova, A.; Tunitskaya, L.; Gulyaev, N. (1981). Biokhimiya. 46: 258.
{{cite journal}}: CS1 maint: 제목 없는 정기 간행물(링크) - ^ Arbuzov, A.; Fuzhenkova, V.; Rozhkova, F. (1982). J. Gen. Chem. USSR. 52: 10.
{{cite journal}}: CS1 maint: 제목 없는 정기 간행물(링크) - ^ Tyka, R. (1970). "Novel synthesis of α-aminophosphonic acids". Tetrahedron Lett. 11 (9): 677–680. doi:10.1016/S0040-4039(01)97800-1.
- ^ Moedritzer, K. (1970). "A Novel Synthesis of Aminomethylphosphonic Acid". Synth. React. Inorg. Metal-Org. Chem. 2 (4): 317–327. doi:10.1080/00945717208069617.
- ^ Wadsworth, W. (1977). "Synthetic Applications of Phosphoryl-Stabilized Anions". Org. React. 25: 73–253. doi:10.1002/0471264180.or025.02. ISBN 0471264180.
- ^ Sturtz, G.; Corbel, B.; Paugam, J.-P. (1976). "Nouveaux synthons phosphores : Bianions d'hydroxy-1 propene-2 YL phosphonamides, carbanions en β d'acides carboxyliques potentiels". Tetrahedron Lett. 17: 47–50. doi:10.1016/S0040-4039(00)71319-0.


