캡토 효과
Captodative effect
캡토데이션 효과는 전자-퇴출 대체물과 전자 기부 대체물의 시너지 효과에 의한 활성산소의 안정화다.[2][3]이 이름은 전자 인출 그룹(EWG)을 캡토 그룹(Captor)이라고 부르기도 하는 반면 전자 기부 그룹(EDG)은 "dative" 대체물이라고 부르기도 한다.[3]이 대체 패턴을 가진 올레핀은 때때로 자막으로 묘사된다.[2]급진적인 반응은 몇 가지 화학 반응에 필수적인 역할을 하며 또한 중합체 과학 분야에도 중요하다.[4]
EDG와 EWG가 급진적 중심 가까이에 있을 때, 급진적 중심부의 안정성은 증가한다.[1]대체물은 분자와 다른 급진적인 중심들이 중심과 반응하는 것을 방지함으로써 운동적으로 급진적인 중심들을 안정시킬 수 있다.[3]대체 물질은 공명을 통해 급진 이온을 분해하여 열역학적으로 중심을 안정시킨다.[1][3]이러한 안정화 메커니즘은 자유방사선 반응에 대한 증가율을 유도한다.[5]오른쪽 그림에서 라디칼은 캡토르 니트릴(-CN)과 데이티브 2차 아민(-N(CH3)2 사이에서 소산되어 라디칼 중심이 안정화된다.[3]
반응율에 대한 대체 효과
어떤 대체자들은 다른 대체자들보다 급진적인 중심을 안정시키는 데 더 뛰어나다.[6]이는 대체자가 전이 상태 구조에서 급진 이온을 소산하는 능력에 의해 영향을 받는다.[3]급진 이온을 분해하면 전환 상태 구조가 안정된다.그 결과 활성화의 에너지가 감소하여 전체 반응의 비율을 높인다.캡토 효과에 따르면, EDG와 EWG 모두 전환 상태 구조에서 급진 이온을 소산시킬 수 있을 때 반응 속도는 가장 크다.[7]
이토와 동료들은 올레핀 분비에 대한 아릴틸 래디컬의 추가 반응 비율을 관찰했다.[6]올레핀은 EWG 니트릴 그룹과 다양한 EDG를 포함했으며, 다양한 EDG가 추가 반응 속도에 미치는 영향을 관찰했다.연구된 프로세스는 다음과 같다.
추가 반응 속도는 다음의 EDG에 의해 증가 순서에 따라 가속화되었다.H < CH3 < OCHCH23>.R = OCHCH일23 때 반응 속도가 가장 빠른 것은 반응의 활성화 에너지(ΔG‡)가 가장 작기 때문이다.이토시와 사이아노 집단은 과도상태에서 급진 이온을 탈색시킬 수 있어 급진적인 중심을 안정시킬 수 있다.요금 인상은 자막 효과에 기인자막 효과에 기인한다.R = H일 때, 급진적인 중심이 캡토 효과에 의해 안정화되지 않기 때문에 반응의 활성화 에너지가 가장 크다.수소 원자는 급진 이온을 분해할 수 없다.따라서 R = OCHCH23 사례에 비해 반응이 느리다.R = CH일3 때, 메틸 그룹의 전자 기증 능력이 더 높기 때문에 R = H일 때 대비 반응 속도가 더 빠르다.[6]단, 과격한 이온이 메틸 그룹에 비해 소산되지 않기 때문에 R = OCHCH에23 비해 반응 속도가 느리다.따라서 EWG와 EDG 대체물 모두에 대해 급진 이온이 분산되지 않는 경우 캡토제는 반응 속도에 영향을 주지 않는다.이러한 각각의 사례는 아래에 설명되어 있다.
합성에서의 사용
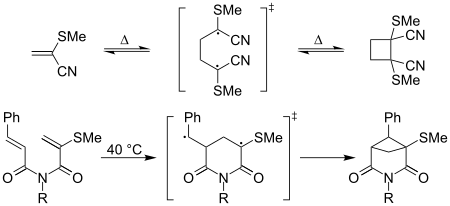
"캡처형 에틸렌"이라는 용어는 2-메틸티오아크릴로니트릴의 열적 [2+2] 머리와 머리 사이의 조광화는 상온에서 쉽게 발생하며, 아크릴로니트릴의 등가 시클로부탄 유도체의 형성은 "슬러기시"[8]이다.또한 아래와 같이 근내[2+2] 사이클링도 캡쳐 효과에 의해 강화되는 것으로 보고되었다.[8]
[3+2], [4+2], [3+4]와 같은 다른 사이클로어드민에 대해서도 유사한 효과가 논의되었다.[9]또한 디엘-알데르, 프리델-크래프트와 같은 경우에서 핵포질 올레핀이 비효율적으로 반응하는 경우, 전이 상태가 비균형에 가까워서 안정화되기 때문에 효과가 보고되었다.[8][10]이러한 연구들은 ΔΩ에 대한 직접적인 의존, 전기영역성의 차이, 그리고 반응의 극성을 밝혀냈다.그것들은 매우 반응적이고 입체적이며, 이러한 반응 안에서 재생성 있는 성질 때문에 사용되어 왔다.[9][11]
반응에서 캡토화 올레핀은 또한 전형적인 운동성 동위원소 효과에 간섭하는 효과를 보여주며, 동위원소 라벨이 부착된 분자와[12] 비정형 반응이 일어나도록 허용하고 이러한 반응의 메커니즘과 전환 상태가 영향을 받았음을 증명한다.
폴리머 과학 응용
활성산소가 공정 전파의 체인 운반체인 프리라디칼 중합은 2001년 미국에서 생산된 1,100억 파운드의 폴리머 중 400억 파운드를 차지했다.[13]캡토형 올레핀은 급진성을 불안정하게 하는 효과 없이 용제 효과에 반응할 수 있는 특별한 장점이 있다.[4]그들은 또한 중합 메커니즘 용해에 유용하고 NMR Studies를 통해 더 잘 이해할 수 있도록 하는 그들의 급진적인 변화를 자발적으로 경험하는 것을 보여주었다.또한 캡토형 에탄은 알려진 급진적 메커니즘을 통해 더 높은 분자량 분포를 제공하고 블록 복합체를 형성하는 고유한 특성을 가진 개시자 이다.캡토 방식으로 대체된 시동 물질에서 얻은 중합체는 광학 활동, 극성 차이, 용제 친화도, 열 및 기계적 안정성과 같은 "바람직한" 특성을 나타낸다.
- 극성 대체재를 사용한 폴리머는 전기 및 광학 소재 등 흥미로운 용도가 있는 것으로 알려져 있다.
- 이 중합체는 전형적으로 투명하다.
- 이들 중합체의 Tdi(초기 분해)는 아날로그에 비해 상대적으로 낮지만 T(중량dm 변화 온도의 최대 속도)가 상대적으로 높다.즉, 비록 그들이 더 빨리 녹기 시작할 것이지만, 완전히 국면을 바꾸는 데는 더 오랜 시간이 걸릴 것이다.
- 큰 캡토화 안정화 시작 재료를 가진 폴리머는 가열 시 시작 모노머에 빠르게 "지퍼"를 풀 수 있다.
- 각 모노머 유닛마다 서로 다른 두 가지 기능 그룹이 있는 분기성 중합체는 일반적으로 캡토형 단량체로부터 형성된다.
- 데이터 그룹은 특정 분기 중합체에서 수소 결합을 통해 용해도를 상당히 변화시킨다(위 그림 참조).그러나 대체물과 용해성의 모든 조합이 조사된 것은 아니기 때문에 현재로서는 명확한 상관관계가 개발되지 않았다.
- 캡토데틱 폴리머는 특정 금속을 가진 첼레이트에서 매우 기능적이다.[4]
참조
- ^ a b c Anslyn, E. V.; Dougherty, D. A. (2006). Modern Physical Organic Chemistry (Dodr. ed.). Sausalito, CA: University Science Books. ISBN 9781891389313.
- ^ a b Concise Dictionary of Chemistry. V&S Publishers. 2012. p. 51. ISBN 9789381588628.
- ^ a b c d e f Viehe, H. G.; Janousek, Z.; Merényi, R.; Stella, L. (1985). "The Captodative Effect". Accounts of Chemical Research. 18 (5): 148–154. doi:10.1021/ar00113a004.
- ^ a b c Tanaka, H. (2003). "Captodative Modification in Polymer Science". Progress in Polymer Science. 28 (7): 1171–1203. doi:10.1016/S0079-6700(03)00013-3.
- ^ Sustmann, R.; Korth, H.-G. (1990). Advances in Physical Organic Chemistry. San Diego, CA: Academic Press. pp. 131–172. ISBN 0120335263.
- ^ a b c Ito, Osamu; Arito, Y.; Matsuda, M. (1988). "Captodative Effects on Rate of Addition Reactions of Arylthiyl Radical to Disubstituted Olefins". Journal of the Chemical Society, Perkin Transactions 2 (6): 869–873. doi:10.1039/P29880000869.
- ^ Creary, X.; Mehrisheikh-Mohammadi, M. E. (1985). "Captodative Rate Enhancement in the Methylenecyclopropane Rearrangement". Journal of Organic Chemistry. 51 (14): 2664–2668. doi:10.1021/jo00364a009.
- ^ a b c Stella, L. (1986). "Captodative Substituent Effects in Cycloaddition Reactions". In Viehe, H. G.; Janousek, Z.; Merényi, R. (eds.). Substituent Effects in Radical Chemistry. Springer. pp. 361–370. ISBN 9789027723406.
- ^ a b Herrera, R.; Jimenez-Vazquez, H. A.; Delgado, F.; Soderberg, B. C. G.; Tamariz, J. (2005). "1-Acetyvinyl Acrylates: New Captodative Olefins Bearing and Internal Probe for the Evaluation of the Relative Reactivity of Captodative against Electron-Deficient Double Bond in Diels-Alders and Friedel-Crafts Reaction". Journal of the Brazilian Chemical Society. 16 (3A): 456–466. doi:10.1590/S0103-50532005000300021.
- ^ Stella, L.; Boucher, J.-L. (1982). "Capto-dative Substituent Effects. 121 - New Ketene Equivalents for Diels-Alder Cycloadditions". Tetrahedron Letters. 22 (9): 953–956. doi:10.1016/S0040-4039(00)86992-0.
- ^ Domingo, L.; Chamorro, E.; Pérez, P. (2008). "Understanding the Reactivity of Captodative Ethylenes in Polar Cycloaddition Reactions. A Theoretical Study". Journal of Organic Chemistry. 73 (12): 4615–4624. doi:10.1021/jo800572a. hdl:10533/139635. PMID 18484771.
- ^ Wood, M.; Bissiriou, S.; Lowe, C.; Windeatt, K. M. (2013). "Synthetic Use of the Primary Kinetic Isotope Effect in Hydrogen Atom Transfer 2: Generation of Captodatively Stabilised Radicals". Organic and Biomolecular Chemistry. 11 (16): 2712–23. doi:10.1039/C3OB40275D. PMID 23479029.
- ^ Odian, G. (2004). Principles of Polymerization (4th ed.). New York: Wiley-Interscience. ISBN 9780471274001.