기브스 이소템
Gibbs isotherm깁스 흡착 등식은 다중물질 시스템에 대한 기타로서 표면과 접촉하는 요소의 농도 변화와 표면 장력의 변화를 연관시키기 위해 사용되는 방정식으로, 표면 에너지의 상응하는 변화를 초래한다. 이항계통의 경우 표면과잉 측면에서 Gibbs 흡착 방정식은 다음과 같다.
어디에
흡착
인터페이스에서의 다른 영향은 표면 가까이 층의 구성에 변화를 일으킬 수 있다.[1] 물질은 표면 근처에 축적되거나 반대로 대량으로 이동할 수 있다.[1] 분자의 움직임은 흡착 현상의 특징을 나타낸다. 흡착은 표면 장력과 콜로이드 안정성의 변화에 영향을 미친다. 액체 분산매의 표면에서 Adsorption는 층들이 가장 미디어에 결과적으로 이런 지층들이 콜로이드 stability[2]에 중대한 역할을 할지도 모를 때 이 액체 상태의 국면은 인터페이스에서 액체 상태의 위상의 분자의 흡착 다른 혼합되지 않는 면을 가지는 b. 수 있접촉에서 발생하는 분산된 입자의 상호 작용에 영향을 미칠 수 있e 가스, 액체 또는 고체[3]
방정식의 개념적 설명
표면 장력은 표면의 영역을 확장하는 것이 얼마나 어려운지를 설명한다. 표면장력이 높으면 표면적을 늘리는 데 필요한 자유 에너지가 크기 때문에 표면이 고무시트처럼 수축하고 붙는 경향이 있다.
표면 장력에 영향을 미치는 요인은 다양하며, 그 중 하나는 표면의 구성이 부피와 다를 수 있다는 것이다. 예를 들어 소량의 계면활성제(예: 손비누)와 물을 섞으면 벌크수는 99%의 물분자와 1%의 비누분자일 수 있지만, 물 표면의 맨 위는 50%의 물분자와 50%의 비누분자일 수 있다. 이 경우, 비누는 크고 긍정적인 "표면 과잉"을 가진다. 다른 예에서는 표면 초과가 음수일 수 있다. 예를 들어 염화나트륨과 같은 무기염과 물을 섞으면 표면이 평균적으로 염분이 적고 질량 평균보다 순도가 높다.
비누가 조금 있는 물의 예를 다시 생각해보자. 수면에 비누의 농도가 대량보다 높아야 하기 때문에 수분의 표면적이 늘어날 때마다 대량에서 비누 분자를 제거해 새로운 표면에 첨가하는 것이 필요하다. 비누의 농도가 조금 높아지면 비누 분자는 더 쉽게 구할 수 있기 때문에(그들은 더 높은 화학적 잠재력을 가지고 있다), 새로운 표면을 만들기 위해 비누 분자를 대량에서 잡아당기는 것이 더 쉽다. 새로운 표면을 만들기 쉬우므로 표면 장력이 낮아진다. 일반적인 원칙은 다음과 같다.
- 구성 요소의 표면 초과가 양성이면 해당 구성 요소의 화학적 전위를 증가시키면 표면 장력이 감소한다.
다음은 소금을 뿌린 물의 예를 생각해 보자. 수면은 벌크보다 염분이 적어 물의 표면적이 늘어날 때마다 새로운 표면의 소금 분자를 제거하고 대량으로 밀어넣어야 한다. 소금의 농도를 약간 높이면(소금의 화학적 전위를 높이면) 소금 분자를 밀어내기가 더 어려워진다. 이제 새로운 표면을 만드는 것이 더 어려워졌기 때문에, 표면 장력은 더 높아진다. 일반적인 원칙은 다음과 같다.
- 구성 요소의 표면 초과가 음수인 경우 해당 구성 요소의 화학적 전위를 증가시키면 표면 장력이 증가한다.
Gibbs isotherm 방정식은 이러한 경향에 대한 정확한 양적 관계를 제공한다.
표면 위치 및 정의 표면 초과
표면 위치
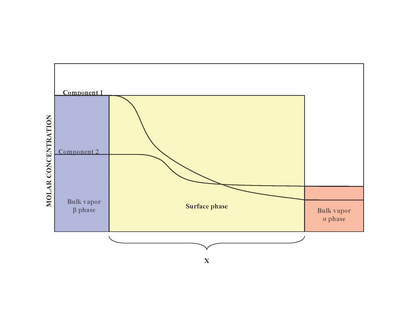
2상(α 및 β)이 있는 상태에서 표면(표면상)은 위상 α와 위상 β 사이에 위치한다. 실험적으로 둘 이상의 용액이 포함된 대량 액체 상과 접촉하는 비균형 표면 단계의 정확한 구조를 파악하기 어렵다.[2] 표면 위상의 비균형성은 몰 비 변동의 결과물이다.[1] 조시아 윌러드 깁스가 제안한 모델은 두께가 0인 이상화된 모델로서 표면상을 제안했다. 실제로 α 및 β 단계의 벌크 부위는 일정하지만, 인터페이스 부위의 성분 농도는 거리 x에 걸쳐 α의 벌크 농도부터 β의 벌크 농도까지 점차 차이가 있을 것이다. 이는 거리 x가 0의 값을 갖는 이상화된 Gibbs 모델과는 대조적이다. 오른쪽의 도표는 실제 모델과 이상화된 모델 사이의 차이를 보여준다.
표면과잉의 정의
이상화된 모델에서 α 및 β 벌크 단계의 화학적 성분은 분할 표면에 접근하는 경우를 제외하고는 변하지 않는다.[3] 모든 구성 요소의 총 몰(예: 물, 에틸렌 글리콜 등)은 대량 단계에서는 일정하게 유지되지만 실제 시스템 모델의 경우 다음과 같이 표면 단계에 따라 달라진다.
그러나 실제 시스템에서 구성 요소의 총 몰은 분할 표면의 임의적인 위치에 따라 달라진다. i번째 성분의 흡착에 대한 정량적 측정은 표면 과잉 수량에 의해 포착된다.[1] 표면 과잉은 시스템 내 i번째 성분의 총 몰과 특정 위상(α 또는 β) 내 i번째 성분의 몰 사이의 차이를 나타내며, 다음과 같이 표현된다.
여기서 γ은i i번째 성분의 표면 초과, n은 몰, α 및 β는 위상, A는 분할 표면의 영역이다.
γ은 표면까지 벌크 농도가 우세할 경우 표면의 단위 면적당 용액의 초과량을 나타내며, 양, 음 또는 0일 수 있다. 그것은 mol/m2 단위를 가지고 있다.
상대표면초과
상대 표면 초과 수량은 임의 표면 초과 수량보다 더 유용하다.[3] 상대 표면 과다는 인터페이스에서의 흡착과 벌크 단계의 용매와 관련이 있다. 상대 표면의 초과 수량을 사용하는 장점은 분할 표면의 위치에 의존하지 않는다는 것이다. 따라서 종 i와 용제 1의 상대 표면 초과량은 다음과 같다.
깁스 흡착 등식
Gibbs 흡착 방정식의 도출
위상을 나누는 표면 S와 평형 상태에서 α 및 β 위상으로 구성된 2상 시스템의 경우, 시스템의 총 Gibbs 자유 에너지는 다음과 같이 기록할 수 있다.
여기서 G는 깁스 자유 에너지다.
기브스 흡착 이소템의 방정식은 "동일한 1차 형태에 대한 오일러 정리의 열역학으로 구체화"[4]에서 도출할 수 있다. 각 위상 α, 위상 β 및 표면 위상의 Gibbs 자유 에너지는 다음과 같은 방정식으로 나타낼 수 있다.
여기서 U는 내부 에너지, p는 압력, V는 부피, T는 온도, S는 엔트로피, μ는i i번째 성분의 화학적 전위다.
α 위상, β 위상 및 표면 위상에 대한 Gibbs 방정식의 오일러 형태의 총 파생물을 취함으로써:
여기서 A는 분할면의 단면적이고, γ은 표면장력이다.
가역성 프로세스의 경우 열역학 제1법칙은 다음을 요구한다.
q는 열 에너지, w는 작업이다.
위 식을 Gibbs 에너지 방정식의 총 파생물로 대체하고 그 결과를 활용하여 surfacedA는 표면 에너지를 고려할 때 비압력 부피 작업과 동일하다.
다원체 시스템의 Gibbs 에너지의 기본 방정식을 활용함으로써:
α 위상, β 위상 및 표면 위상과 관련된 방정식은 다음과 같이 된다.
벌크 위상(α 위상, β 위상)을 고려할 때 일정한 온도와 압력에서 평형상태에서 Gibbs-Duhem 방정식은 다음을 요구한다.
결과 방정식은 Gibbs 흡착 등식이다.
Gibbs 흡착 등식은 용액의 표면 장력과 용액의 농도를 연결하는 흡착 등식으로 간주될 수 있다.
두 가지 성분을 포함하는 이항 시스템의 경우 표면 초과 측면에서 Gibbs 흡착 방정식은 다음과 같다.
표면장력과 표면초과농도와의 관계
용액에 포함된 종 i의 화학적 잠재력은 다음 방정식을 사용하는 활성 a에 따라 달라진다.[2]
여기서 μ는i i번째 성분의 화학적 전위, μ는io 기준 상태에서 i번째 성분의 화학적 전위, R은 기체 상수, T는 온도, a는i i번째 성분의 활동이다.
화학적 전위 방정식의 분화는 다음을 초래한다.
여기서 f는 성분 i의 활성계수, C는 종 i의 벌크상 농도다.
α 및 β 단계의 용액이 희석되면(특정 성분 i에 풍부) 성분 i의 활성 계수가 단결에 접근하고 Gibbs isotherm은 다음과 같이 된다.
위의 방정식은 인터페이스가 항상 참인 것은 아니지만 비차원적인 것으로 가정한다. 구겐하임과 같은 추가 모델들이 이 결함을 바로잡는다.
이온 분리 효과
전해질 흡착을 위한 Gibbs 방정식
유기 전해질 RNAz와 무기 전해질 NaCl을 포함하는 물로 구성된 시스템을 고려하십시오. 이 두 물질 모두 다음과 같이 완전히 분리된다.
상대 표면 초과에 대한 Gibbs 흡착 방정식은 다음과 같이 된다.
표면 장력과 표면 초과 농도의 관계는 다음과 같다.
여기서 m은 Gibbs 흡착 계수다.[3] m 값은 헬름홀츠, 구이, 스턴의 이중층(간격) 모델을 사용하여 계산한다.
물질은 다음과 같이 표면 장력에 다른 영향을 미칠 수 있다.
따라서, 깁스 이소템은 무기염의 표면 농도가 음이라고 예측한다. 그러나 이러한 관점은 보다 정밀한 계면 감수성 실험과 이론적 모델의 조합으로 인해 최근 몇 년 동안 광범위하게 도전되어 왔는데, 둘 다 크기와 편광성이 증가하는 할로겐화물의 표면 성향 증가를 예측하고 있다.[5] 이와 같이 표면 장력은 공기-물 인터페이스에 대한 이온의 상대적 경향을 결정하는 신뢰할 수 있는 방법이 아니다.
모델의 유효성을 입증하기 위해 표면 농도를 결정하는 방법이 필요하다: 일반적으로 두 가지 다른 기법이 사용된다: 줄임표계와 계면활성제 분자에 존재하는 C의 붕괴에 따른 것이다.
깁스는 이온계면활성제의 다른 성분이다.
이온계면활성제는 전해질이기 때문에 특별한 고려가 필요하다.
- 여분의 전해질이 없는 경우
여기서 는 계면활성제 분자의 표면 농도를 말하며, 카운터 이온을 고려하지 않는다.
- 추가된 전해질 존재
실험 방법
액체 인터페이스에서의 흡착 범위는 표면 장력 농도 데이터와 Gibbs 흡착 방정식을 사용하여 평가할 수 있다.[3] 마이크로톰 블레이드 방법은 인터페이스의 무게와 어금니 농도를 결정하는 데 사용된다. 이 방법에는 마이크로톰 블레이드를 이용한 바이너리 용액의 공기-액체 인터페이스의 1제곱미터 부분을 확보하는 것이 포함된다.
공기-물 인터페이스에서 흡착의 정도를 결정하는 또 다른 방법은 에멀전 기법인데, 에멀전 기법은 물에 관한 상대적 표면과잉을 추정하는 데 사용할 수 있다.[3]
또한 수용액에 대한 표면 활성 성분의 Gibbs 표면 초과도 방사성 추적기 방법을 사용하여 확인할 수 있다. 표면 활성 성분은 보통 탄소-14 또는 황-35로 라벨이 표시된다.[3]
참조
- ^ a b c d 슈킨, E.D., 퍼트소프, A.V., 아멜리나 E.A., 젤레네프, A.S. 콜로이드 및 표면 화학. 1부. Mobius D.와 Miller R. Vol. 12. 암스테르담: 엘시버 사이언스 2001년
- ^ a b c 히메네스, 폴 C.와 라자고팔란, 라즈. 콜로이드와 표면 화학의 원리. 제3판 뉴욕: Marcel Dekker, Inc., 1997.
- ^ a b c d e f g 채토라지, D.K.와 버디, K.S. 흡착과 깁스 표면 과잉. 뉴욕: 플레넘 출판사, 1984.
- ^ 캘런, 허버트 B. 열역학 및 온도조절기 도입. 2부. 캐나다: John Wiley & Sons, Inc., 1985.
- ^ Petersen, Poul B.; Saykally, Richard J. (2006). "On the Nature of Ions at the Liquid Water Surface". Annual Review of Physical Chemistry. 57 (1): 333–364. doi:10.1146/annurev.physchem.57.032905.104609.

 (는)
(는)  i(는) 성분 i의 표면 과잉 농도,
i(는) 성분 i의 표면 과잉 농도, i 성분 i의
i 성분 i의