물의 특성
Properties of water | |||
| | |||
 | |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름 물 | |||
| 체계적 IUPAC 이름 산화제 | |||
| 기타 이름 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 3587155 | |||
| 체비 | |||
| 켐벨 | |||
| 켐스파이더 | |||
| 117 | |||
펍켐 CID | |||
| RTECS 번호 |
| ||
| 유니 | |||
| |||
| |||
| 특성. | |||
| H 2O | |||
| 어금질량 | 18.01528(33) g/198 | ||
| 외관 | 흰색 결정체 고체, 거의 무색 액체, 파란색 무색 기체의[3] 기미가 있음 | ||
| 냄새 | 없음 | ||
| 밀도 | 액체:[4] 0°C에서 0.9998396 g/mL 25°C에서 0.9970474 g/mL 95°C에서 0.961893 g/mL 솔리드:[5] 0°C에서 0.9167 g/ml | ||
| 녹는점 | 0.00°C(32.00°F; 273.15K) | ||
| 비등점 | 99.98°C(211.96°F, 373.13K) | ||
| 해당 없음 | |||
| 용해성 | 할로알카인, 알리파틱 및 방향족 탄화수소, 에테르 등에 잘 녹지 않는다.[7]카르복실산염, 알코올, 케톤, 아민 등의 용해도 향상메탄올, 에탄올, 프로판올, 이소프로판올, 아세톤, 글리세롤, 1,4-다이옥산, 테트라하이드로푸란, 설폴레인, 아세트알데히드, 디메틸포름아미드, 디메트호옥시드, 황산화디메틸, 아세토나이트릴과 함께 부적합함.부분적으로 디에틸 에테르, 메틸 에틸 케톤, 디클로로메탄, 에틸 아세테이트, 브로민으로 잘못 사용 가능. | ||
| 증기압 | 3.1690 킬로파스칼 또는 25 °C에서[8] 0.031276 atm | ||
| 산도(pKa) | 13.995[9][10][b] | ||
| 기본성(pKb) | 13.995 | ||
| 콘게이트산 | 하이드로늄 HO3+(pKa = 0) | ||
| 콘게이트 베이스 | 수산화물 OH–(pKb = 0) | ||
| 열전도도 | 0.6065 W/(m·K)[13] | ||
굴절률(nD) | 1.3330(20°C)[14] | ||
| 점도 | 0.890 mPa/s(0.890 cP)[15] | ||
| 구조 | |||
| 육각형 | |||
| C2v | |||
| 벤트 | |||
| 1.8546 D[16] | |||
| 열화학 | |||
열 용량 (C) | 75.385 ± 0.05 J/(몰·K)[17] | ||
성 어금니 엔트로피 (S | 69.95 ± 0.03 J/(몰·K)[17] | ||
의 성 엔탈피 대형화 (ΔfH⦵298) | −285.83 ± 0.04 kJ/mol[7][17] | ||
기브스 자유 에너지 (ΔfG˚) | −237.24 kJ/mol[7] | ||
| 위험 | |||
| 산업안전보건(OHS/OSH): | |||
주요 위험 | 익사 눈사태(눈처럼) | ||
| GHS 라벨 표시:[18] | |||
| NFPA 704(화재 다이아몬드) | |||
| 플래시 포인트 | 불연성 | ||
| 안전 데이터 시트(SDS) | Sds. | ||
| 관련 화합물 | |||
기타 양이온 | 황화수소 셀레니드 수소 텔루라이드 수소 폴로니드 수소 과산화수소 | ||
관련 용매 | 아세톤 메탄올 | ||
| 부가자료페이지 | |||
| 물(데이터 페이지) | |||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
물(HO
2)은 상온에 있는 무미건조하고 무취의 액체로, 파랑의 내재된 기미와는 거의 무색이다.그것은 지금까지 가장 많이 연구된 화학 화합물이며[19] "범용 용매"[20]와 "생명의 용매"로 묘사된다.[21]그것은[22] 지구 표면에서 가장 풍부한 물질이며 지구 표면에서 고체, 액체, 기체로 존재하는 유일한 공통 물질이다.[23]우주에서 세 번째로 풍부한 분자(분자수소와 일산화탄소 뒤)이기도 하다.[22]
물 분자는 서로 수소 결합을 이루고 강한 극성을 띤다.이 극성은 소금에서 이온을 분리하고 알코올과 산과 같은 다른 극성 물질에 결합하여 분해할 수 있게 한다.수소 결합은 액체 형태보다 밀도가 낮은 고체 형태,[c] 어금니 질량 100℃의 비교적 높은 비등점, 높은 열용량 등 많은 독특한 성질을 유발한다.
물은 암페리히로, 즉 산이나 염기의 성질을 나타낼 수 있고, 그 안에 있는 용액의 pH에 따라 H와+
OH−
이온을 모두 쉽게 생산한다.[c]원형적 성격과 관련하여, 그것은 자기 이온화를 겪는다.활동의 산물 또는 대략 H와+
OH의−
농도는 상수이므로 각각의 농도는 서로 반비례한다.[24]
물리적 성질
물은 화학적 공식 HO를
2 가진 화학 물질이다; 물의 한 분자는 두 개의 수소 원자를 하나의 산소 원자에 균등하게 결합한다.[25]물은 주변 온도와 압력에서 맛이 없고 냄새가 없는 액체다.액체 상태의 물은 약 750nm의 파장에서 약한 흡수 띠를 가지고 있어 파란색으로 보인다.[3]이것은 안감이 하얀 물 욕조나 세면대에서 쉽게 관찰할 수 있다.빙하와 마찬가지로 큰 얼음 결정체도 푸른색으로 나타난다.
표준 조건에서 물은 일반적으로 기체성인 산소 계열의 다른 아날로그 하이드라이드와 달리 주로 액체다.물의 이 독특한 특성은 수소 결합 때문이다.물의 분자는 끊임없이 서로를 위해 움직이고, 수소 결합은 200 펨토초(2 × 10초−13)보다 빠른 시간대에 지속적으로 깨지고 개혁되고 있다.[26]그러나 이러한 결합은 물의 많은 독특한 성질을 만들어낼 수 있을 만큼 충분히 강하며, 그 중 일부는 물의 생명에 필수적인 성질을 만들어낸다.
물, 얼음, 증기
지구의 대기권이나 표면권 내에서 액체 위상은 가장 흔하며 일반적으로 "물"이라는 단어로 나타내는 형태다.물의 고체 위상은 얼음으로 알려져 있으며, 일반적으로 얼음 정육면체 같은 단단하고 혼합된 결정체나 눈처럼 느슨하게 축적된 세밀한 결정체의 구조를 취한다.일반적인 육각형 결정체 얼음 외에도, 얼음의 다른 결정체 및 비정형 단계가 알려져 있다.물의 기체 위상은 수증기(또는 증기)라고 알려져 있다.눈에 보이는 증기와 구름은 공기 중에 떠 있는 미세한 물방울로부터 형성된다.
물은 또한 초임계 액체를 형성한다.임계온도는 647 K이고 임계압력은 22.064 MPa이다.자연에서 이것은 극히 적대적인 조건에서만 드물게 발생한다.자연적으로 발생하는 초임계수의 유력한 예는 깊은 물 열수 분출구의 가장 뜨거운 부분에 있는데, 이 열수 분출구에서 물은 화산 연기에 의해 임계 온도로 가열되고 임계 압력은 분출구가 위치한 극한 깊이의 바다의 무게에 의해 발생한다.이 압력은 약 2200미터의 깊이에서 도달하는데, 이것은 바다의 평균 깊이(3800미터)보다 훨씬 적다.[27]
열 용량과 기화 및 융합의 가열
물은 25 °C에서 4184 J/(kg·K)의 매우 높은 고유 열용량을 가지며, 이는 모든 이형 원자종(암모니아 이후) 중 두 번째로 높은 수치화 열(정상 비등점에서는 40.65 kJ/mol 또는 2257 kJ/kg)이며, 이 두 가지 모두 분자 간의 광범위한 수소 결합의 결과물이다.이 두 가지 특이한 성질은 물의 온도가 큰 변동을 완충함으로써 지구의 기후를 온화하게 한다.1970년 이후 기후 시스템에 저장된 추가 에너지의 대부분은 바다에 축적되었다.[28]
물의 핵융합(잠열로 더 많이 알려진)의 특정 엔탈피는 0°C에서 333.55 kJ/kg이다. -160 °C에서 녹는 지점까지의 따뜻한 얼음이나 약 80 °C의 동일한 양의 물을 가열하는 데 동일한 에너지가 필요하다.일반적인 물질 중 암모니아 물질만이 더 높다.이 성질은 빙하와 표류 얼음 위에서 녹는 것에 대한 저항을 준다.기계식 냉동기의 출현 이전과 이후, 얼음은 음식의 부패를 늦추는데 공통적으로 사용되고 있다.
-10 °C에서 얼음의 특정 열 용량은 2030 J/(kg·K),[29] 100 °C에서 증기의 열 용량은 2080 J/(kg·K)이다.[30]
물과 얼음의 밀도
물의 밀도는 입방 센티미터 당 약 1 그램이다.[31] 이 관계는 원래 그램을 정의하기 위해 사용되었다.밀도는 온도에 따라 달라지지만 선형적인 것은 아니다: 온도가 증가하면 밀도가 3.98°C(39.16°F)에서 최고로 상승했다가 감소한다.[32] 이는 이례적이다.[d]규칙적이고 육각형의 얼음은 또한 액체 물보다 밀도가 낮다. 얼면 물의 밀도는 약 9%[35][e] 감소한다.
이러한 영향은 냉각을 통한 열운동의 감소로 인해 물 분자가 더 많은 수소 결합을 형성하여 분자가 서로 가까이 접근하지 못하도록 하기 때문이다.[32]0-4°C 범위에서 난방에 의한 수소 결합의 파괴는 열 운동(액체를 팽창시키는 경향이 있음)의 증가에도 불구하고 물 분자가 더 가깝게 포장을 할 수 있게 하고, 온도가 증가함에 따라 4°C 이상의 물이 팽창한다.[32]끓는점 근처의 물은 4°C(39°F)에서 물보다 약 4% 덜 밀도가 낮다.[35][f]
증가하는 압력 하에서 얼음은 얼음 II, 얼음 III, 고밀도 아모르퍼스 얼음(HDA), 고밀도 아모르퍼스 얼음(VHDA)과 같이 액체 물보다 밀도가 높은 다른 폴리모르퍼스로의 많은 전환을 겪는다.[36][37]
물보다 더 낮은 얼음의 밀도와 비정상적인 밀도 곡선은 지구 생명체의 많은 부분에 필수적이다. 만약 물이 얼기 지점에서 가장 밀도가 높다면, 겨울에 호수 표면과 다른 수역의 매우 차가운 물이 가라앉을 것이고, 호수는 바닥에서 위로 얼어서 그 안의 모든 생명체가 죽게 될 것이다.[35]게다가, 물이 좋은 단열재임을 감안할 때, (열 용량 때문에), 일부 얼어붙은 호수는 여름에 완전히 녹지 않을 수도 있다.[35]꼭대기에 떠 있는 얼음 층은 아래의 물을 단열한다.[38]약 4 °C(39 °F)의 물도 바닥으로 가라앉아 물의 온도가 바닥에서 일정하게 유지된다(도표 참조).[35]
소금물과 얼음의 밀도

소금물의 밀도는 온도는 물론 용해된 소금 함량에 따라 달라진다.얼음은 여전히 바다에 떠다닌다. 그렇지 않으면, 얼음은 밑에서 위로 얼어버릴 것이다.그러나 바다의 염분 함량은 약 1.9°C의[39] 빙점을 낮추고(설명은 여기를 참조) 0°C의 이전 빙점까지의 물의 밀도 최대 온도를 낮춘다.바닷물에서 차가운 물의 하향 대류가 빙점 부근으로 차가워지면서 물의 팽창에 의해 차단되지 않는 이유다.빙점 부근의 대양의 차가운 물은 계속 가라앉는다.그래서 북극해와 같은 차가운 바다 밑바닥에서 사는 생물들은 일반적으로 얼어붙은 민물 호수나 강 바닥보다 4 °C 더 추운 물에서 산다.
소금물의 표면이 얼기 시작하면서(일반 염도 해수의 경우 -1.9[39]℃, 3.5%) 형성되는 얼음은 기본적으로 염분이 없고, 담수 얼음과 거의 같은 밀도를 갖는다.이 얼음은 표면 위에 떠 있고, "얼음질쳐 나가는" 소금은 그 바로 아래에 있는 바닷물의 염도와 밀도를 더해주는데, 이것은 브라인 거부반응이라고 알려진 과정이다.이 밀도가 높은 염수는 대류에 의해 가라앉고 바닷물을 대체하는 것도 같은 과정을 거쳐야 한다.이것은 표면에서 -1.9 °C의[39] 담수 얼음을 생성한다.형성되는 얼음 아래의 바닷물의 밀도가 증가하면 그것이 바닥을 향해 가라앉게 된다.대규모로 브라인 거부반응과 차가운 짠물 가라앉는 과정으로 인해 해양조류가 형성되어 그러한 물을 폴란드로부터 멀리 운반하게 되며, 열전류 순환이라 불리는 전지구적 조류체계가 형성된다.
부정확성 및 응축
물은 에탄올을 포함한 많은 액체와 함께 섞일 수 있다.물과 대부분의 기름은 대개 위에서부터 밀도가 증가함에 따라 층을 형성한다.이것은 극성을 비교함으로써 예측할 수 있다.비교적 극성 화합물인 물은 에탄올이나 아세톤과 같은 극성이 높은 액체로 잘못 전달되는 경향이 있는 반면 극성이 낮은 화합물은 탄화수소와 같이 불연성 및 용해성이 떨어지는 경향이 있다.
기체로서 수증기는 공기와 완전히 어긋난다.반면 주어진 온도에서 액체(또는 고체)로 열역학적으로 안정된 최대 수증기 압력은 총 대기압에 비해 상대적으로 낮다.예를 들어 수증기의 부분 압력이 대기압의 2%이고 공기가 25℃에서 냉각되면 약 22℃의 물에서 시작하여 응축하기 시작하여 이슬점을 정의하고 안개나 이슬을 발생시킨다.그 반대의 과정은 아침에 안개가 타는 것을 설명해준다.예를 들어 뜨거운 샤워나 목욕을 하는 등 상온에서 습도가 높아져 온도가 거의 변하지 않으면 수증기는 곧 위상 변화를 위한 압력에 도달한 다음 보통 증기라고 하는 미세한 물방울로 응축된다.
포화 가스 또는 상대습도가 100%인 가스는 공기 중 물의 증기압이 (액체) 물로 인해 증기 압력과 평형 상태일 때, 포화 공기에 노출되었을 때 수분(또는 얼음, 충분히 차가우면)이 증발에 의해 질량이 감소하지 않는 것을 말한다.공기 중의 수증기 양이 적기 때문에 수증기로 인한 부분압력 대 포화 부분증기압의 비율인 상대습도가 훨씬 유용하다.상대습도 100%를 넘는 증기압을 과포화라고 하며, 예를 들어 상승기류에서 갑자기 상승하는 등 공기가 급속 냉각되면 발생할 수 있다.[g]
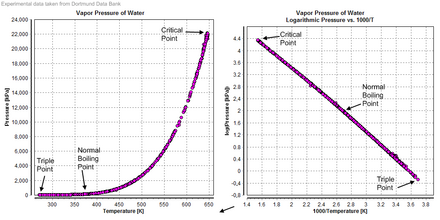
증기압
압축성
물의 압축성은 압력과 온도의 함수다.0°C에서 0압력의 한계에서 압축성은 5.1×10Pa이다−10−1.영압 한계치에서 압축성은 45 °C 전후로 최소 4.4−10×10−1 Pa에 도달한 후 온도가 증가하면서 다시 증가한다.압력이 증가하면 압축성은 감소하여 0°C에서 3.9×10Pa−10−1, 100메가파스칼(1,000bar)이 된다.[40]
물의 대량 계수는 약 2.2 GPA이다.[41]가스가 아닌 것, 특히 물의 압축성이 낮으면 가스가 압축되지 않는 것으로 간주되는 경우가 많다.물의 압축성이 낮다는 것은 압력이 40 MPa인 4km 깊이의 심해에서도 부피가 1.8% 감소하는 데 그치는 것을 의미한다.[41]
물 얼음의 벌크 계수는 0K의 11.3 GPA에서 273K의 8.6 GPA까지 다양하다.[42]온도의 함수로서 얼음의 압축성이 큰 변화는 다른 일반적인 고형물에 비해 상대적으로 큰 열팽창계수의 결과물이다.
트리플 포인트
보통의 고형수, 액체수, 기체수가 평형상태에서 공존하는 온도와 압력은 물의 3중점이다.1954년부터 이 지점은 온도의 기본 단위인 켈빈을[43][44] 정의하기 위해 사용되었으나, 2019년부터는 물의 3중 지점이 아닌 볼츠만 상수를 사용하여 켈빈을 정의한다.[45]
얼음의 많은 폴리모프(형태)가 존재하기 때문에 물은 다른 3중점을 가지고 있는데, 3중점은 얼음의 폴리모프 3개 또는 얼음과 액체의 폴리모프 2개가 평형상태로 가지고 있다.[44]괴팅겐의 구스타프 하인리히 요한 아폴론 탐만(Gustav Hinrich Johann Apolon Tammann)은 20세기 초 여러 다른 3중점에 대한 자료를 만들었다.캄브 등은 1960년대에 3배 이상의 점수를 기록하였다.[46][47][48]
| 안정 평형에서의 위상 | 압력 | 온도 |
|---|---|---|
| 액체 물, 얼음h I, 수증기 | 611[49].657 파 | 273.16K(0.01°C) |
| 액체 물, 얼음h I, 얼음 III | 209.9 MPa | 251 K(-22 °C) |
| 액체 물, 얼음 III, 얼음 V | 350.1 MPa | -17.0°C |
| 액체 물, 얼음 V, 얼음 VI | 632.4 MPa | 0.16°C |
| Iceh, Ice II, Ice III | MPa 213 | -35°C |
| ice II, ice III, ice V | 344 MPa | -24°C |
| 아이스 II, 아이스 V, 아이스 VI | MPa 626 | -70°C |
녹는점
얼음의 녹는점은 표준 압력에서 0 °C(32 °F; 273 K)이지만, 액체가 기계적으로 방해를 받지 않는 경우 순수 액체 물은 동결하지 않고 그 온도보다 훨씬 낮게 냉각될 수 있다.그것은 약 231 K(-42 °C; -44 °F)[50]의 균일한 핵 지점까지 유체 상태로 유지될 수 있다.평범한 육각형 얼음의 용해점. 적당히 높은 압력 약간 밑도, 0.0073°(0.0131 °F)[h]또는 약 0.5°(0.90 °F)/70 atm[나는][51]으로 수소 결합의 안정화 에너지 분자 간 반발에 의해 초과하지만 209.9 MPa를 위와 같이 그것의 동소체에 얼음 변환( 보는 결정질 상태의 얼음)(2,072 떨어진다. 현금하고압력[52], 즉 2.216 GPA(21,870 atm)에서 355 K(82 °C)에 이르는 용해 지점이 눈에 띄게 증가한다.
전기적 특성
전기 전도도
외생 이온이 없는 순수한 물은 뛰어난 전자 절연체지만 '이온화'된 물조차 이온이 완전히 없는 것은 아니다.물은 두 개의 물 분자가 하나의 수산화 음이온(OH−
)과 하나의 하이드로늄 양이온(HO
3+
)을 형성하면 액체 상태에서 자동이온화를 겪는다.자동이온화 때문에 주변 온도에서 순수 액체 상태의 물은 반도체 게르마늄과 내적 충전 캐리어 농도가 유사하고 내적 충전 캐리어 농도가 반도체 실리콘보다 3배 이상 높기 때문에 충전 캐리어 농도에 근거하면 물을 c로 볼 수 없다.완전 유전체 재료 또는 전기 절연체 그러나 이온 전하의 제한된 도체여야 한다.[53]
물은 매우 좋은 용매이기 때문에, 거의 항상 약간의 용액이 용해되어 있고, 종종 소금을 가지고 있다.만약 물이 아주 적은 양의 불순물을 가지고 있다면, 이온들은 전하를 앞뒤로 운반할 수 있어, 물이 훨씬 더 쉽게 전기를 전도할 수 있다.
물의 이론적 최대 전기저항은 25 °C에서 약 18.2 MΩ·cm(182 kΩ·m)인 것으로 알려져 있다.[54]이 수치는 예를 들어 반도체 제조 공장에서 사용되는 역삼투, 초 여과 및 탈이온 초순수 시스템에서 흔히 볼 수 있는 것과 잘 일치한다.그렇지 않으면 초순수에서 염분 또는 산성 오염물질 수준이 조 당 100ppt(ppt)까지 초과하면 몇 kΩ·m까지 내성이 눈에 띄게 낮아지기 시작한다.[citation needed]
순수한 물에서 민감한 장비는 25.00 °C에서 0.05501 ± 0.0001 μS/cm의 매우 미세한 전기전도도를 감지할 수 있다.[54]물은 또한 산소와 수소 가스로 전해질 수 있지만 용존 이온이 없을 때는 전류가 거의 전도되지 않기 때문에 이것은 매우 느린 과정이다.얼음에서 1차 전하 캐리어는 양성자(양자 도체 참조)[55]이다.얼음은 이전에는 1×10−10 S/cm의 작지만 측정할 수 있는 전도성을 가지고 있다고 생각되었지만, 이 전도성은 이제 거의 전적으로 표면 결함에 기인한다고 생각되고 있으며, 그것들 없이는 얼음은 헤아릴 수 없이 작은 전도성을 가진 절연체라고 할 수 있다.[32]
극성과 수소 결합
물의 중요한 특징은 극성이다.그 구조는 산소 꼭지점에서 두 개의 수력관을 위한 구부러진 분자 기하학을 가지고 있다.산소 원자는 또한 두 쌍의 전자를 가지고 있다.일반적으로 단독 쌍에 기인하는 한 가지 효과는 H-O-H 기체 위상 굽힘 각도가 104.48°[56]로 일반적인 사면각 109.47°보다 작다는 것이다.외로운 쌍들은 수력갱에 접합된 전자 시그마보다 산소 원자에 더 가깝기 때문에 더 많은 공간이 필요하다.외로운 쌍의 반발 증가는 O-H 결합을 서로 더 가깝게 만든다.[57]
그것의 구조의 또 다른 결과는 물이 극성 분자라는 것이다.전기성의 차이로 인해 결합 쌍극자 모멘트는 각 H에서 O까지 가리키며 산소는 부분적으로 음극이고 각 수소는 부분적으로 양극이 된다.큰 분자 쌍극자는 두 수소 원자 사이의 영역에서 산소 원자까지 가리킨다.전하 차이로 인해 물 분자가 응집된다(상대적으로 음의 영역에 끌리는 양적인 영역).이 매력인 수소 결합은 물의 용매 특성 같은 많은 특성들을 설명한다.[58]
수소 결합은 물 분자 자체 내의 공밸런스 결합에 비해 상대적으로 약한 끌어당김이지만, 물의 물리적 특성 중 몇 가지를 담당한다.이러한 특성에는 비교적 높은 용해와 끓는점 온도가 포함된다. 물 분자 사이의 수소 결합을 깨는데 더 많은 에너지가 필요하다.반면 황화수소(HS
2)는 유황의 전기성이 낮아 수소 결합이 훨씬 약하다.HS는
2 황화수소의 어금니 질량이 거의 두 배나 되는 물임에도 불구하고 상온에서 기체다.물 분자 간의 추가적인 결합은 또한 액체 상태의 물에게 큰 특정한 열 용량을 준다.이 높은 열 용량은 물을 좋은 열 저장 매체(냉각재)와 열 차폐로 만든다.
응집력 및 접착력
물 분자는 물 분자 사이의 수소 결합의 집단적 작용으로 인해 서로 가까이 머문다(코션).이러한 수소 결합은 끊임없이 깨지고, 다른 물 분자와 새로운 결합이 형성된다; 그러나 액체 물의 표본에서 주어진 시간에, 분자의 많은 부분이 그러한 결합에 의해 함께 결합된다.[59]
물 역시 극성을 띠기 때문에 부착력이 높다.깨끗하고 매끄러운 유리에서는 유리와 물 분자 사이의 분자력(접착력)이 응집력보다 강하기 때문에 물이 얇은 막을 형성할 수도 있다.[citation needed]생물 세포와 유기체에서 물은 친수성 물질인 막과 단백질 표면, 즉 물에 강한 흡인력을 가진 표면에 접촉한다.어빙 랭뮤어는 친수성 표면 사이에서 강한 반발력을 관찰했다.수화 표면의 탈수(강하게 유지되는 물의 층을 제거하기 위해)를 위해서는 수화력이라고 불리는 이러한 힘에 대해 상당한 작업을 수행해야 한다.이러한 힘은 매우 크지만 나노미터 이하에서 급격히 감소한다.[60]그것들은 생물학에서 특히 건조한 대기에 노출되거나 세포외 결빙에 의해 세포가 탈수될 때 중요하다.[61]
표면장력

물은 25°C에서[62] 71.99mN/m의 비정상적으로 높은 표면 장력을 가지는데, 이는 물 분자 간의 수소 결합 강도에 의해 발생한다.[63]이것은 곤충들이 물 위를 걸을 수 있게 해준다.[63]
모세관 작용
물은 응집력과 접착력이 강하기 때문에 모세관 작용을 보인다.[64]수소 결합과 접착으로 인한 응집력이 강해 나무가 100m 이상 물을 위로 운반할 수 있다.[63]
용제로서의 물
물은 유전체 상수가 높기 때문에 뛰어난 용매다.[65]잘 섞여서 물에 녹는 물질을 친수성 물질("물 사랑")이라고 하며, 물과 잘 섞이지 않는 물질은 친수성 물질("물 공포성")이라고 한다.[66]물에서 용해되는 물질의 능력은 물 분자가 다른 물 분자 사이에서 생성하는 강한 매력적 힘과 물질이 일치할 수 있는지 혹은 더 나은지에 의해 결정된다.만약 어떤 물질이 강한 분자간 힘을 극복하지 못하게 하는 성질을 가지고 있다면, 그 분자들은 물에서 분출된다.일반적인 오해와는 달리 물과 소수성 물질은 "반복"되지 않으며, 소수성 표면의 수화는 정력적이지만 엔트로피적으로 유리하지는 않다.
이온화합물이나 극성화합물이 물에 들어가면 물분자(수분자)에 둘러싸여 있다.비교적 작은 크기의 물 분자(~3개의 앙스트롬)는 많은 물 분자가 하나의 용액 분자를 둘러싸게 한다.물의 부분적으로 음극성 쌍극성 단부는 용액의 양전하 구성 요소에 끌리고, 반대로 양극성 단부는 양전하 구성성분극성 단부에 끌린다.
일반적으로 산, 알코올, 소금 등 이온성 물질과 극성 물질은 물에 비교적 용해되며 지방, 기름 등 비극성 물질은 그렇지 않다.비극성 분자는 물 속에 함께 머문다. 왜냐하면 그것은 물 분자가 비극성 분자와 반 데르 발스 상호작용을 하는 것보다 서로 수소 결합에 더 에너지적으로 유리하기 때문이다.
이온 용액의 예로는 식탁용 소금을 들 수 있다; 염화 나트륨 NaCl은 Na+
양이온과 Cl−
음이온으로 나뉘는데, 각각은 물 분자에 둘러싸여 있다.그러면 이온들은 결정 격자로부터 용액으로 쉽게 운반된다.비이온 용해제의 한 예는 식탁용 설탕이다.물두덩이는 설탕 분자(OH 그룹)의 극지방과 수소 결합을 만들어 용액으로 운반할 수 있게 한다.
양자 터널링
물 속에서 양자 터널링 역학 관계가 빠르면 1992년에 보고되었다.당시 대체수 단층기의 내부 회전으로 약한 수소 결합을 파괴하고 재생시키는 움직임이 있는 것으로 알려졌다.[67]2016년 3월 18일에는 물 헥사머에 양자 터널을 뚫으면 수소 결합이 깨질 수 있다는 보고가 있었다.이전에 보고된 물 속에서 터널링 동작과는 달리, 이것은 두 개의 수소 결합을 함께 끊는 것을 포함한다.[68]같은 해 말, 물 분자의 양자 터널링 발견이 보고되었다.[69]
전자기 흡수
물은 가시광선, 자외선 근처, 원적외선 등에 비교적 투명하지만 자외선, 적외선, 전자파를 대부분 흡수한다.대부분의 광수용체와 광합성 색소는 물을 통해 잘 전달되는 광 스펙트럼의 부분을 이용한다.전자레인지 오븐은 물의 불투명성을 이용하여 음식 안의 물을 데우기 위해 전자레인지 복사를 한다.물의 연한 청색은 가시 스펙트럼의 적색 부분에서의 약한 흡수에 의해 발생한다.[3][70]
구조

단일 물 분자는 산소 쌍을 이용해 2개의 결합을 받아들이고 2개의 수소 원자를 기증할 수 있기 때문에 최대 4개의 수소 결합에 참여할 수 있다.불화수소, 암모니아, 메탄올과 같은 다른 분자도 수소 결합을 형성할 수 있다.그러나 이 중 수소 원자를 기증하거나 수용하지 못하거나 부피가 큰 잔류물에서 steric 효과가 나타나는 수소 결합은 4가지 수소 결합을 형성할 수 없기 때문에 물에서 관찰된 것과 같은 비정상적인 열역학, 운동학적 또는 구조적 특성을 나타내지 않는다.물속에서는 4개의 수소결합으로 인해 분자간 사면체 구조가 형성되어 개방적인 구조와 3차원 접합망을 형성하여 4℃ 이하로 냉각하면 비정상적인 밀도 감소가 일어난다.이 반복적이고 지속적으로 재편성되는 유닛은 액체 전체에 걸쳐 확장되는 3차원 네트워크를 정의한다.이 견해는 중성자 산란 연구와 컴퓨터 시뮬레이션에 기초하고 있으며, 얼음 구조물에 있는 물 분자의 애매모호한 사면배열을 볼 때 타당하다.
그러나 물의 구조에 대한 대안 이론이 있다.2004년, 스톡홀름 대학의 논쟁적인 논문은 액체 상태의 물 분자가 일반적으로 4개가 아니라 2개의 다른 분자와 결합하여 사슬과 고리를 형성한다고 제안했다.물의 끈 이론(물리의 끈 이론과 혼동하지 말 것)이라는 말이 생겨났다.이러한 관측은 개별 산소 원자의 국부 환경을 조사한 X선 흡수 분광법에 기초하였다.[71]
분자구조
산소 원자에 대한 두 외로운 쌍의 반발 효과는 물을 선형이 아닌 구부러진 분자 구조를 가지게 하여 극성을 갖게 한다.[72]수소-산소-수소 각도는 104.45°로 이상적인 sp3 하이브리드화의 109.47°보다 작다.발란스 결합 이론의 설명은 산소 원자의 단독 쌍이 물리적으로 더 크기 때문에 산소 원자가 수소 원자에 결합하는 것보다 더 많은 공간을 차지한다는 것이다.[73]분자 궤도 이론 설명(벤트의 법칙)은 산소 원자의 비결합 혼합 궤도(더 많은 문자, 더 적은 p 문자를 할당하여)의 에너지를 낮추고 그에 상응하여 수소 원자에 결합한 산소 원자의 혼합 궤도(더 많은 p 문자를 할당하고 더 적은 문자를 할당하여)의 에너지를 상승시키는 것이다.r) 산소 원자의 비결합 하이브리드 궤도 에너지는 산소 원자의 단독 궤도 에너지에 완전히 기여하는 반면, 산소 원자의 다른 두 하이브리드 궤도 에너지는 결합 궤도 에너지(기존 궤도)에 부분적으로만 기여하기 때문에 점유된 분자 궤도의 에너지를 낮추는 순 효과가 있다.수소 원자의 1초 궤도로부터 오는 나머지 기여).
화학적 특성
자기이온화
액체 물에는 약간의 자기 이온이 있어 하이드로늄 이온과 수산화 이온을 제공한다.
- 2 H
2O ⇌ H
3O+
+ OH−
물의 이온성 산물로 알려진 이 반응의 평형 상수 K =[ + [ O - {−14중성 pH에서 수산화물 이온(OH−
)의 농도는 (용납) 수소 이온(H+
)의 농도와 같으며, 값은 25°C에서 10−7 mol−1 L에 가깝다.[74]다른 온도에서의 값은 데이터 페이지를 참조하십시오.
열역학적 평형 상수는 물을 포함한 모든 제품 및 반응제의 열역학적 활성의 몫이다.
그래서 우리는 Keq≈ Kw)[H3O+][OH−]{\displaystyle K_{\rm{eq} 간단한 이온 곱을 얻는다 하지만 희석된 해결책을, 물 분자 또는 OH−과 같은 용질의 활동 집중에 의해 용매 H2O의 활동 1로 잡는다,}}-경우{\rm{H_{3}O^{\approx K_{\rm{w}는다.+}}}
지구화학
오랜 시간 동안 바위에 물이 작용하면 일반적으로 풍화작용과 물침식, 고체 바위와 미네랄을 토양과 침전물로 바꾸는 물리적 과정이 발생하지만, 어떤 조건에서는 물과 화학반응이 일어나면서 암석의 화학적 변화인 메타소모티즘이나 미네랄 하이드레이션을 초래하기도 한다.점토 광물을 채굴하다포틀랜드 시멘트가 굳을 때도 발생한다.
물의 얼음은 쇄석액 하이드레이트로 알려진 쇄석액 화합물을 형성할 수 있으며, 넓은 크리스털 격자 안에 다양한 작은 분자를 내장할 수 있다.이 중 가장 눈에 띄는 것은 메탄 크라스트레이트, 4 CH-23이다
4.HO
2, 해저에서 자연적으로 대량으로 발견된다.
자연의 산성
비는 일반적으로 약한 산성으로, 이산화탄소보다 강한 산을 가지고 있지 않을 경우 pH가 5.2에서 5.8 사이에 있다.[75]만약 공기 중에 많은 양의 질소와 황산화물이 존재한다면, 그것들 역시 구름과 빗방울로 용해되어 산성비를 발생시킬 것이다.
동위원소
수소와 산소의 동위원소가 여러 개 존재하여 알려진 물의 동위원소 몇 개를 생성한다.비엔나 표준 해양 평균 물은 현재 물 동위원소의 국제 표준이다.자연적으로 발생하는 물은 거의 완전히 중성자 없는 수소 동위원소 프로튬으로 구성된다.중성자 1개를 가진 수소 동위원소인 중수소(2
H 또는 D)가 155ppm에 불과하고 중성자 2개를 가진 삼중수소(3
H 또는 T)가 1조당 20ppm 미만이다.산소는 또한 3개의 안정된 동위원소를 가지고 있는데, O는 99.76%, O는 0.04%, O는 물 분자의 0.2%에 존재한다.[76]
중수소 산화물, DO는
2 밀도가 높아 중수로도 알려져 있다.원자로에서 중성자 감속재로 사용된다.삼중수소는 방사성 물질이며, 반감기가 4500일로 붕괴된다; THO는 자연에서 미세한 양으로만 존재하며, 주로 대기 중 우주 광선 유도 핵 반응을 통해 생성된다.양성자 1개와 중수소 HDO 1개를 가진 물은 저농도(0.03%)와 DO
2(0.000003%)에서 보통수에서 자연적으로 발생하며, 그러한 분자는 원자가 재결합하면서 일시적이다.
HO와
2 DO의
2 가장 눈에 띄는 물리적 차이는 특정 질량의 단순한 차이 외에 동결, 비등과 같은 수소 결합의 영향을 받는 특성 및 기타 운동 효과를 포함한다.중수소의 핵이 프로토늄보다 두 배나 무겁고, 이는 본딩 에너지에 현저한 차이를 일으키기 때문이다.끓는점의 차이는 동위원소를 분리할 수 있게 한다.25 °C에서
2 HO의 자가투과계수는 DO
2 값보다 23% 높다.[77]수분자가 수소원자를 서로 교환하기 때문에 순수 일산화탄소 DO보다
2 저순도 중수에서 수소중수소산화물(DOH)이 훨씬 일반적이다.
순수하게 격리된 DO의
2 소비는 생화학적 과정에 영향을 미칠 수 있다 – 다량의 섭취는 신장 및 중추신경계 기능을 손상시킨다.적은 양을 아무런 나쁜 영향 없이 소비할 수 있다; 인간은 일반적으로 맛의 차이를 알지 못하지만,[78] 때로는 타는 듯한[79] 느낌이나 달콤한 맛을 보고한다.[80]독성이 드러나려면 매우 많은 양의 중수를 소비해야 한다.그러나 쥐는 냄새로 중수를 피할 수 있고, 많은 동물들에게 독성이 있다.[81]
경수는 중수소 함량이 기준치인 155ppm 이하로 줄어든 물인 중수소(DDW)를 말한다.
발생
물은 지구상에서 가장 풍부한 물질이자 우주에서 세 번째로 풍부한 분자로, 지구 질량의 [22]H와
2 CO 0.23ppm에 이어 지구 질량 1.38×10km의93 97.39%가 바다에서 발견된다.[82]
반응
산-기저반응
물은 원형질이다: 물은 화학 반응에서 산이나 염기 역할을 할 수 있는 능력을 가지고 있다.[83]브뢰네스트-로리 정의에 따르면 산은 양성자(H+
) 기증자, 염기(base)는 양성자 수용자(proton acceptor)이다.[84]더 강한 산과 반응할 때 물은 기초 역할을 하고, 더 강한 염기와 반응할 때는 산 역할을 한다.[84]예를 들어, 물은 염산이 형성되었을 때 HCl로부터 H이온을+
받는다.
- + ⇌ H
3O+
+ Cl−
암모니아, NH와의
3 반응에서 물은 H+
이온을 공급하며, 따라서 산으로 작용한다.
- + ⇌ NH+
4 + OH−
물 속의 산소 원자는 두 쌍의 외로운 쌍을 가지고 있기 때문에 물은 루이스 산과 반응하여 루이스 산과 반응하여 종종 루이스 베이스 또는 전자 페어 공여자의 역할을 하며, 비록 루이스 베이스와 반응하여 전자 페어 공여자와 물의 수소 원자 사이에 수소 결합을 형성할 수도 있다.HSAB 이론은 물을 약한 경산(hard acid)과 약한 경질(hard base) 둘 다로 설명하고 있는데, 이는 물이 다른 경질종과 우선적으로 반응한다는 것을 의미한다.
- + → H
3O+
- + → Fe(H
2O)3+
6
- + → Cl(H
2O)−
6
약한 산이나 약한 염기의 소금이 물에 녹으면, 물은 부분적으로 염분을 가수분해하여 해당 염기 또는 산을 생성하여 비누와 베이킹 소다의 수용액을 기본 pH로 한다.
- Na
2CO
3 + H
2O ⇌ NaOH + NaHCO
3
리간드 화학
워터 루이스의 베이스 캐릭터는 전환 금속 콤플렉스에서 흔히 볼 수 있는 리간드로, 그 예로는 페(HO
2)2+
6에서 페르헤닉산(perrhenic acid)과 같은 금속 아쿠오 콤플렉스가 있는데, 여기에는 레늄 센터로 조정된 두 개의 물 분자가 포함되어 있다.고체 하이드레이트에서 물은 리간드가 될 수도 있고 단순히 틀에 박혀 있을 수도 있고 둘 다일 수도 있다.그러므로 FeSO
4/7HO는
2 [Fe2(HO2)]62+센터와 1개의 "attice water"로 구성되어 있다.물은 전형적으로 단수 리간드(monodentate ligand), 즉 중심 원자와 단 하나의 결합만을 형성한다.[85]

유기 화학
단단한 기초로서 물은 유기 탄화수소와 쉽게 반응한다. 예를 들어 수화 반응에서, 탄화수소 이중 결합에서 서로 결합되는 두 탄소 원자에 히드록실 그룹(OH−
)과 산성 양성자가 추가되어 알코올이 발생한다.유기 분자에 물을 더하면 분자가 둘로 갈라질 때 가수분해가 일어난다고 한다.가수 분해의 주목할 만한 예로는 지방의 비누화와 단백질과 다당류의 소화가 있다.물은 또한 S2N 치환과 E2 제거 반응에서 이탈군이 될 수 있다; 후자는 탈수 반응으로 알려져 있다.
리독스 반응에서의 물
물은 산화상태 +1의 수소와 산화상태 -2의 산소를 함유하고 있다.[86]그것은 수화물, 알칼리 금속, 그리고 일부 알칼리성 토금속과 같은 화학물질을 산화시킨다.[87][88]알칼리 금속이 물과 반응하는 한 예는 다음과 같다.[89]
- 2 Na + 2 H
2O → H
2 + 2 Na+
+ 2 OH−
알루미늄과 베릴륨과 같은 다른 반응성 금속들도 물에 의해 산화되지만, 그들의 산화물은 금속과 결합하여 수동적인 보호층을 형성한다.[90]철의 녹슬기는 철과 산소의[91] 반응이지 철과 물 사이에 녹는 것이 아니라는 점에 유의한다.
물은 산화되어 산소 가스를 방출할 수 있지만 O
2/HO의
2 잠재력보다 감소 가능성이 더 크더라도 물과 반응하는 산화물은 거의 없다.거의 모든 그러한 반응은 촉매를 필요로 한다.[92]물의 산화의 예는 다음과 같다.
- 4 AgF
2 + 2 H
2O → 4 AgF + 4 HF + O
2
전기분해
물은 전류를 통과시켜 구성 요소, 수소, 산소로 나눌 수 있다.[93]이 과정을 전기분해라고 한다.음극 반작용은 다음과 같다.
- 2H+
2 + 2−
e → H
양극 반작용은 다음과 같다.
- 2 H
2O → O
2 + 4 H+
+ 4
e−
이 가스들은 표면으로 거품을 만들어 냈는데, 만약 이것이 의도였다면 물 위의 불꽃으로 모아지거나 점화될 수 있었다.순수수의 전기분해에 필요한 전위는 25 °C에서 1.23 V이다.[93]작동 전위는 실제 전기분해가 1.48V 이상이다.
역사
헨리 카벤디시는 1781년에 물이 산소와 수소로 구성되어 있다는 것을 보여주었다.[94]수소와 산소로 물을 전기분해에 의해 처음으로 분해한 것은 1800년 영국의 화학자 윌리엄 니콜슨과 앤서니 칼리슬에 의해 이루어졌다.[94][95]1805년 조셉 루이스 게이 루삭과 알렉산더 폰 훔볼트는 물이 2부분의 수소와 1부분의 산소로 이루어져 있다는 것을 보여주었다.[96]
길버트 뉴턴 루이스는 1933년에 최초의 순수 중수 샘플을 분리했다.[97]
물의 특성은 역사적으로 다양한 온도 눈금을 정의하는데 사용되어 왔다.특히 켈빈, 섭씨, 랭킨, 화씨 비늘은 물의 동결점과 비등점에 의해 정의되거나 현재 정의된다.델리즐, 뉴턴, 레아우무르, 뢰머의 덜 일반적인 척도는 유사하게 정의되었다.물의 3중점은 오늘날 더 흔히 사용되는 표준점이다.
명명법
수용된 IUPAC 명칭은 산화제 또는 단순 물이며,[98] 분자를 설명하는 데 사용될 수 있는 다른 체계적 명칭도 있지만, 다른 언어로 동등한 명칭이다.옥사인은 대체 명명법에 의해 물의 파생물 이름을 명명하는 데 사용되는 단핵성 모체 하이드라이드의 이름으로만 사용되도록 되어 있다.[99]이러한 파생상품은 일반적으로 다른 권장 명칭을 가지고 있다.예를 들어 –OH 그룹에 대해서는 oxideanyl보다 hydroxyl이라는 이름이 권장된다.옥산이라는 이름은 이미 테트라히드롭라이란으로도 알려진 순환 에테르 이름이기 때문에 IUPAC에 의해 이러한 목적에 적합하지 않은 것으로 명시적으로 언급되고 있다.[100][101]
물의 가장 단순한 체계적 이름은 산화수소다.이는 과산화수소, 황화수소, 중수소(중수) 등 관련 화합물과 유사하다.이온성 이온성 화합물에 화학적 명칭을 사용하면 물이 일산화탄소라는 이름을 갖게 되지만,[102] 이는 국제순수화학연합(IUPAC)이 발표한 명칭에는 포함되지 않는다.[98]또 다른 이름은 일산화탄소(dihydrogilis)로, 거의 사용되지 않는 물의 이름이며, 주로 일산화탄소 패러디에서 사용된다.
물의 다른 체계적 이름으로는 산과 염기 이름을 사용하는 수산화 수소, 수산화 수소 등이 있다.[j]이러한 이국적인 이름들 중 널리 쓰이는 것은 없다.물 분자의 편광 형태인 HOH는+
−
IUPAC 명명법에 의해 수산화수소로 불리기도 한다.[103]
물 물질은 액체 물, 증기, 얼음의 어떤 형태 또는 혼합물이나 광물의 성분을 말하는지 명시하고 싶지 않을 때 산화수소(HO2)에 사용되는 용어다.
참고 항목
각주
- ^ a b 교정에 사용되는 Vienna Standard Mean Ocean Water(VSMOW)는 273.1500089(10) K(0.000089(10) °C)에서 녹고 373.1339 K(99.9839 °C)에서 끓인다.다른 동위원소 성분은 약간 다른 온도에서 녹거나 끓인다.
- ^ 물의 pK를a 위해 유기화학에 주로 사용되는 15.7의 일반적으로 인용되는 값은 부정확하다.[11][12]
- ^ a b H+는 HO
3+
(HO
2)
n와 형성되는 더 복잡한 이온을 나타낸다. - ^ 녹은 실리카에서도 음의 열팽창이 관찰된다.[33]또한, 꽤 순수한 실리콘은 약 18에서 120 켈빈 사이의 온도에 대해 열팽창 계수가 음수다.[34]
- ^ Other substances that expand on freezing are silicon (melting point of 1,687 K (1,414 °C; 2,577 °F)), gallium (melting point of 303 K (30 °C; 86 °F), germanium (melting point of 1,211 K (938 °C; 1,720 °F)), and bismuth (melting point of 545 K (272 °C; 521 °F))
- ^ (1-0.95865/1.00000) × 100% = 4.135%
- ^ 이상적인 가스 법칙에서 비롯되는 단열 냉각
- ^ 선원은 이를 0.0072°C/atm으로 제공한다.그러나 저자는 분위기를 100만 dynes/cm2(바)로 정의한다.대기의 표준 정의인 1,013,250 dynes/cm를2 사용하여 0.0073°C/atm까지 작동한다.
- ^ 0.5/0.0073 = 68.5라는 사실 사용.
- ^ 산과 염기성 모두 암페리히(산이나 알칼리 둘 다로 반응할 수 있음)이기 때문에 물을 위해 존재한다.
참조
메모들
- ^ "naming molecular compounds". www.iun.edu. Archived from the original on 24 September 2018. Retrieved 1 October 2018.
Sometimes these compounds have generic or common names (e.g., H2O is "water") and they also have systematic names (e.g., H2O, dihydrogen monoxide).
- ^ "Definition of Hydrol". Merriam-Webster. Retrieved 21 April 2019.
- ^ a b c Braun, Charles L.; Smirnov, Sergei N. (1993-08-01). "Why is water blue?" (PDF). Journal of Chemical Education. 70 (8): 612. Bibcode:1993JChEd..70..612B. doi:10.1021/ed070p612. ISSN 0021-9584.
- ^ Riddick 1970, Table of Physical Properties, Water 0b. 페이지 67-8.
- ^ Lide 2003, 섹션 6의 얼음 및 과냉각수 특성.
- ^ 린스트롬의 물, Peter J.; Mallard, William G. (eds.); NIST 화학 웹북, NIST 표준 참조 데이터베이스 번호 69, 국립 표준 기술 연구소, Gaithersburg(MD), http://webbook.nist.gov
- ^ a b c Anatolievich, Kiper Ruslan. "Properties of substance: water".
- ^ Lide 2003, 0 ~ 370°C의 6초 물의 증기 압력.
- ^ Lide 2003, 8장: 무기산과 염기의 분리 상수.
- ^ 웨인게르트너 외 2016, 페이지 13.
- ^ "What is the pKa of Water". University of California, Davis. 2015-08-09.
- ^ Silverstein, Todd P.; Heller, Stephen T. (17 April 2017). "pKa Values in the Undergraduate Curriculum: What Is the Real pKa of Water?". Journal of Chemical Education. 94 (6): 690–695. Bibcode:2017JChEd..94..690S. doi:10.1021/acs.jchemed.6b00623.
- ^ Ramires, Maria L. V.; Castro, Carlos A. Nieto de; Nagasaka, Yuchi; Nagashima, Akira; Assael, Marc J.; Wakeham, William A. (1995-05-01). "Standard Reference Data for the Thermal Conductivity of Water". Journal of Physical and Chemical Reference Data. 24 (3): 1377–1381. Bibcode:1995JPCRD..24.1377R. doi:10.1063/1.555963. ISSN 0047-2689.
- ^ Lide 2003, 8—수성 용액의 농축 특성:밀도, 굴절률, 동결점 우울증, 점도.
- ^ 리데 2003, 6.186.
- ^ Lide 2003, 9—Dipole Moments.
- ^ a b c 린스트롬의 물, Peter J.; Mallard, William G. (eds.); NIST 화학 웹북, NIST 표준 참조 데이터베이스 번호 69, 국립 표준 기술 연구소, Gaithersburg(MD), http://webbook.nist.gov
- ^ GHS: 퍼브켐 962
- ^ 그린우드 & 어니쇼 1997, 페이지 620.
- ^ "Water, the Universal Solvent". U.S. Department of the Interior. usgs.gov (website). United States of America: USGS. October 22, 2019. Retrieved December 15, 2020.
- ^ 리스 외 2013, 페이지 48.
- ^ a b c 웨인게르트너 외 2016, 페이지 2
- ^ 리스 외 2013, 페이지 44.
- ^ "Autoprotolysis constant". IUPAC Compendium of Chemical Terminology. IUPAC. 2009. doi:10.1351/goldbook.A00532. ISBN 978-0-9678550-9-7.
- ^ 캠벨, 윌리엄슨 & 헤이든 2006.
- ^ Smith, Jared D.; Christopher D. Cappa; Kevin R. Wilson; Ronald C. Cohen; Phillip L. Geissler; Richard J. Saykally (2005). "Unified description of temperature-dependent hydrogen bond rearrangements in liquid water" (PDF). Proc. Natl. Acad. Sci. USA. 102 (40): 14171–14174. Bibcode:2005PNAS..10214171S. doi:10.1073/pnas.0506899102. PMC 1242322. PMID 16179387.
- ^ Deguchi, Shigeru; Tsujii, Kaoru (2007-06-19). "Supercritical water: a fascinating medium for soft matter". Soft Matter. 3 (7): 797–803. Bibcode:2007SMat....3..797D. doi:10.1039/b611584e. ISSN 1744-6848. PMID 32900070.
- ^ Rhein, M.; Rintoul, S.R. (2013). "3: Observations: Ocean" (PDF). IPCC WGI AR5 (Report). p. 257.
Ocean warming dominates the global energy change inventory. Warming of the ocean accounts for about 93% of the increase in the Earth's energy inventory between 1971 and 2010 (high confidence), with the warming of the upper (0 to 700 m) ocean accounting for about 64% of the total. Melting ice (including Arctic sea ice, ice sheets, and glaciers) and warming of the continents and atmosphere account for the remainder of the change in energy.
- ^ Lide 2003, 6장: 얼음과 과냉각수의 특성
- ^ Lide 2003, 6. 온도와 압력의 함수로서의 물과 증기의 특성
- ^ "Decree on weights and measures". April 7, 1795. Archived from the original on February 25, 2013. Retrieved August 3, 2016.
Gramme, le poids absolu d'un volume d'eau pure égal au cube de la centième partie du mètre, et à la température de la glace fondante.
- ^ a b c d 그린우드 & 어니쇼 1997, 페이지 625.
- ^ Shell, Scott M.; Debenedetti, Pablo G.; Panagiotopoulos, Athanassios Z. (2002). "Molecular structural order and anomalies in liquid silica" (PDF). Phys. Rev. E. 66 (1): 011202. arXiv:cond-mat/0203383. Bibcode:2002PhRvE..66a1202S. doi:10.1103/PhysRevE.66.011202. PMID 12241346. S2CID 6109212. Archived from the original (PDF) on 2016-06-04. Retrieved 2009-07-07.
- ^ Bullis, W. Murray (1990). "Chapter 6". In O'Mara, William C.; Herring, Robert B.; Hunt, Lee P. (eds.). Handbook of semiconductor silicon technology. Park Ridge, New Jersey: Noyes Publications. p. 431. ISBN 0-8155-1237-6. Retrieved 2010-07-11.
- ^ a b c d e Perlman, Howard. "Water Density". The USGS Water Science School. Retrieved 2016-06-03.
- ^ Loerting, Thomas; Salzmann, Christoph; Kohl, Ingrid; Mayer, Erwin; Hallbrucker, Andreas (2001-01-01). "A second distinct structural "state" of high-density amorphous ice at 77 K and 1 bar". Physical Chemistry Chemical Physics. 3 (24): 5355–5357. Bibcode:2001PCCP....3.5355L. doi:10.1039/b108676f. ISSN 1463-9084.
- ^ 그린우드 & 어니쇼 1997, 페이지 624.
- ^ 줌달 & 줌달 2013, 페이지 493.
- ^ a b c "Can the ocean freeze?". National Ocean Service. National Oceanic and Atmospheric Administration. Retrieved 2016-06-09.
- ^ Fine, R.A.; Millero, F.J. (1973). "Compressibility of water as a function of temperature and pressure". Journal of Chemical Physics. 59 (10): 5529. Bibcode:1973JChPh..59.5529F. doi:10.1063/1.1679903.
- ^ Neumeier, J.J. (2018). "Elastic Constants, Bulk Modulus, and Compressibility of H2O Ice Ih for the Temperature Range 50 K-273 K". Journal of Physical and Chemical Reference Data. 47 (3): 033101. Bibcode:2018JPCRD..47c3101N. doi:10.1063/1.5030640. S2CID 105357042.
- ^ "Base unit definitions: Kelvin". National Institute of Standards and Technology. Retrieved 9 August 2018.
- ^ a b 웨인게르트너 외 2016, 페이지 5
- ^ Proceedings of the 106th meeting (PDF). International Committee for Weights and Measures. Sèvres. 16–20 October 2017.
- ^ Schlüter, Oliver (2003-07-28). "Impact of High Pressure — Low Temperature Processes on Cellular Materials Related to Foods" (PDF). Technischen Universität Berlin. Archived from the original (PDF) on 2008-03-09.
{{cite journal}}:Cite 저널은 필요로 한다.journal=(도움말) - ^ Tammann, Gustav H.J.A (1925). "The States Of Aggregation". Constable And Company.
{{cite journal}}:Cite 저널은 필요로 한다.journal=(도움말) - ^ 루이스 & 라이스 1922.
- ^ Murphy, D. M. (2005). "Review of the vapour pressures of ice and supercooled water for atmospheric applications". Quarterly Journal of the Royal Meteorological Society. 131 (608): 1539–1565. Bibcode:2005QJRMS.131.1539M. doi:10.1256/qj.04.94.
- ^ Debenedetti, P. G.; Stanley, H. E. (2003). "Supercooled and Glassy Water" (PDF). Physics Today. 56 (6): 40–46. Bibcode:2003PhT....56f..40D. doi:10.1063/1.1595053.
- ^ 샤프 1988, 페이지 27.
- ^ "Revised Release on the Pressure along the Melting and Sublimation Curves of Ordinary Water Substance" (PDF). IAPWS. September 2011. Retrieved 2013-02-19.
- ^ C. S. 풀러 "반도체의 결함 상호작용" 5장 192-221 "반도체" N. B. Hannay Ed.라인홀드, 1959년 뉴욕
- ^ a b Light, Truman S.; Licht, Stuart; Bevilacqua, Anthony C.; Morash, Kenneth R. (2005-01-01). "The Fundamental Conductivity and Resistivity of Water". Electrochemical and Solid-State Letters. 8 (1): E16–E19. doi:10.1149/1.1836121. ISSN 1099-0062.
- ^ Crofts, A. (1996). "Lecture 12: Proton Conduction, Stoichiometry". University of Illinois at Urbana-Champaign. Retrieved 2009-12-06.
- ^ Hoy, AR; Bunker, PR (1979). "A precise solution of the rotation bending Schrödinger equation for a triatomic molecule with application to the water molecule". Journal of Molecular Spectroscopy. 74 (1): 1–8. Bibcode:1979JMoSp..74....1H. doi:10.1016/0022-2852(79)90019-5.
- ^ 줌달 & 줌달 2013, 페이지 393.
- ^ 캠벨 & 파렐 2007년 37~38페이지.
- ^ 캠벨 & 리스 2009, 페이지 47.
- ^ Chiavazzo, Eliodoro; Fasano, Matteo; Asinari, Pietro; Decuzzi, Paolo (2014). "Scaling behaviour for the water transport in nanoconfined geometries". Nature Communications. 5: 4565. Bibcode:2014NatCo...5.4565C. doi:10.1038/ncomms4565. PMC 3988813. PMID 24699509.
- ^ "Physical Forces Organizing Biomolecules" (PDF). Biophysical Society. Archived from the original on August 7, 2007.
{{cite web}}: CS1 maint : 부적합한 URL(링크) - ^ Lide 2003, 일반 액체의 표면 장력.
- ^ a b c 리스 외 2013, 페이지 46.
- ^ 줌달 & 줌달 2013, 페이지 458–459.
- ^ 그린우드 & 어니쇼 1997, 페이지 627.
- ^ 줌달 & 줌달 2013, 페이지 518.
- ^ Pugliano, N. (1992-11-01). "Vibration-Rotation-Tunneling Dynamics in Small Water Clusters". Lawrence Berkeley Lab., CA (United States): 6. doi:10.2172/6642535. OSTI 6642535.
{{cite journal}}:Cite 저널은 필요로 한다.journal=(도움말) - ^ Richardson, Jeremy O.; Pérez, Cristóbal; Lobsiger, Simon; Reid, Adam A.; Temelso, Berhane; Shields, George C.; Kisiel, Zbigniew; Wales, David J.; Pate, Brooks H.; Althorpe, Stuart C. (2016-03-18). "Concerted hydrogen-bond breaking by quantum tunneling in the water hexamer prism". Science. 351 (6279): 1310–1313. Bibcode:2016Sci...351.1310R. doi:10.1126/science.aae0012. ISSN 0036-8075. PMID 26989250.
- ^ Kolesnikov, Alexander I. (2016-04-22). "Quantum Tunneling of Water in Beryl: A New State of the Water Molecule". Physical Review Letters. 116 (16): 167802. Bibcode:2016PhRvL.116p7802K. doi:10.1103/PhysRevLett.116.167802. PMID 27152824.
- ^ Pope; Fry (1996). "Absorption spectrum (380-700nm) of pure water. II. Integrating cavity measurements". Applied Optics. 36 (33): 8710–23. Bibcode:1997ApOpt..36.8710P. doi:10.1364/ao.36.008710. PMID 18264420.
- ^ Ball, Philip (2008). "Water—an enduring mystery". Nature. 452 (7185): 291–292. Bibcode:2008Natur.452..291B. doi:10.1038/452291a. PMID 18354466. S2CID 4365814.
- ^ Gonick, Larry; Criddle, Craig (2005-05-03). "Chapter 3 Togetherness". The cartoon guide to chemistry (1st ed.). HarperResource. p. 59. ISBN 9780060936778.
Water, H2O, is similar. It has two electron pairs with nothing attached to them. They, too, must be taken into account. Molecules like NH3 and H2O are called bent.
- ^ Theodore L. Brown; et al. (2015). "9.2 The Vsepr Model". Chemistry : the central science (13 ed.). p. 351. ISBN 978-0-321-91041-7. Retrieved 21 April 2019.
Notice that the bond angles decrease as the number of nonbonding electron pairs increases. A bonding pair of electrons is attracted by both nuclei of the bonded atoms, but a nonbonding pair is attracted primarily by only one nucleus. Because a nonbonding pair experiences less nuclear attraction, its electron domain is spread out more in space than is the electron domain for a bonding pair (Figure 9.7). Nonbonding electron pairs, therefore, take up more space than bonding pairs; in essence, they act as large and fatter balloons in our analogy of Figure 9.5. As a result, electron domains for nonbonding electron pairs exert greater repulsive forces on adjacent electron domains and tend to compress bond angles
- ^ 보이드 2000 페이지 105.
- ^ 보이드 2000, 페이지 106.
- ^ "Guideline on the Use of Fundamental Physical Constants and Basic Constants of Water" (PDF). IAPWS. 2001.
- ^ Hardy, Edme H.; Zygar, Astrid; Zeidler, Manfred D.; Holz, Manfred; Sacher, Frank D. (2001). "Isotope effect on the translational and rotational motion in liquid water and ammonia". J. Chem. Phys. 114 (7): 3174–3181. Bibcode:2001JChPh.114.3174H. doi:10.1063/1.1340584.
- ^ Urey, Harold C.; et al. (15 Mar 1935). "Concerning the Taste of Heavy Water". Science. Vol. 81, no. 2098. New York: The Science Press. p. 273. Bibcode:1935Sci....81..273U. doi:10.1126/science.81.2098.273-a.
- ^ "Experimenter Drinks 'Heavy Water' at $5,000 a Quart". Popular Science Monthly. Vol. 126, no. 4. New York: Popular Science Publishing. Apr 1935. p. 17. Retrieved 7 Jan 2011.
- ^ Müller, Grover C. (June 1937). "Is 'Heavy Water' the Fountain of Youth?". Popular Science Monthly. Vol. 130, no. 6. New York: Popular Science Publishing. pp. 22–23. Retrieved 7 Jan 2011.
- ^ Miller, Inglis J., Jr.; Mooser, Gregory (Jul 1979). "Taste Responses to Deuterium Oxide". Physiology & Behavior. 23 (1): 69–74. doi:10.1016/0031-9384(79)90124-0. PMID 515218. S2CID 39474797.
- ^ 웨인게르트너 외 2016, 페이지 29.
- ^ 줌달 & 줌달 2013, 페이지 659.
- ^ a b 줌달 & 줌달 2013, 페이지 654.
- ^ 줌달 & 줌달 2013, 페이지 984.
- ^ 줌달 & 줌달 2013, 페이지 171.
- ^ "Hydrides". Chemwiki. UC Davis. 2 October 2013. Retrieved 2016-06-25.
- ^ 줌달 & 줌달 2013, 페이지 932, 936.
- ^ 줌달 & 줌달 2013, 페이지 338.
- ^ 줌달 & 줌달 2013, 페이지 862.
- ^ 줌달 & 줌달 2013, 페이지 981.
- ^ 샬럿 2007, 페이지 275.
- ^ a b 줌달 & 줌달 2013, 페이지 866.
- ^ a b 그린우드 & 어니쇼 1997, 페이지 601.
- ^ "Enterprise and electrolysis..." Royal Society of Chemistry. August 2003. Retrieved 2016-06-24.
- ^ "Joseph Louis Gay-Lussac, French chemist (1778–1850)". 1902 Encyclopedia. Footnote 122-1. Retrieved 2016-05-26.
- ^ Lewis, G. N.; MacDonald, R. T. (1933). "Concentration of H2 Isotope". The Journal of Chemical Physics. 1 (6): 341. Bibcode:1933JChPh...1..341L. doi:10.1063/1.1749300.
- ^ a b 레이, 파브르 & 메타넘스키 1998, 페이지 34.
- ^ IUPAC 2005, 페이지 85.
- ^ 레이, 파브르 & 메타넘스키 1998, 페이지 99.
- ^ "Tetrahydropyran". Pubchem. National Institutes of Health. Retrieved 2016-07-31.
- ^ 레이, 파브르 & 메타넘스키 1998, 페이지 27–28.
- ^ "Compound Summary for CID 22247451". Pubchem Compound Database. National Center for Biotechnology Information.
참고 문헌 목록
- Boyd, Claude E. (2000). "pH, Carbon Dioxide, and Alkalinity". Water Quality. Boston, Massachusetts: Springer. pp. 105–122. doi:10.1007/978-1-4615-4485-2_7. ISBN 9781461544852.
- Campbell, Mary K.; Farrell, Shawn O. (2007). Biochemistry (6th ed.). Cengage Learning. ISBN 978-0-495-39041-1.
- Campbell, Neil A.; Reece, Jane B. (2009). Biology (8th ed.). Pearson. ISBN 978-0-8053-6844-4.
- Campbell, Neil A.; Williamson, Brad; Heyden, Robin J. (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 978-0-13-250882-7.
- Charlot, G. (2007). Qualitative Inorganic Analysis. Read Books. ISBN 978-1-4067-4789-8.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- International Union of Pure and Applied Chemistry (2005-11-22). Nomenclature of Inorganic Chemistry: IUPAC Recommendations 2005 (PDF). Royal Society of Chemistry. ISBN 978-0-85404-438-2. Retrieved 2016-07-31.
- Leigh, G. J.; Favre, H. A; Metanomski, W. V. (1998). Principles of chemical nomenclature: a guide to IUPAC recommendations (PDF). Oxford: Blackwell Science. ISBN 978-0-86542-685-6. OCLC 37341352. Archived from the original (PDF) on 2011-07-26.
- Lewis, William C.M.; Rice, James (1922). A System of Physical Chemistry. Longmans, Green and Co.
- Lide, David R. (2003-06-19). CRC Handbook of Chemistry and Physics, 84th Edition. CRC Handbook. CRC Press. ISBN 9780849304842.
- Reece, Jane B.; Urry, Lisa A.; Cain, Michael L.; Wasserman, Steven A.; Minorsky, Peter V.; Jackson, Robert B. (2013-11-10). Campbell Biology (10th ed.). Boston, Mass.: Pearson. ISBN 9780321775658.
- Riddick, John (1970). Organic Solvents Physical Properties and Methods of Purification. Techniques of Chemistry. Wiley-Interscience. ISBN 978-0471927266.
- Sharp, Robert Phillip (1988-11-25). Living Ice: Understanding Glaciers and Glaciation. Cambridge University Press. p. 27. ISBN 978-0-521-33009-1.
- Weingärtner, Hermann; Teermann, Ilka; Borchers, Ulrich; Balsaa, Peter; Lutze, Holger V.; Schmidt, Torsten C.; Franck, Ernst Ulrich; Wiegand, Gabriele; Dahmen, Nicolaus; Schwedt, Georg; Frimmel, Fritz H.; Gordalla, Birgit C. (2016). "Water, 1. Properties, Analysis, and Hydrological Cycle". Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA. doi:10.1002/14356007.a28_001.pub3. ISBN 9783527306732.
- Zumdahl, Steven S.; Zumdahl, Susan A. (2013). Chemistry (9th ed.). Cengage Learning. ISBN 978-1-13-361109-7.
추가 읽기
- Ben-Naim, A. (2011), Molecular Theory of Water and Aqueous Solutions, World Scientific
외부 링크
| 위키미디어 커먼즈에는 워터 분자와 관련된 미디어가 있다. |
| 위키미디어 커먼즈에는 워터 다이어그램과 관련된 미디어가 있다. |
| Wikiversity는 엔지니어링 열역학/스팀 표에 대한 학습 리소스를 가지고 있다. |
- "Water Properties and Measurements". United States Geological Survey. May 2, 2016. Retrieved August 31, 2016.
- 일반용수 및 과학용수물질의 열역학적 특성에 관한 IAPWS 제1995호 방출(심플러 제제)
- IAPWS 부가 릴리즈 0.1 MPa, 2008년 9월
- Chaplin, Martin (2019). "Structure and Properties of Water in its Various States". Encyclopedia of Water. Wiley Online Library 2019. pp. 1–19. doi:10.1002/9781119300762.wsts0002. ISBN 9781119300755. S2CID 213738895.
- 물의 증기압력, 액체밀도, 동적 액체점도, 표면장력 계산
- 수밀도 계산기
- 왜 내 음료에 얼음이 떠있는가?, 나사는?













![K_{{{\rm {w}}}}=[{{\rm {{H_{3}O^{+}}}}}][{{\rm {{OH^{-}}}}}]](https://wikimedia.org/api/rest_v1/media/math/render/svg/86dca39006c4f875cacc14395c7ff6e38a09d990)



