전립선암
Prostate cancer| 전립선암 | |
|---|---|
| 기타 이름 | 전립선암 |
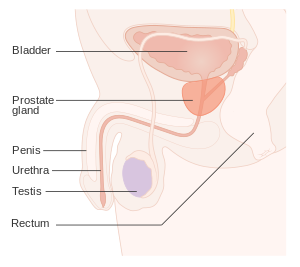 | |
| 전립선의 위치 | |
| 전문 | 종양학, 비뇨기과 |
| 증상 | 일반적으로 없음.때때로 소변 문제, 발기부전 또는 허리/골반 통증이 있습니다. |
| 정상발현 | 나이 > 40세 |
| 위험요소 | 나이, 가족력, 인종 |
| 진단법 | PSA 테스트 후 조직 생검 |
| 감별진단 | 양성 전립선비대증 |
| 치료 | 능동 감시, 전립선 절제, 방사선 치료, 호르몬 치료, 화학 요법 |
| 예후 | 단계에 따라 5년 생존율 97%[1] |
| 빈도수. | 연간[2] 약 120만 건의 새로운 사례 |
| 데스 | 연간[2] 약 350,000개 |
전립선암은 방광 바로 아래에 있는 남성 생식계의 샘인 전립선에서 세포의 통제되지 않은 성장을 말합니다.초기 전립선암은 보통 증상이 없습니다.종양이 커지면서 주변 장기에 손상을 줘 발기부전, 소변이나 정액 속 혈액, 소변 문제 등을 일으킬 수 있습니다.일부 종양은 결국 신체의 다른 영역, 특히 뼈와 림프절로 퍼집니다.그곳에서, 종양은 심각한 뼈 통증, 다리의 허약함 또는 마비, 그리고 결국 죽음을 초래합니다.
전립선암의 대부분의 경우는 전립선암 검진 프로그램에 의해 발견됩니다.이것들은 일반적으로 전립선암 또는 전립선에 영향을 미치는 다른 조건을 가진 사람들에서 증가하는 전립선 특이 항원 (PSA)의 수준에 대한 정기적인 혈액 검사에 의존합니다.선별 검사는 또한 두드러진 전립선 종양을 느끼기 위한 디지털 직장 검사를 포함할 수 있습니다.최종 진단을 위해서는 전립선 생검이 필요합니다.의심되는 종양의 샘플은 병리학자에 의해 현미경으로 검사됩니다.암이 있는 경우 병리학자는 글리슨 점수를 6점에서 10점으로 매기고, 더 높은 점수는 더 위험한 종양을 나타냅니다.의료 영상은 전립선 밖으로 전이된 암을 찾기 위해 수행됩니다.글리슨 점수, PSA 수준 및 영상 결과를 기반으로 암 환자에게 단계가 할당됩니다.더 높은 단계는 더 진행되고 더 위험한 질병을 의미합니다.
대부분의 전립선 종양은 작고 건강상의 문제를 일으키지 않습니다.이것들은 종양이 성장하지 않았는지 확인하기 위해 정기적인 검사로 종양을 모니터링하는 능동적인 감시로 관리됩니다.위험할 가능성이 더 높은 종양은 방사선 치료로 파괴되거나 근본적인 전립선 절제술로 외과적으로 제거될 수 있습니다.암이 재발하거나 전립선 밖으로 이미 전이된 사람들은 전립선 세포가 생존하기 위해 필요한 남성 호르몬의 수치를 낮추는 호르몬 치료를 받습니다.이것은 종양의 성장을 잠시 멈추지만, 결국 암세포는 이 치료법에 내성을 갖게 됩니다.거세 저항성 전립선암이라고 불리는 이 질병의 가장 진보된 단계는 화학 요법 약물인 도코텔과 함께 지속적인 호르몬 치료로 치료됩니다.전립선암의 예후는 진단 시 암이 얼마나 멀리 퍼졌는지에 따라 달라집니다.대부분의 남성들은 전립선에 국한된 종양으로 진단을 받습니다; 그들 중 99%는 진단 후 10년 이상 생존합니다.먼 신체 부위로 전이된 종양은 5년 생존율이 30~40%로 가장 위험합니다.
전립선암 발병 위험은 나이가 들수록 높아지며, 진단 평균 연령은 67세입니다.전립선암 가족력이 있는 사람들은 아프리카계 미국인 남성들과 마찬가지로 전립선암에 걸릴 가능성이 더 높습니다.매년 120만 건의 전립선암이 진단되고 35만 명이 이 [2]질병으로 사망하며 남성 암과 암 사망의 두 번째 주요 원인이 됩니다.남성 8명 중 1명은 평생 전립선암 진단을 받는 반면, 40명 중 1명은 이 [3]병으로 사망합니다.전립선 종양은 처음에는 희귀한 것으로 여겨졌는데, 1893년의 한 보고서는 의학 문헌에 단지 50건의 사례를 기술했습니다.수술이 보편화되면서 전립선 종양은 나이가 들면서 커진 전립선의 수술 표본에서 발견되었습니다.그 질병을 치료하기 위한 수술과 방사선 치료 방법은 20세기에 걸쳐 개발되었습니다.전립선 종양의 남성 성 호르몬에 대한 비정상적인 필요성과 전립선암에 대한 호르몬 치료법의 개발을 설명하는 주요 연구는 찰스 B. 1966년 노벨 생리학·의학상을 수상했으며, 안제이 W. 샐리는 1977년 노벨 생리학·의학상을 수상했습니다.
징후 및 증상
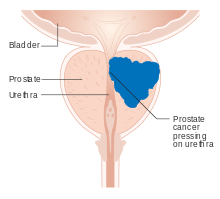
전립선암의 대부분의 경우는 종양이 너무 작아서 어떤 [4]증상도 유발할 수 없을 때 선별 검사를 통해 진단됩니다.종양이 전립선 너머로 자라면서, 발기부전, 소변 또는 정액 속의 혈액, 또는 소변 문제를 야기하는 근처의 장기들을 손상시킬 수 있습니다 – 종종 소변이 자주 나오고 소변 흐름이 [4]느리거나 약합니다.50세 이상의 남성의 절반 이상이 어떤 형태의 배뇨 [5]문제를 경험하는데, 일반적으로 양성 전립선 과형성(비암성 [4]전립선 비대)과 같은 전립선암 이외의 문제 때문입니다.
진행된 전립선 종양은 골반과 등의 근처 뼈로 전이될 수 있습니다; 그곳에서 그것들은 휴식, 피로 또는 설명할 수 없는 체중 [6]감소와 함께 개선되지 않는 요통이나 뼈 통증을 야기할 수 있습니다.전이가 되면 주변 뼈가 손상될 수 있고 전이성 전립선암 환자의 4분의 1 정도가 [7]골절상을 입을 수 있습니다.전이가 증가하면 다리와 발에 힘이 없거나 사지 [8][9]마비를 일으키는 척수를 압박할 수도 있습니다.
심사
전립선암 검진은 증상이 없는 사람들의 종양을 찾습니다.선별 검사는 치료의 혜택을 받을 고위험 암에 걸린 남성과 종양의 성장이 느리고 [10]건강에 영향을 미치지 않을 가능성이 있는 남성을 분리하는 것을 목표로 합니다.이것은 일반적으로 전립선암이나 양성 전립선 [11][10][12]비대증으로 인해 전립선이 비대해진 사람들에서 증가하는 단백질 전립선 특이 항원(PSA)의 수준에 대한 혈액 검사를 통해 수행됩니다.평균적인 사람의 혈액은 밀리리터(mL)당 약 1나노그램(ng)의 PSA를 [13]검사합니다.PSA 수치가 평균 이하인 사람들은 향후 8년에서 10년 [13]동안 위험한 전립선암에 걸릴 가능성이 매우 낮습니다.PSA가 3ng/mL 이상인 남성은 위험이 증가합니다; 30%는 전립선암에 걸릴 것이고, 10%[14]는 치료가 필요한 고급 암에 걸릴 것입니다.PSA 수준이 4ng/mL 이상인 사람들은 전립선 생검을 위해 종종 언급되지만, 이 고위험군에서도 대부분의 생검은 전립선암에 [15]음성입니다.PSA 수치가 평균보다 [16]높은 남성은 전립선암과 무관하게 PSA 수치가 변동할 수 있기 때문에 4주에서 6주 후에 혈액 검사를 반복할 것을 권장합니다.PSA가 증가한 사람들은 사람이 공격적인 전립선암에 걸릴 가능성을 더 잘 예측하기 위해 PSA와 다른 혈액 단백질의 하위 유형을 측정하는 2차 선별 혈액 검사를 받을 수 있습니다. 4K 점수, 전립선 건강 지수, ExoDx 전립선 검사 및 SelectMDx는 이 목적을 위해 [17]모두 사용할 수 있습니다.
몇몇 큰 연구들은 전립선암 검사를 받은 남성들이 질병으로 [18]사망할 위험이 줄어든다는 것을 발견했습니다. 하지만 그렇지 않았다면 건강에 영향을 미치지 않았을 암 사례를 발견하면 불안감을 유발할 수 있고 불필요한 생체 검사와 [10]치료로 이어질 수 있습니다.주요 국가 보건 기구들은 조기 진단의 이점과 종양이 [10]건강에 영향을 미칠 가능성이 없는 사람들을 치료하는 잠재적인 해악의 균형을 맞추기 위해 다양한 권장 사항을 제공합니다.많은 국가 보건 기관은 상당한 건강 수명이 남아 있을 것으로 예상하고 의료 기관의 검진 위험에 대해 잘 알고 있는 40세 이상 남성에게 전립선암 검진을 권장합니다.미국 예방 서비스 특별 위원회와 미국 비뇨기과 협회는 55세에서 69세 사이의 남성들에게 그 위험과 [18]이점을 알리기 위해 상담 후 검진을 제공할 것을 권고합니다.두 사람 모두 70세 이후의 PSA 검사에 반대할 것을 권장합니다. 검사에서 검출된 종양은 너무 느리게 성장하여 이 남성들의 [19]건강에 영향을 줄 가능성이 낮기 때문입니다.캐나다 비뇨기과 협회(CUA)는 50세 남성에게 최소 10년 이상의 기대 수명이 있는 경우 검진을 제공할 것을 권장합니다.전립선암 가족력이 있는 남성의 경우,[18] CUA는 45세에 검진을 받을 것을 권장합니다.마찬가지로, 유럽 비뇨기학 협회, 유럽 방사선 치료 및 종양학 협회, 국제 노인 종양학 협회는 50세 이상의 남성, 전립선암 가족력이 있는 남성 또는 45년 이상의 아프리카 혈통에 대해 PSA 검사를 권장합니다.그리고 40세에 암과 관련된 BRCA2 변종을 가진 남성들; 그들이 적어도 10년의 [18]기대 수명을 가진다면 모두.일본비뇨기학회는 적어도 50세 이상의 남성과 40세부터 [18]시작되는 전립선암 가족력이 있는 남성에게 PSA 검사를 권고합니다.캐나다 예방 의료 특별 위원회는 전립선암 [18]검진에 반대할 것을 권고합니다.거의 유사한 선별 지침에도 불구하고 선별의 흡수는 지역에 따라 다릅니다. 미국과 서유럽에서 80% 이상의 남성이 선별되고 일본에서 20% 이상의 남성이 선별되며 인간 개발 지수가 [18]낮은 지역에서는 선별이 거의 없습니다.
진단.
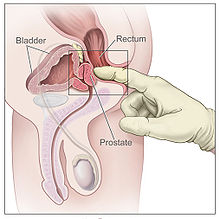
전립선암에 걸린 것으로 의심되는 남성들은 전립선을 평가하는 것을 돕기 위해 몇 가지 검사를 받을 수 있습니다.하나의 일반적인 절차는 의사가 가까운 [20][21]전립선을 느끼기 위해 윤활된 손가락을 직장에 삽입하는 디지털 직장 검사입니다.종양은 전립선의 나머지 부분에 뻣뻣하고 불규칙한 모양의 덩어리처럼 느껴집니다.전립선의 경화는 양성 전립선 비대증에 의한 것일 수도 있습니다; 직장 검사에서 비정상적인 소견을 가진 사람들 중 약 20-25%가 전립선암입니다.[22]
전립선암의 진단은 전립선의 생검을 필요로 합니다.전립선 생체검사는 일반적으로 직장이나 회음부를 통과하는 바늘에 의해 이루어지며, 직장 초음파 영상, 자기공명영상(MRI) 또는 이 [23][21]둘의 조합에 의해 유도됩니다.종양을 [21]발견할 가능성을 높이기 위해 전립선의 여러 부위에서 10-12개의 샘플을 채취합니다.생체검사는 존재하는 암세포의 종류와 범위를 결정하는 병리학자에 의해 현미경으로 검사됩니다.암은 먼저 현미경으로 그들의 외모에 따라 분류됩니다.전립선암의 95% 이상은 선암(샘 조직과 유사)으로 분류되며, 나머지는 주로 편평세포암(편평세포, 상피세포의 한 종류)과 전이세포암([24]전이세포와 유사)으로 분류됩니다.

다음 종양 샘플은 종양 조직이 정상 전립선 조직과 얼마나 다른지에 따라 등급이 매겨집니다. 종양이 더 많이 나타날수록 종양은 더 빨리 성장할 가능성이 높습니다.병리학자가 현미경으로 관찰된 가장 일반적인 패턴에 대해 1(전립선 조직과 유사함)에서 5(가장 덜 유사함)까지의 숫자를 할당한 후 두 번째로 가장 일반적인 패턴에 대해서도 동일하게 하는 글리슨 등급 시스템이 일반적으로 사용됩니다.이 두 숫자의 합은 글리슨 [24]점수입니다.2에서 5까지의 총 점수는 더 이상 연습에서 일반적으로 사용되지 않으며, 가장 낮은 점수는 6점, 가장 높은 점수는 10점입니다.점수는 일반적으로 글리슨 등급 그룹으로 분류됩니다. 6점 이하의 점수는 글리슨 등급 그룹 1, 7점은 글리슨 등급 그룹 3, 2번은 등급 그룹 2, 역 - 1번은 등급 그룹 4, 2번은 등급 그룹 3, 8점은 등급 그룹 4, 9점 또는 10점은 등급 그룹 [24]5로 분류됩니다.글리슨 점수가 높고 등급이 높은 그룹은 [24]더 나쁜 예후와 함께 더 공격적일 가능성이 있는 암 사례를 나타냅니다.
암 확산의 범위는 전립선 단백질 전립선 특이적 막 항원을 결합하는 방사선 의약품을 사용하여 [25][21]전립선에서 멀리 떨어진 전이를 감지하는 양전자 방출 단층 촬영(PET) 영상 기술인 MRI 또는 PSMA 스캔으로 평가됩니다.CT 스캔도 사용할 수 있지만 MRI보다 전립선 외부의 확산을 감지하는 능력이 낮습니다. 뼈 신티그래피는 암이 [25]뼈로 전이되는지 검사하는 데 사용됩니다.
스테이징

전립선암 진단 후 종양의 성장과 확산 정도를 결정하기 위해 종양을 단계적으로 진행합니다.전립선암은 일반적으로 미국 암 공동 위원회(AJCC)의 3성분 TNM 시스템을 사용하여 진행되며, 종양의 범위(T), 림프절(N) 및 전이(M)[26]에 대한 점수가 할당됩니다. T1과 T2의 점수는 전립선 내에 남아 있는 종양을 나타냅니다.T1은 영상 또는 디지털 직장 검사로 감지할 수 없는 종양에 대한 것입니다. T2는 영상 또는 직장 검사로 감지할 수 있는 종양에 대한 것이지만 여전히 [27]전립선 내에 갇혀 있습니다.T3는 전립선 밖에서 성장하는 종양의 경우, T3a는 전립선 밖으로 확장된 종양의 경우, T3b는 인접한 정낭을 침범하는 종양의 경우입니다.T4는 정낭을 [27]넘어 장기로 성장한 종양을 위한 것입니다.N 및 M 점수는 이항(예 또는 아니오)입니다.N1은 주변 림프절로의 확산을 나타냅니다.M1은 다른 신체 [27]부위로의 전이를 나타냅니다.
그런 다음 AJCC는 TNM 점수, 글리슨 등급 그룹 및 PSA 혈액 테스트 결과를 결합하여 암 사례를 네 단계 중 하나와 그 하위 단계로 분류합니다.국소 종양(T1 또는 T2), 확산 없음(N0 및 M0), 글리슨 등급 그룹 1, PSA가 10 ng/mL 미만인 암 환자는 1단계로 지정됩니다.국소 종양 및 PSA가 10 ~ 20 ng/mL 사이인 환자는 2단계 - 글리슨 등급 그룹 1의 경우 IIA, 2등급 그룹 2의 경우 IIB, 3 또는 4등급 그룹의 경우 IIC로 세분됩니다.3단계는 세 가지 더 높은 위험 요소에 대한 지정입니다. IIIA는 PSA 수준 약 20ng/mL, IIIB는 T3 또는 T4 종양, IIIC는 글리슨 등급 그룹 5개입니다.4단계는 림프절(N1, IVA 단계) 또는 다른 장기(M1, IVB [26]단계)로 전이된 암에 대한 것입니다.
| AJCC 스테이지 | TNM 점수 | 글리슨 학년군 | PSA |
|---|---|---|---|
| 1단계 | T1 또는 T2, N0, M0 | 1 | <10ng/mL |
| 2단계 | T1 또는 T2, N0, M0 | 1 | 10-20 ng/mL |
| 2단계 | 2 | ||
| 2단계 | 3 또는 4 | ||
| 스테이지 IIIA | T1 또는 T2, N0, M0 | 3 또는 4 | 20 ng/mL 이상 |
| 스테이지 IIIB | T3 또는 T3, N0, M0 | 10-20 ng/mL | |
| 2단계 | T1 또는 T2, N0, M0 | 5 | |
| 스테이지 IVA | 임의의 T, N1 | 임의의 그룹 | 모든 PSA |
| 스테이지 IVB | 임의의 T, M1 |
영국 국립 보건 관리 우수 연구소는 Cambridge Progendistic Group이라 불리는 질병의 예후 또는 사망 위험에 기초한 5단계 시스템을 추천합니다. CPG 1은 AJCC 1단계와 동일합니다.[28]국소 종양(T1 또는 T2)과 글리슨 등급 그룹 2 이상의 PSA 수준(10 ~ 20 ng/mL)이 있는 경우를 CPG 2로 지정합니다. CPG 3은 글리슨 등급 그룹 3 또는 CPG 2 기준의 조합을 나타냅니다.CPG 4는 AJCC 단계 3과 유사합니다. 즉, 글리슨 등급 4 그룹, PSA 수준이 20 ng/mL 이상이거나 전립선(T3)을 초과하여 성장한 종양입니다. CPG 5는 가장 높은 위험 사례에 해당합니다. T4 종양, 글리슨 등급 5 그룹 또는 CPG 4 [29]기준 중 하나입니다.
모의 조건
육아종 전립선염은 직장 검사, MRI 및 PSA 점수 상승을 포함하여 전립선암으로 오인될 수 있으며,[medical citation needed] 구별하기 위해 생검이 필요합니다.
예방
전립선암 예방을 위해 규제 기관에 의해 승인된 약물이나 백신은 없습니다.여러 연구에서 전립선암의 발생률을 감소시키는 5α-환원효소 억제제를 보여주었지만, 질병을 감소시키는지는 [30]명확하지 않습니다.
관리
전립선암의 치료는 암이 얼마나 진행되었는지, 암이 확산될 수 있는 위험(조직학에 기초함), 그리고 영향을 받은 사람의 건강, 기대 수명 및 개인적 [31]선호도에 따라 매우 다양합니다.확산 위험이 낮은 국소 질환을 가진 사람들은 종종 질병의 영향보다 치료 부작용으로부터 더 큰 위협을 받기 때문에 정기적으로 능동적인 감시, 즉 [32]질병의 악화에 대한 반복 테스트를 통해 모니터링됩니다.높은 위험에 처한 사람들은 종양을 제거하기 위한 치료를 받을 수 있습니다 – 일반적으로 전립선 절제술(전립선을 제거하기 위한 수술) 또는 방사선 치료, 때로는 호르몬 [33]치료와 함께.전이성 질환을 가진 사람들은 전이성 [33]종양의 증상을 완화하기 위해 추가적인 방사선 또는 다른 약제뿐만 아니라 화학 요법으로 추가적으로 치료됩니다.치료 과정 전반에 걸쳐 혈액 PSA 수준을 모니터링하여 치료의 효과와 질병의 [34]진행 여부를 평가합니다.
국한성 질환
전립선암의 저위험 사례로 진단된 남성들은 종종 치료를 미루고 대신 적극적인 [32]감시에 의해 정기적으로 암 진행을 모니터링합니다.능동적인 감시는 PSA 테스트(약 6개월), 디지털 직장 검사(매년), MRI 또는 반복 생체검사(매 1~3년)[32]를 통해 종양의 성장을 모니터링하는 것을 포함합니다.대부분의 사람들에게 [35]문제를 일으킬 가능성이 없는 천천히 성장하거나 자가 제한된 종양을 고려할 때, 적극적인 감시의 목표는 치료를 미루고 과도한 치료와 그 부작용을 피하는 것입니다.전립선암 환자의 임상적 특성과 검사 결과를 바탕으로 질병 진행 위험을 예측하는 다양한 위험 계산 알고리즘이 개발되었습니다.여기에는 환자의 PSA 수준, 글리슨 점수 및 TNM 점수를 고려한 Partin Table 및 D'Amico 위험 그룹뿐만 아니라 환자의 나이와 암세포가 [36]발견된 전립선 생검의 비율을 고려한 CAPRA 점수도 포함됩니다.NICE가 지원하는 예측 전립선 알고리즘 및 웹 도구는 개별화된 예후를 살펴보고 비정형 [37]질환에서 치료 대 보존적 관리의 이점을 확인합니다.
치료를 받기로 선택한 사람들은 일반적으로 방사선 치료나 전립선 [38]절제술을 받습니다.방사선은 다른 장기에 대한 방사선이 상대적으로 거의 없이 전립선에 높은 선량(80 Gy 이상)이 전달될 수 있도록 하는 강도 조절 방사선 치료 또는 [39][40]전립선 옆에 방사선원이 수술적으로 배치되는 브라키테라피를 통해 전달될 수 있습니다.방사선 치료는 일반적으로 8주에서 [41]9주에 걸쳐 여러 치료로 이루어집니다.근처 장기에 대한 방사선 손상은 후속 방광암의 위험을 증가시키고 발기부전, 불임, 그리고 설사, 혈변, 요실금, [41]통증과 같은 위장관 문제를 일으킬 수 있습니다.상대적으로 위험성이 높은 국소 질환을 가진 사람들의 경우 방사선과 안드로겐 결핍 치료를 결합하면 전반적인 [39]생존율이 향상됩니다.
근본적 전립선 절제술은 전립선의 암 부분과 정낭, 혈관의 [42]일부를 외과적으로 제거하는 것을 목표로 합니다.이것은 음경 위, 음낭 아래, 또는 복강경 또는 로봇 보조 [43]수술의 도움을 받는 작은 절개를 통해 수행될 수 있습니다.네 가지 접근법은 수술 중에 혈액 손실이 적고 병원 [43]체류 시간이 짧지만 암 통제 및 부작용의 비율이 유사합니다.수술 중 주변 조직이 손상되면 발기부전과 요실금이 발생할 수 있습니다.발기부전은 더 나이가 많거나 이전에 [43]발기부전이 있었던 사람들에게서 더 발생할 가능성이 높습니다.요실금은 나이가 많고 [43]요도가 짧은 사람들에게 더 흔합니다.암 진행 결과와 수술 부작용 모두에서, 수술을 하는 개별 외과 의사의 기술과 경험은 [43]성공의 가장 큰 결정 요인 중 하나입니다.방사선 치료와 수술은 5년 [44]후 장, 발기 및 비뇨기 기능과 관련하여 유사한 결과를 초래하는 것으로 보입니다.
성공적인 방사선 치료는 종양의 파괴로 인해 PSA 수치의 감소를 야기하는 반면, 전립선 절제술은 PSA가 감지할 수 없는 [45]수준으로 떨어지도록 합니다.국소 전립선암 치료 후에도 PSA 수치는 여전히 정기적으로 모니터링됩니다.치료를 받은 사람들의 최대 절반은 결국 PSA 수치가 상승할 것이며, 이는 종양이나 작은 전이가 [46]다시 성장하고 있음을 시사합니다.PSA 수치가 높거나 증가하는 사람들은 종종 이전 종양 부위에 직접 방사선 치료를 제공받습니다.따라서 추가 진행 위험이 75%[45] 감소합니다.전이가 의심되는 사람들은 민감한 방사선 추적기 C-11 콜린, F-18 플루시클로바인 및 PSMA 표적 약물에 부착된 F-18 또는 Ga-68로 PET 스캔을 받을 수 있으며, 각각은 대체 영상 [47][45]방법보다 더 민감하게 작은 전이를 감지할 수 있습니다.
전이성 질환
전이성 질환자의 경우 전립선 세포가 [48]성장하기 위해 필요한 안드로겐(남성 성호르몬) 수치를 낮추는 약물인 안드로겐 박탈 요법이 치료의 기준입니다.주요 안드로겐인 테스토스테론의 합성이나 작용을 차단하여 안드로겐 수치를 낮추기 위해 다양한 약물이 사용됩니다.치료의 첫 번째 라인은 일반적으로 필요한 [49][48]경우 월별 또는 그 이하로 주사에 의한 Leuprolide, Goserelin, Triptorelin 또는 Leuprolide Mesylate와 같은 GnRH 작용제입니다.GnRH 작용제는 치료를 시작할 때 테스토스테론 수치의 일시적인 상승을 유발하며,[50] 이는 전이의 중요한 증상을 가진 사람들의 질병을 악화시킬 수 있습니다.이러한 사람들에게, 디가렐릭스나 레루골릭스와 같은 GnRH 길항제가 대신 주어지고, 또한 테스토스테론 [50]수치를 빠르게 감소시킬 수 있습니다.호르몬 치료는 치료를 받은 [51]사람들의 95% 이상에서 종양 성장을 멈추고, PSA 수치는 최대 70%[52]까지 정상으로 돌아갑니다.
테스토스테론 수치의 감소에도 불구하고, 결국 거의 모든 전립선암은 계속 성장합니다 – 전형적으로 혈액 PSA 수치의 증가와 근처 [53][54]뼈로의 전이로 나타납니다.이것은 거세 저항성 전립선암 (CRPC)이라고 불리는 질병의 가장 진행된 단계입니다.CRPC는 일반적으로 지속적인 호르몬 치료와 함께 전신 화학 요법으로 치료됩니다.진료 기준은 3주에 [55]한 번씩 주어지는 진료비입니다.대부분의 CRPC 사례는 여전히 안드로겐 신호 전달에 다소 의존하며, 그래서 특정 항안드로겐 약물, 즉 안드로겐 수용체 길항제인 엔잘루타미드, 팔루타미드 및 다롤루타미드뿐만 아니라 테스토스테론 생성 억제제인 아비라테론 아세테이트(다른 호르몬의 균형을 방해함)가 종종 사용됩니다.프레드니손(Prednisone)[53][56]과 함께 투여됩니다.암이 독극물에 내성이 생긴 사람들은 2세대 독극물인 카바지타셀을 [53]받을 수 있습니다.대안은 세포 치료 과정 Sipuleucel-T입니다. 여기서 영향을 받은 사람의 면역 세포를 제거하고 전립선암 세포를 더 효과적으로 표적화하도록 치료하고 동일한 [53][56]사람에게 다시 주입합니다.
지원적 케어
전이성 전립선암 환자의 약 85%에 존재하는 뼈 전이는 전이성 [57][58]전립선암으로 인한 증상과 사망의 주요 원인입니다.전이는 심각한 통증과 뼈 약화를 일으킬 수 있으며, 영향을 받은 사람들의 약 25%가 [58]골절을 일으킬 수 있습니다.지속적인 통증이 있는 사람들은 종종 비스테로이드성 항염증제를 [59]처방받습니다.하지만, 뼈 전이가 있는 사람들은 종종 통증 약이 [59]효과를 발휘하기 전에 약 15분 이내에 갑자기 심한 통증이 폭발하는 "돌파적 통증"을 경험합니다.단일 부위의 통증은 외부 빔 방사선 치료로 치료하여 주변 [60]종양을 축소할 수 있습니다.더 분산된 뼈 통증은 뼈 종양의 크기를 줄이는 데 도움을 주는 라듐-223 및 사마륨-153-EDTMP와 같은 뼈에 불균형적으로 축적되는 방사성 화합물로 치료할 수 있습니다.유사하게, 전이성 전립선암에 사용되는 전신 화학 요법은 [60]종양을 축소시킬 때 고통을 줄일 수 있습니다.Zoledronic acid와 denosumab과 같은 다른 뼈 변형제는 종양 [60]크기에 거의 영향을 미치지 않지만 전립선암의 뼈 통증을 줄일 수 있습니다.전이성 전립선암 환자의 12%까지 척수를 압박하여 통증, 허약, 저림, [61][62]마비를 일으킬 수 있습니다.척추의 염증은 고용량 스테로이드로 치료할 수 있을 뿐만 아니라 수술과 방사선 치료를 통해 척추 종양을 수축시키고 [61][62]척수에 가해지는 압력을 완화시킬 수 있습니다.
진행된 전립선암을 가진 사람들은 종종 피로, 무기력, 그리고 전신 쇠약을 겪습니다.이것은 부분적으로 식욕 감퇴, 체중 감소, 메스꺼움, 그리고 변비와 함께 위장 장애에 의해 발생합니다.이들은 일반적으로 식욕을 증가시키는 약물인 메게스트롤 아세테이트 또는 코르티코스테로이드로 치료됩니다.[63]일반적인 허약함은 빈혈, 그 자체가 질병 자체, 영양 부족, 그리고 암 치료나 [64]뼈 전이로 인한 골수 손상에 의해 야기될 수도 있습니다.빈혈은 원인에 따라 다양한 방법으로 개선될 수도 있고 [64]수혈로 직접 해결할 수도 있습니다.장기 손상과 림프절의 전이는 생식기 또는 하지에 액체(림프 부종이라고 함)가 불편하게 축적될 수 있습니다.이러한 붓기는 극도로 고통스러울 수 있으며, 영향을 받은 사람의 소변, 성관계 또는 정상적으로 걷는 능력을 감소시킬 수 있습니다.림프 부종은 배수를 돕기 위해 압력을 가하고, 수술로 고인 물을 빼내고, 주변의 손상된 [65]피부를 청소하고 치료함으로써 치료될 수 있습니다.
전립선암에 걸린 사람들은 [66]암에 걸리지 않은 사람들에 비해 불안감이나 우울증을 경험할 확률이 약 두 배입니다.정상적인 전립선암 치료에 추가될 때, 정신 교육과 인지 행동 치료와 같은 심리적 개입은 불안, 우울증, 그리고 일반적인 [67]고통을 줄이는 데 도움이 될 수 있습니다.
말기에 전이성 전립선암을 앓고 있는 중증 환자들은 대부분 혼란을 겪으며 환각을 보이거나 사랑하는 [68][69]사람을 인식하는 데 어려움을 겪을 수 있습니다.혼란은 신부전, 패혈증, 탈수증을 포함한 다양한 상태와 다양한 약물, 특히 [68]오피오이드의 부작용으로 인해 발생합니다.대부분의 사람들은 오랫동안 잠을 자고, 어떤 사람들은 [69]깨어 있을 때 졸립니다.안정감이 없는 것은 또한 흔하며, 때로는 변비로 인한 신체적 불편이나 요로결핍, 때로는 [69]불안감으로 인해 발생합니다.마지막 며칠 동안, 영향을 받은 남성들의 호흡은 얕아지고 느려질 수 있으며, 호흡 사이에 긴 휴지기가 있을 수 있습니다.호흡은 목에 액체가 남아 있을 때 덜컹거리는 소리를 동반할 수 있지만, 이는 영향을 받는 [69][70]사람에게 불편하지 않습니다.그들의 손과 발은 만지면 차가워지고, 피부는 혈액 순환이 약해져 얼룩이 지거나 파랗게 됩니다.많은 사람들이 먹고 마시는 것을 멈추고, 그 결과 입과 [69]입술을 촉촉하게 함으로써 도움이 될 수 있는 건조한 입을 만듭니다.그 사람은 점점 더 반응이 적어지고, 결국 심장과 호흡이 [70]멈춥니다.
예후
진단된 전립선암의 예후는 진단 당시 암의 등급과 단계에 따라 크게 다릅니다. 저단계 질환을 가진 사람들은 예후가 크게 개선되었습니다.전립선암 진단의 약 80%는 여전히 전립선에 국한된 암을 가진 남성들에게 있습니다.이 남성들은 진단 후에도 오래 생존하는 경우가 많으며,[71] 진단 후 10년이 지난 지금도 99%가 생존합니다.암이 신체의 가까운 부분으로 전이된 남성(진단의 약 15%)은 5년 생존율이 60-80%[72]로 더 낮은 예후를 보입니다.원격 신체 부위에 전이가 있는 환자(진단의 약 5%)는 5년 생존율이 30~40%[72]로 상대적으로 예후가 좋지 않습니다.
진단 시 혈중 PSA 수치가 낮고, 종양이 글리슨 등급이 낮고 임상 단계가 덜 진행된 사람들은 더 나은 예후를 보이는 경향이 있습니다.[73] 전립선 절제술이나 방사선 치료 후 치료와 그에 따른 PSA 수치 상승 사이에 짧은 시간이 있거나 PSA 수치 상승의 빠른 속도가 있는 사람들은 [46]암으로 사망할 가능성이 더 높습니다.거세 저항성 전이성 전립선암은 [74]치료가 불가능하며, 이 [53]단계에 도달한 사람들 중 대다수가 사망합니다.

원인

전립선암은 전립선에 있는 세포의 DNA에 유전적 돌연변이가 축적되어 발생합니다.이 돌연변이들은 세포 성장, DNA 손상 복구, 세포 사망과 관련된 유전자에 영향을 미칩니다.이러한 유전자의 변화는 전립선의 세포가 통제할 수 없이 자라게 하여 [75]종양을 초래할 수 있습니다.시간이 지남에 따라, 종양은 정낭이나 [76]방광과 같은 가까운 장기를 침범할 만큼 충분히 커질 수 있습니다.결국 종양 세포는 림프계를 통해 가까운 림프절로 이동하거나 혈류를 통해 골수 및 (더 드물게) 다른 신체 [77]부위로 이동하는 능력을 발달시킬 수 있습니다.이러한 새로운 부위에서, 암세포는 정상적인 신체 기능을 방해하고 계속해서 성장합니다.전이는 전립선암과 관련된 대부분의 불편함을 야기하고, 결국 영향을 받은 [77]사람을 죽일 수 있습니다.
병리생리학
전립선암은 세포 성장, 복제, 사망 및 DNA 손상 [78]복구를 조절하는 전립선 조직에 축적된 돌연변이로 시작됩니다.대부분의 전립선 종양은 [79]전립선의 가장 바깥 부분인 말초 영역에서 시작됩니다.세포들이 통제 불능으로 자라기 시작하면서, 그들은 전립선 상피 [80]내 신생물이라고 불리는 규제되지 않은 세포들의 작은 덩어리를 형성합니다.일부 PIN은 계속 성장하여 원래 조직 위치인 p63, 사이토케라틴 5 및 사이토케라틴 14에 공통적인 유전자 발현을 중지하고 췌장 덕트의 가장 안쪽 라이닝을 구성하는 세포에 공통적인 유전자인 사이토케라틴 8 및 사이토케라틴 [79]18을 발현하기 시작하는 조직 층을 형성합니다.이러한 다층 PIN은 또한 종종 [79]전립선암 진행과 관련된 AMACR 유전자를 과발현합니다.
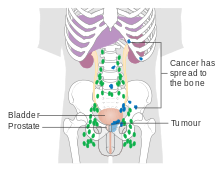
특히 큰 PIN은 결국 종양으로 성장할 수 있습니다.이것은 일반적으로 염색체 서열이 반복적으로 재배열되거나 복사되는 게놈에 대한 대규모 변화를 동반합니다.일부 유전자 변형은 특히 초기 전립선암, 즉 TMPRSS2와 종양유전자 ERG(전립선 종양의 최대 60%) 사이의 유전자 융합, SPOP(종양의 최대 15%)를 비활성화하는 돌연변이, FOXA1([79]종양의 최대 5%)을 과활성화하는 돌연변이에서 흔합니다.
전이성 전립선암은 국소 [81]질환보다 유전적 돌연변이가 더 많은 경향이 있습니다.이러한 돌연변이의 대부분은 p53(국재 종양의 8%, 전이 종양의 27% 이상) 및 RB1(국재 종양의 1%, 전이 [81]종양의 5% 이상)과 같이 DNA 손상으로부터 보호하는 유전자에 있습니다.마찬가지로 DNA 복구 관련 유전자 BRCA2 및 ATM의 돌연변이는 국소 질환에서는 드물지만 전이 질환의 최소 7% 및 5%에서 [81]발견됩니다.
거세에 민감한 전립선암에서 거세에 내성이 있는 전립선암으로의 전환은 또한 다양한 유전자 돌연변이의 획득을 동반합니다.거세 저항성 질환에서 종양의 70% 이상은 안드로겐 수용체 신호 경로에 돌연변이가 있습니다. 즉, 수용체 유전자 자체의 증폭 및 기능 향상 돌연변이, 활성화 인자(예: FOXA1)의 증폭 또는 음성 조절기(예: ZBTB16 및 NCOR1)[81]의 돌연변이가 비활성화됩니다.이러한 안드로겐 수용체 장애는 캐스트레이트 감수성 전이 [81]질환의 생체검사 중 최대 6%에서만 발견됩니다.마찬가지로, 종양 억제제 PTEN의 결실은 12-17%의 거세 감수성 종양에 의해 보호되지만 40% 이상의 거세 내성 [81]종양에 의해 보호됩니다.덜 일반적으로 종양은 APC(종양의 9%) 또는 CTNNB1(종양의 4%)의 구성원 중단을 통한 Wnt 신호 전달 경로의 비정상적인 활성화; PI3KCA/PI3KCB 돌연변이(종양의 6%) 또는 [81]AKT1(종양의 2%)을 통한 PI3K 경로의 조절 장애를 가지고 있습니다.
역학

전립선암은 남성에서 두 번째로 자주 진단되는 암이며, 남성에서 암 사망의 두 번째로 빈번한 원인입니다(폐암 [2][3]다음으로).매년 약 120만 명의 전립선암 환자가 새로 진단되고 35만 명의 남성이 이 [2]질병으로 사망합니다.남성 8명 중 1명은 평생 전립선암 진단을 받고, 40명 중 1명은 이 [3]질병으로 사망합니다.전립선암의 비율은 나이가 들수록 증가합니다.이것 때문에, 전립선암 발병률은 일반적으로 기대수명이 높은 세계의 일부 지역에서 더 높으며, 또한 국내 총생산이 높고 인간 개발 [2]지수가 높은 지역인 경향이 있습니다.호주, 유럽, 북아메리카, 뉴질랜드, 그리고 남아메리카의 일부 지역에서 발병률이 가장 높습니다.남아시아, 중앙아시아, 사하라 이남 아프리카는 전립선암 발병률이 가장 낮습니다. 비록 이 지역들에서 발병률이 [2]세계에서 가장 빠른 속도로 증가하고 있지만요.전립선암은 전 세계 절반 이상의 국가에서 남성에게 가장 많이 진단되는 암이며,[83] 약 4분의 1의 국가에서 남성이 암으로 사망하는 주요 원인입니다.
전립선암은 40세 [84]미만의 사람들에게 드문 경우입니다.환자의 압도적인 [2]대다수는 60세 이상에서 진단되며, 평균적인 사람은 [85]67세로 진단됩니다.전립선암으로 사망하는 평균 사람은 [85]77세입니다.소수의 전립선암 환자들만이 진단을 받습니다.다양한 나이에 사망한 남성의 부검 결과 50세 이상 남성의 40% 이상이 전립선에 암이 있는 것으로 나타났습니다.발병률은 나이가 들수록 증가하며, 80-89세에 부검을 받은 남성의 거의 70%가 전립선에 [86]암이 있었습니다.
유전학
전립선암은 일부 가족에서 더 흔합니다.영향을 받은 1급 친척(아버지 또는 형제)이 있는 남성은 전립선암에 걸릴 위험이 2배 이상이고, 1급 친척이 2명인 남성은 가족력이 [87]없는 남성에 비해 5배 이상 위험이 큽니다.일부 민족 집단에서도 위험이 증가하는데, 특히 아프리카계 미국인 남성은 전립선암이 더 높은 비율로 발생하고 더 [87]공격적인 전립선암에 걸릴 위험이 높습니다.게놈 전체에 걸친 대규모 연관 연구는 전립선암 [88]위험 증가와 관련된 100개 이상의 유전자 변형을 확인했습니다.가장 큰 위험 증가는 DNA [88]손상 복구와 관련된 BRCA2(최대 8배 위험 증가) 및 HOXB13(최대 3배 위험 증가)의 변화와 관련이 있습니다.DNA 손상 복구와 관련된 다른 유전자의 변형은 또한 전립선암(특히 초기 전립선암)의 발병 위험 증가와 관련이 있습니다(BRCA1, ATM, NBS1, MSH2, MSH6, PMS2, CHECK2,[88] RAD51D 및 PALB2 포함).또한, 종양 유전자 MYC 근처의 게놈 변이체는 [88]위험 증가와 관련이 있습니다.아프리카계 미국인에게 흔한 비타민 [87]D 수용체, 그리고 테스토스테론 합성 및 신호 전달에 관여하는 안드로겐 수용체, CYP3A4 및 CYP17의 단일 뉴클레오티드 다형성과 마찬가지로.알려진 유전자 변형은 초기 전립선암의 40%를 포함하여 전립선암 [87]환자의 약 25%를 유발하는 것으로 추정됩니다.
신체 및 생활양식
키가 큰 남자들은 [89]비만인 남자들과 마찬가지로 전립선암에 걸릴 위험이 약간 증가합니다.높은 혈중 콜레스테롤 수치는 전립선암 위험 증가와도 관련이 있습니다; 결과적으로, 콜레스테롤을 낮추는 약인 스타틴을 복용하는 사람들은 진행된 [90]전립선암의 위험이 줄어듭니다.만성 염증은 다양한 암을 유발할 수 있습니다.감염과 전립선암 사이의 잠재적인 연관성이 연구되었지만 전립선암과 임질, 매독, 클라미디아 또는 다양한 인간 유두 바이러스 [91]감염의 역사 사이에 연관성이 없다는 한 큰 연구가 발견되지 않았습니다.
규칙적인 격렬한 운동은 몇몇 식이요법의 [92]개입처럼 진행된 전립선암에 걸릴 가능성을 줄일 수 있습니다.십자화과 채소, 생선, 게니스테인 또는 리코펜(토마토에서 발견됨)이 풍부한 식단을 가진 사람들은 증상성 전립선암의 [87][93]위험이 감소합니다.반대로, 높은 수준의 식이 지방, 다환 방향족 탄화수소 또는 칼슘을 섭취하는 사람들은 진행성 전립선암에 [87][94]걸릴 위험이 증가할 수 있습니다.셀레늄, 비타민 C, 비타민 D, 그리고 비타민 [30][94]E를 포함한 몇몇 식이 보충제들이 전립선암 위험에 영향을 미치지 않는 것으로 연구되었습니다.
역사
전립선의 종양은 하체 통증과 소변 문제로 [95][96]68세에 사망한 한 남성의 부검 후 1817년 영국 외과의사 조지 랭스태프에 의해 처음 기술되었습니다.1853년, 런던 병원의 외과의사 존 애덤스는 비뇨기 질환으로 사망한 한 남자의 또 다른 전립선 종양에 대해 설명했습니다; 아담스는 병리학자가 종양을 검사하도록 하여 [95][97]전립선에 암 종양의 조직학적으로 확인된 첫 사례를 제공했습니다.이 병은 처음에는 다른 비뇨기 [98]폐색의 원인들과 거의 구별되지 않았기 때문에 흔하지 않은 것으로 생각되었습니다.1893년의 한 보고서는 의학 [99]문헌에 기술된 50건의 사례만을 발견했습니다.19세기가 바뀔 무렵, 비뇨기 폐색을 완화하기 위한 전립선 수술이 더 보편화되어 외과의사와 병리학자들이 제거된 전립선 조직을 검사할 수 있게 되었습니다.그 무렵의 두 연구는 10%에 달하는 수술 표본에서 암을 발견했는데, 전립선암이 전립선 [99]비대의 상당히 흔한 원인임을 시사합니다.
20세기 대부분의 기간 동안, 전립선암의 주요 치료법은 전립선을 제거하는 수술이었습니다.회음부 전립선 절제술은 1904년 존스 홉킨스 [100][101]병원에서 휴 H. 영에 의해 처음으로 시행되었습니다.영의 방법은 널리 퍼진 표준이 되었고, 처음에는 주로 소변 [100]막힘 증상을 완화하기 위해 행해졌습니다.1931년에 새로운 수술 방법인 전립선의 경요도 절제술이 가능해졌고, 증상적인 [99]폐색 완화를 위해 회음부 전립선 절제술을 대체했습니다.1945년, 테렌스 밀린은 골반 림프절에 더 쉽게 접근하여 질병의 정도를 조절하고 외과의사들이 배우기 쉬운 [100]복강 전립선 절제 접근법을 설명했습니다.이것은 패트릭 C에 의해 개선되었습니다. Walsh의 1983년 기술은 전립선 근처의 신경 손상을 피하고 발기 [100][102]기능을 보존하는 복강경 전립선 절제 접근법에 대한 것입니다.
전립선암에 대한 방사선 치료는 20세기 초에 가끔 사용되었는데, 종양의 크기와 관련된 [103]증상을 줄이기 위해 요도나 직장에 라듐을 이식했습니다.1950년대에 더 강력한 방사선 기계의 출현은 전립선에 도달하는 외부 광선 방사선 치료를 가능하게 했습니다.1960년대까지,[103] 이것은 종종 치료의 효과를 향상시키기 위해 호르몬 치료와 결합되었습니다.1970년대에 Willlet Whitmore는 요오드 125의 바늘을 전립선에 직접 넣는 개방형 수술 기술을 개척했습니다.이것은 1983년 Henrik H. Holm에 의해 방사성 [103]물질의 이식을 안내하기 위해 횡단 초음파를 사용함으로써 개선되었습니다.
고환(그리고 그들이 분비하는 호르몬)이 전립선 크기에 영향을 미친다는 관찰은 동물에 대한 거세 실험을 통해 이미 18세기 후반에 이루어졌습니다.그러나, 다음 세기에 걸친 때때로의 실험은 양성 전립선 과형성으로 인해 커진 전립선에서 전립선 종양을 분리할 수 없기 때문에 혼합된 결과를 낳았습니다.1941년, 찰스 B. 허긴스와 클라렌스 V. Hodges는 안드로겐 수치를 줄이고 전립선암 증상을 개선하기 위해 외과적 거세 또는 경구 에스트로겐을 사용하는 두 가지 연구를 발표했습니다.허긴스는 [104][105]전립선암에 대한 최초의 전신 치료법인 이 발견으로 1966년 노벨 생리학·의학상을 수상했습니다.1960년대에, 큰 연구들은 에스트로겐 치료가 전립선암을 치료하는 데 외과적 거세만큼 효과적이라는 것을 보여주었지만, 에스트로겐 치료를 받는 사람들은 [104]혈전을 겪을 위험이 증가했습니다.1980년대 내내, Andrzej W. GnRH에 대한 샬리의 연구는 GnRH 작용제의 개발로 이어졌는데,[104][106] 이는 응고의 위험 증가 없이 에스트로겐만큼 효과적인 것으로 밝혀졌습니다.1977년에 GnRH와 전립선암에 [104]대한 연구로 노벨 생리학·의학상을 수상했습니다.
전립선암에 대한 전신 화학 요법은 1950년대부터 연구되어 왔으며, 임상 실험은 그 [107]약을 받는 대부분의 사람들에게 이점을 보여주지 못했습니다.1996년, 미국 식품의약국은 거세 저항성 전립선암을 가진 사람들을 위한 전신 화학 요법 미톡산트론을 승인했는데,[108] 이는 생존율을 높이는데 실패했음에도 불구하고 증상이 개선되었다는 것을 보여주는 실험을 기반으로 합니다.2004년에 docetaxel은 거세 저항성 전립선암 [108]환자의 생존율을 높이기 위한 최초의 화학 요법으로 승인되었습니다.2015년 추가 실험 후, 의사 택셀 사용은 거세에 민감한 전립선암 [109]환자로 확대되었습니다.
사회와 문화
전립선암 검진과 인식은 2000년대 초부터 9월 전립선암 인식의 달과 11월 [110]모벰버에 의해 널리 홍보되었습니다.인터넷 검색과 소셜 미디어 게시물을 분석한 결과, 유방암 인식의 [110][111]달에 비해 전립선암에 대한 관심이나 토론의 수준은 어느 것도 변하지 않는 것으로 나타났습니다.전립선암에 대한 인식을 높이기 위해 하늘색 리본이 사용됩니다.
조사.
전립선암은 현재 진행 중인 연구의 주요 주제로, 2020년에 미국 국립 암 연구소(NCI, 세계 최대 암 연구 기금)가 전립선암 연구에 2억 9천 9백만 달러를 지출했는데, 이는 암 [112]유형 중 6번째로 높은 금액입니다.높은 총 지출에도 불구하고 전립선암 연구 자금은 사망자 수에 비해 상대적으로 낮습니다.NCI는 전립선암 사망 1건당 약 5,700달러를 지출하는데, 이는 뇌암(사망 1건당 21,000달러), 유방암(사망 1건당 13,000달러)[113] 또는 암 전체(사망 1건당 11,000달러)보다 상당히 낮습니다.유사한 경향이 민간 비영리 단체에도 적용됩니다.전립선암에 중점을 둔 비영리 단체의 연간 수익은 암 유형 중 6위를 차지하지만, 전립선암 비영리 단체의 수익은 환자 수, 사망 및 잠재적 수명 [114]손실에 대해 예상되는 것보다 낮습니다.
전립선암에 대한 연구는 질병의 측면을 테스트하기 위해 많은 실험실 모델에 의존합니다.고전적인 라인인 DU145, PC-3 및 LNCaP를 비롯하여 더 최근의 22Rv1, LAPC-4, VCaP 및 MDA-PCa-2a 및 -2b와 같은 [115]여러 전립선 불멸 세포주가 널리 사용됩니다.전립선의 더 복잡한 모델을 필요로 하는 연구는 인간 전립선 종양이나 줄기 [116]세포에서 성장할 수 있는 전립선 세포의 클러스터인 오가노이드를 사용합니다.종양 성장과 전이를 모델링하려면 모델 유기체, 일반적으로 마우스가 필요합니다.연구자들은 인간 전립선 종양을 면역 [117]결핍 생쥐에 외과적으로 이식하거나 화학적 노출이나 유전 [118]공학을 통해 생쥐에 전립선 종양을 유도할 수 있습니다.이러한 유전적으로 조작된 마우스 모델은 일반적으로 종양 억제기를 파괴하거나 전립선 [119]세포에서 종양 유전자를 활성화하기 위해 Cre 재조합 시스템을 사용합니다.
레퍼런스
- ^ "Survival Rates for Prostate Cancer". American Cancer Society. 1 March 2023. Retrieved 12 July 2023.
- ^ a b c d e f g h Rebioto et al. 2021, "유행병학"
- ^ a b c Scher & Eastham 2022, "전립암".
- ^ a b c "Prostate Cancer Signs and Symptoms". American Cancer Society. 1 August 2019. Retrieved 21 May 2023.
- ^ 메리엘, 펀스턴 & 해밀턴 2018, "증상과 징후".
- ^ "Symptoms of Prostate Cancer". Cancer Research UK. 15 March 2022. Retrieved 21 May 2023.
- ^ Coleman et al. 2020, "전립선암".
- ^ 임상 개요 2022, "임상 프레젠테이션".
- ^ Scher & Eastham 2022, "산병:비캐스트레이트".
- ^ a b c d Rebioto et al. 2021, "선별 및 조기 발견"
- ^ Dall'era 2023, "세럼 종양 마커".
- ^ "What Is Screening for Prostate Cancer". U.S. Centers for Disease Control and Prevention. 25 August 2022. Retrieved 17 May 2023.
- ^ a b Carlsson & Vickers 2020, "3.PSA 수준에 따라 선별 빈도를 조정합니다."
- ^ Carlsson & Vickers 2020, "5.생검 전에 마커 또는 이미징과 같은 2차 테스트를 사용하십시오.
- ^ Scher & Eastham 2022, "전립자 특이 항원".
- ^ Carlsson & Vickers 2020, "PSA(σ3 ng/mL)가 상승한 남성의 경우 PSA를 반복합니다.
- ^ Scher & Eastham 2022, "2차 선별 검사".
- ^ a b c d e f g Rebioto et al. 2021, "박스 1: 각기 다른 지역의 전립선암 선별 검사"
- ^ 반항아 외. 2021, "표 2".
- ^ "Tests to Diagnose and Stage Prostate Cancer". American Cancer Society. 21 February 2023. Retrieved 18 May 2023.
- ^ a b c d Rebioto et al. 2021, "진단"
- ^ Scher & Eastham 2022, "신체검사".
- ^ Scher & Eastham 2022, "전립생검".
- ^ a b c d Scher & Eastham 2022, "병리학".
- ^ a b Scher & Eastham 2022, "전립선암 스테이징".
- ^ a b "Prostate Cancer Staging". American Cancer Society. 8 October 2021. Retrieved 14 May 2023.
- ^ a b c Scher & Eastham 2022, "표 87-1 TNM 분류"
- ^ "Prostate cancer: diagnosis and management. NICE guideline [NG131]". National Institute for Health and Care Excellence (NICE). 9 May 2019. Retrieved 3 October 2022.
- ^ "Prostate cancer risk groups and the Cambridge Prognostic Group (CPG)". Cancer Research UK. 24 May 2022. Retrieved 25 June 2023.
- ^ a b Scher & Eastham 2022, "암 진단 없음"
- ^ Rebioto et al. 2021, "경영".
- ^ a b c Scher & Eastham 2022, "적극적인 감시".
- ^ a b "Initial Treatment of Prostate Cancer, by Stage and Risk Group". American Cancer Society. 9 August 2022. Retrieved 28 May 2023.
- ^ "Following PSA Levels During and After Prostate Cancer Treatment". American Cancer Society. 1 August 2019. Retrieved 28 May 2023.
- ^ Ellis SD, Hwang S, Morrow E, Kimminau KS, Goonan K, Petty L, et al. (May 2021). "Perceived barriers to the adoption of active surveillance in low-risk prostate cancer: a qualitative analysis of community and academic urologists". BMC Cancer. 21 (1): 649. doi:10.1186/s12885-021-08386-3. PMC 8165996. PMID 34058998.
{{cite journal}}CS1 유지 관리: 재정의된 설정(링크) - ^ Rebioto et al. 2021, "표 1: 진단 시 및 치료 후 전립선암 위험 분류"
- ^ Thurtle DR, Greenberg DC, Lee LS, Huang HH, Pharoah PD, Gnanapragasam VJ (March 2019). "Individual prognosis at diagnosis in nonmetastatic prostate cancer: Development and external validation of the PREDICT Prostate multivariable model". PLOS Medicine. 16 (3): e1002758. doi:10.1371/journal.pmed.1002758. PMC 6413892. PMID 30860997.
- ^ Scher & Eastham 2022, "임상 국소 전립선암"
- ^ a b Scher & Eastham 2022, "외부 빔 방사선 치료".
- ^ Scher & Eastham 2022, "Brachytherapy".
- ^ a b 2018년 브롤리, 모한 & Ne, "방사능 치료".
- ^ Dall'era 2023, "급성 전립선 절제술".
- ^ a b c d e Scher & Eastham 2022, "급성 전립선 절제술".
- ^ Wallis CJ, Glaser A, Hu JC, Huland H, Lawrentschuk N, Moon D, et al. (January 2018). "Survival and Complications Following Surgery and Radiation for Localized Prostate Cancer: An International Collaborative Review" (PDF). European Urology. 73 (1): 11–20. doi:10.1016/j.eururo.2017.05.055. PMID 28610779.
{{cite journal}}CS1 유지 관리: 재정의된 설정(링크) - ^ a b c Rebioto et al. 2021, "생화학적 재발 및 잔류 질환"
- ^ a b Rebioto et al. 2021, "생화학적 재발 및 잔류 질환"
- ^ Scher & Eastham 2022, "확정적 국소 치료 후 상승 PSA"
- ^ a b Rebioto et al. 2021, "대사호르몬 감수성 전립선암"
- ^ "Hormone Therapy for Prostate Cancer". American Cancer Society. 9 August 2022. Retrieved 15 May 2023.
- ^ a b Scher & Eastham 2022, "테스토스테론-하강제".
- ^ Chard et al. 2022, "소개".
- ^ Scher & Eastham 2022, "안드로겐 박탈의 결과"
- ^ a b c d e Scher & Eastham 2022, "산병:거세".
- ^ Rebioto et al. 2021, "정성 거세 저항성 전립선암"
- ^ Teo, Rathkopf & Kantoff 2019, "전이성 거세 저항성 전립선암의 관리"
- ^ a b 테오, 라스코프 & 칸토프 2019, "아비라테론 아세테이트".
- ^ Coleman et al. 2020, "뼈 전이의 만연".
- ^ a b Coleman et al. 2020, "SRE의 보급".
- ^ a b Coleman et al. 2020, "CIBP에 사용된 진통제".
- ^ a b c Scher & Eastham 2022, "고통 관리".
- ^ a b Thompson, Wood & Feuer 2007, "코드 압축".
- ^ a b "What is metastatic spinal cord compression (MSCC)". Prostate Cancer UK. June 2022. Retrieved 25 June 2023.
- ^ Thompson, Wood & Feuer 2007, "위장관 증상".
- ^ a b Thompson, Wood & Feuer 2007, "일반적인 쇠약".
- ^ Thompson, Wood & Feuer 2007, "림프부종".
- ^ Mundle, Afenya & Agarwal 2021, "불안, 우울, 괴로움의 추정치"
- ^ Mundle, Afenya & Agarwal 2021, "추상적".
- ^ a b Thompson, Wood & Feuer 2007, "Delirium".
- ^ a b c d e "Dying from prostate cancer – What to expect". Prostate Cancer UK. July 2018. Retrieved 25 June 2023.
- ^ a b "Care Through the Final Days". American Society of Clinical Oncology. November 2022. Retrieved 25 June 2023.
- ^ Rebioto et al. 2021, "선지자와 생존"
- ^ a b Rebioto et al. 2021, "그림 3: 전립선암 단계 및 진행"
- ^ 필리외 2022, "표 45-2".
- ^ Rebioto et al. 2021, "추상적".
- ^ "What Causes Prostate Cancer?". American Cancer Society. 1 August 2019. Retrieved 17 May 2023.
- ^ "Locally advanced prostate cancer". Cancer Research UK. 31 May 2022. Retrieved 21 May 2023.
- ^ a b Rebioto et al. 2021, "질병 진행".
- ^ 반항아 외. 2021, "유전학".
- ^ a b c d Sandhu et al. 2021, "전립선암의 생물학".
- ^ "Understanding Your Pathology Report: Prostatic Intraepithelial Neoplasia (PIN) and Intraductal Carcinoma". American Cancer Society. Retrieved 25 May 2023.
- ^ a b c d e f g Rebioto et al. 2021, "전태성 질환"
- ^ "WHO Disease and injury country estimates". World Health Organization. 2009. Archived from the original on 11 November 2009. Retrieved 11 November 2009.
- ^ Bergengren et al. 2023, "3.1 역학".
- ^ Pernar et al. 2018, "전립선암의 위험인자"
- ^ a b 스티븐슨, Abouassaly & Klein 2021, "Age at Diagnostics".
- ^ Dall'era 2023, "일반적인 고려사항".
- ^ a b c d e f Scher & Eastham 2022, "유행병학".
- ^ a b c d 반항아 외. 2021, "유전적 소인"
- ^ Pernar et al. 2018, "전립선암 및 치명적인 전립선암의 위험인자"
- ^ Pernar et al. 2018, "Statins".
- ^ 스티븐슨, Abouassaly & Klein 2021, "염증과 감염"
- ^ Pernar et al. 2018, "운동".
- ^ Pernar et al. 2018, "Fish".
- ^ a b 페르나 외 2018, "칼슘, 유제품, 비타민 D"
- ^ a b Valier 2016, 페이지 15–18.
- ^ Lawrence W (1817). "Cases of Fungus Hæmatodes, with Observations, by George Langstaff, Esq. and an Appendix, containing two cases of Analogous Affections". Med Chir Trans. 8: 272–314. doi:10.1177/095952871700800114. PMC 2129005. PMID 20895322.
- ^ Adams J (1853). "The case of scirrhous of the prostate gland with corresponding affliction of the lymphatic glands in the lumbar region and in the pelvis". Lancet. 1 (1547): 393–94. doi:10.1016/S0140-6736(02)68759-8.
- ^ 덴미드 & 아이작스 2002, "메인".
- ^ a b c 라이튼 2001, 1859페이지
- ^ a b c d Denmeade & Isaacs 2002, "Prostate cctomy".
- ^ Young HH (1905). "Four cases of radical prostatectomy". Johns Hopkins Bull. 16.
- ^ Walsh PC, Lepor H, Eggleston JC (1983). "Radical prostatectomy with preservation of sexual function: anatomical and pathological considerations". The Prostate. 4 (5): 473–485. doi:10.1002/pros.2990040506. PMID 6889192. S2CID 30740301.
- ^ a b c Denmade & Isaacs 2002, "방사선 치료".
- ^ a b c d Denmeade & Isaacs 2002, "안드로겐 절제 치료".
- ^ Huggins CB, Hodges CV (1941). "Studies on prostate cancer: 1. The effects of castration, of estrogen and androgen injection on serum phosphatases in metastatic carcinoma of the prostate". Cancer Res. 1 (4): 293. Archived from the original on 30 June 2017. Retrieved 2 September 2015.
- ^ Tolis G, Ackman D, Stellos A, Mehta A, Labrie F, Fazekas AT, et al. (March 1982). "Tumor growth inhibition in patients with prostatic carcinoma treated with luteinizing hormone-releasing hormone agonists". Proceedings of the National Academy of Sciences of the United States of America. 79 (5): 1658–1662. Bibcode:1982PNAS...79.1658T. doi:10.1073/pnas.79.5.1658. PMC 346035. PMID 6461861.
{{cite journal}}CS1 유지 관리: 재정의된 설정(링크) - ^ Denmade & Isaacs 2002, "세포독성 화학요법".
- ^ a b 데사이, 맥매너스 & 샤리피 2021, "치료의 진화".
- ^ 테오, 라스코프 & 칸토프 2019, "그림 1".
- ^ a b 파텔 외. 2020, 64페이지
- ^ Johnson et al. 2021, "추상적"
- ^ "Funding for Research Areas". National Cancer Institute. 10 May 2022. Retrieved 12 July 2023.
- ^ "Estimates of Funding for Various Research, Condition, and Disease Categories (RCDC)". US National Institutes of Health. 31 March 2023. Retrieved 12 July 2023.
- ^ Kamath, Kircher & Benson 2019, "결과".
- ^ Mai et al. 2022, 2.1 인간 전립선암 세포주
- ^ Mai et al. 2022, 2.4. 오가노이드.
- ^ Mai et al. 2022, 2.2 PDX 라인.
- ^ Mai et al. 2022, 2.3 유전자 조작 마우스 모델(GEMM).
- ^ Ittmann et al. 2013, "소개".
인용된 작품
- Achard V, Putora PM, Omlin A, Zilli T, Fischer S (2022). "Metastatic Prostate Cancer: Treatment Options". Oncology. 100 (1): 48–59. doi:10.1159/000519861. PMID 34781285. S2CID 244132770.
- Bergengren O, Pekala KR, Matsoukas K, Fainberg J, Mungovan SF, Bratt O, et al. (May 2023). "2022 Update on Prostate Cancer Epidemiology and Risk Factors-A Systematic Review". Eur Urol. 84 (2): 191–206. doi:10.1016/j.eururo.2023.04.021. PMID 37202314. S2CID 258780321.
- Brawley S, Mohan R, Nein CD (June 2018). "Localized Prostate Cancer: Treatment Options". American Family Physician. 97 (12): 798–805. PMID 30216009.
- Carlsson SV, Vickers AJ (November 2020). "Screening for Prostate Cancer". Med Clin North Am. 104 (6): 1051–1062. doi:10.1016/j.mcna.2020.08.007. PMC 8287565. PMID 33099450.
- Coleman RE, Croucher PI, Padhani AR, Clézardin P, Chow E, Fallon M, et al. (October 2020). "Bone metastases". Nat Rev Dis Primers. 6 (1): 83. doi:10.1038/s41572-020-00216-3. hdl:20.500.11820/6bac9e59-0afa-4b4a-bebf-4e747b889917. PMID 33060614. S2CID 222350837.
- Dall'Era MA (2023). "39-17: Prostate Cancer". In Papadakis MA, McPhee SJ, Rabow MW, McQuaid KR (eds.). Current Medical Diagnosis & Treatment 2023 (62 ed.). McGraw Hill. ISBN 978-1-2646-8734-3.
- Denmeade SR, Isaacs JT (May 2002). "A history of prostate cancer treatment". Nature Reviews. Cancer. 2 (5): 389–396. doi:10.1038/nrc801. PMC 4124639. PMID 12044015.
- Desai K, McManus JM, Sharifi N (May 2021). "Hormonal Therapy for Prostate Cancer". Endocr Rev. 42 (3): 354–373. doi:10.1210/endrev/bnab002. PMC 8152444. PMID 33480983.
- Hessen MT, ed. (August 2022). "Prostate Cancer". Clinical Overviews. Point of Care. Elsevier.
- Ittmann M, Huang J, Radaelli E, Martin P, Signoretti S, Sullivan R, et al. (May 2013). "Animal models of human prostate cancer: the consensus report of the New York meeting of the Mouse Models of Human Cancers Consortium Prostate Pathology Committee". Cancer Res. 73 (9): 2718–36. doi:10.1158/0008-5472.CAN-12-4213. PMC 3644021. PMID 23610450.
- Johnson BS, Shepard S, Torgeson T, Johnson A, McMurray M, Vassar M (February 2021). "Using Google Trends and Twitter for Prostate Cancer Awareness: A Comparative Analysis of Prostate Cancer Awareness Month and Breast Cancer Awareness Month". Cureus. 13 (2): e13325. doi:10.7759/cureus.13325. PMC 7958554. PMID 33738168.
- Kamath SD, Kircher SM, Benson AB (July 2019). "Comparison of Cancer Burden and Nonprofit Organization Funding Reveals Disparities in Funding Across Cancer Types". J Natl Compr Canc Netw. 17 (7): 849–854. doi:10.6004/jnccn.2018.7280. PMID 31319386. S2CID 197666475.
- Loeb S, Eastham JA (2021). "Diagnosis and Staging of Prostate Cancer". In Partin AW, Dmochowski RR, Kavoussi LR, Peters CA (eds.). Cambell-Walsh-Wein Urology (12 ed.). Elsevier. ISBN 978-0-323-54642-3.
- Lytton B (June 2001). "Prostate cancer: a brief history and the discovery of hormonal ablation treatment". The Journal of Urology. 165 (6 Pt 1): 1859–1862. doi:10.1016/S0022-5347(05)66228-3. PMID 11371867.
- Mai CW, Chin KY, Foong LC, Pang KL, Yu B, Shu Y, et al. (September 2022). "Modeling prostate cancer: What does it take to build an ideal tumor model?". Cancer Lett. 543: 215794. doi:10.1016/j.canlet.2022.215794. PMID 35718268. S2CID 249831438.
- Merriel SW, Funston G, Hamilton W (September 2018). "Prostate Cancer in Primary Care". Adv Ther. 35 (9): 1285–1294. doi:10.1007/s12325-018-0766-1. PMC 6133140. PMID 30097885.
- Mundle R, Afenya E, Agarwal N (September 2021). "The effectiveness of psychological intervention for depression, anxiety, and distress in prostate cancer: a systematic review of literature". Prostate Cancer Prostatic Dis. 24 (3): 674–687. doi:10.1038/s41391-021-00342-3. PMID 33750905. S2CID 232325496.
- Patel MS, Halpern JA, Desai AS, Keeter MK, Bennett NE, Brannigan RE (May 2020). "Success of Prostate and Testicular Cancer Awareness Campaigns Compared to Breast Cancer Awareness Month According to Internet Search Volumes: A Google Trends Analysis". Urology. 139: 64–70. doi:10.1016/j.urology.2019.11.062. PMID 32001306. S2CID 210982209.
- Pernar CH, Ebot EM, Wilson KM, Mucci LA (December 2018). "The Epidemiology of Prostate Cancer". Cold Spring Harb Perspect Med. 8 (12): a030361. doi:10.1101/cshperspect.a030361. PMC 6280714. PMID 29311132.
- Pilié P, Viscuse P, Logothetis CJ, Corn PG (2022). "45: Prostate Cancer". In Kantarjian HM, Wolff RA, Rieber AG (eds.). The MD Anderson Manual of Medical Oncology (4 ed.). McGraw Hill. ISBN 978-1-260-46764-2.
- Rebello RJ, Oing C, Knudsen KE, Loeb S, Johnson DC, Reiter RE, et al. (February 2021). "Prostate cancer". Nat Rev Dis Primers. 7 (1): 9. doi:10.1038/s41572-020-00243-0. PMID 33542230. S2CID 231794303.
- Scher HI, Eastham JA (2022). "87: Benign and Malignant Diseases of the Prostate". In Loscalzo J, Fauci A, Kasper D, et al. (eds.). Harrison's Principles of Internal Medicine (21 ed.). McGraw Hill. ISBN 978-1-264-26850-4.
- Stephenson AJ, Abouassaly R, Klein EA (2021). "Epidemiology, Etiology, and Prevention of Prostate Cancer". In Partin AW, Dmochowski RR, Kavoussi LR, Peters CA (eds.). Cambell-Walsh-Wein Urology (12 ed.). Elsevier. ISBN 978-0-323-54642-3.
- Sandhu S, Moore CM, Chiong E, Beltran H, Bristow RG, Williams SG (September 2021). "Prostate cancer". Lancet. 398 (10305): 1075–1090. doi:10.1016/S0140-6736(21)00950-8. PMID 34370973. S2CID 236941733.
- Teo MY, Rathkopf DE, Kantoff P (January 2019). "Treatment of Advanced Prostate Cancer". Annu Rev Med. 70: 479–499. doi:10.1146/annurev-med-051517-011947. PMC 6441973. PMID 30691365.
- Thompson JC, Wood J, Feuer D (2007). "Prostate cancer: palliative care and pain relief". Br Med Bull. 83: 341–354. doi:10.1093/bmb/ldm018. PMID 17628024.
- Valier H (2016). "The Problematic Prehistory of Prostate Cancer". A History of Prostate Cancer. Springer Nature. ISBN 978-1-4039-8803-4.


