플랑크토균류
Planctomycetota| 플랑크토균류 | |
|---|---|
 | |
| 과학적 분류 | |
| 도메인: | |
| 슈퍼문: | |
| 문: | 플랑크토균류 게리티 홀트 2021[1] |
| 클래스 및 순서[2][3] | |
| |
| 동의어 | |
| |
Planctomycetota는 널리 분포하는 박테리아 문으로, 수생과 육생 모두에서 발생한다.[5]그들은 전지구적인 탄소와 질소 순환에서 상당한 역할을 하며, 이 문의 많은 종들은 아나목스로도 알려진 [5][6]혐기성 암모늄 산화를 할 수 있습니다.많은 Planctomycetota는 [7]생물막으로서 상대적으로 풍부하게 발생하며, 종종 대조류나 해양 [8]스펀지와 같은 다른 유기체와 연관된다.
PVC 슈퍼문에는 녹균류, 클라미디오타, 렌티스파에로타, 키리티마티에라에오타, 칸디다투스 옴니트로피카와 함께 [9][10]플랑크토균류가 포함된다.Planctomycetota 문(문)은 Planctomycetia와 Phycisphaerae로 구성되어 있다.1924년에 처음 기술된 Planctomycetota의 구성원들은 진핵생물로 확인되었고 나중에 [5]1972년에야 박테리아로 기술되었다.Planctomycetota의 구성원들에 대한 초기 검사 결과, 비록 그들이 현재 그램 음성 박테리아로 확인되었지만, 많은 독특한 특징들을 가지고 있지만, 다른 박테리아들과 상당히 다른 세포 계획을 제안했습니다.
Planctomycetota의 박테리아는 종종 작은 구형 세포이지만, 많은 양의 형태학적 변화가 보인다.[11]Planctomycetota의 구성원들은 또한 2분열로 [5][12][13]분열하는 다른 모든 자유생활 박테리아와 대조적으로 많은 종들이 싹을 틔워 분열하는 뚜렷한 번식 습관을 보인다.
Planctomycetota에 대한 관심은 주로 생물 활성 [14]분자의 원천으로서 생명 공학 및 인간 응용에 관한 것이다.게다가, 일부 Planctomycetota는 최근에 인간 [8]병원균으로 묘사되었다.
Gemmata [15][16]obscuriglobus 종은 특히 Planctomycetota 중에서 [5][17][15]스테롤 합성 능력 등 독특한 특성을 가진 박테리아로 구성되어 있는 것으로 확인되었다.
구조와 형태
세포 모양 및 부속품
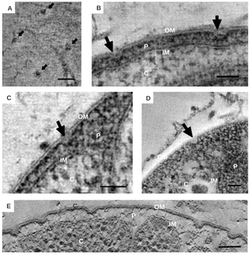
Planctomycetota에서 박테리아의 뚜렷한 형태학적 특성은 광범위하게 [6]논의되어 왔다.일반적인 형태학은 종종 Aquisphaera giovanonii 종에서 관찰된 직경 약 2μm의 구형 세포이다.그러나 세포 모양의 다양성은 종종 크게 다릅니다.난형 세포와 배 모양의 세포는 일부 종에서 설명되어 왔고, 종종 [11]3개에서 10개의 세포로 이루어진 로제트에서 발생합니다.Gemmata obscuriglobus는 구상세포를 가진 Planctomycetota에서 잘 연구된 종이다.반면 Planctopirus limnophila 종의 박테리아는 난형 [15]세포를 가지고 있다.
많은 Planctomycetota 종들은 세포의 바깥 표면에 구조와 부속물을 보여준다.편모는 대부분의 박테리아에서 흔히 볼 수 있으며, [5][11][18]림노필라 종에서도 관찰되고 있습니다.많은 Planctomycetota는 또한 세포를 표면이나 [5][18]기질에 붙이는 홀드패스트, 즉 줄기를 가지고 있다.그러나 이소스에라 팔리다와 같은 몇몇 종의 구성원들은 [5]단식을 하지 않는다.
크레이터형 구조라고 알려진 독특한 부속물이 Planctomycetota 클래스에 속하는 Planctomycetota [13]종에서 관찰되었습니다[5][11][18].림노필라 종의 세포 외부 표면은 크고 작은 분화구 모양의 구조를 보여준다.큰 분화구 모양의 구조가 세포 표면을 덮고 있는 반면, 작은 분화구 모양의 구조는 종종 세포 끝에만 있습니다.광현미경 검사에서 P. 림노필라와 G. 옵스큐리글로부스의 줄기와 필리형 섬유가 모두 확인되었다.이 두 종에 속하는 섬모 섬유는 종종 큰 분화구 구조물과 관련이 있었고, 반대로 줄기 섬유는 작은 분화구 [18]구조물과 관련이 있었다.
세포벽 조성
Planctomycetota의 초기 검사 결과, 그들의 세포 계획은 그램 양성 및 그램 [5]음성 박테리아와 상당히 달랐습니다.최근까지 Planctomycetota의 박테리아는 세포벽에 펩티도글리칸이 부족하다고 생각되었고 대신 단백질 세포벽을 가지고 있다고 제안되었다.펩티도글리칸은 글리칸의 필수 중합체로, 모든 자유 생활 박테리아에 존재하며, 그 강성은 세포의 무결성을 유지하는데 도움을 준다.펩티도글리칸 합성은 세포 분열 중에 필수적이다.최근, G. opscuriglobus 종들의 세포벽에 [5][18]펩티도글리칸이 있는 것이 발견되었다.
내부 세포 조성
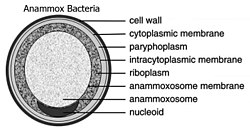
Planctomycetota는 한때 세포 [5][18]내에서 뚜렷한 구획화를 보이는 것으로 생각되었다.G. opscuriglobus의 3차원 전자 단층 촬영 재구성은 이 제안된 구획화에 [16]대한 다양한 해석을 나타냈다.세포질은 세포질 내 막에 의해 유두체와 피렐로솜 양쪽으로 구분되는 것이 제안되었다.그 이후로 이 해석은 잘못된 것으로 입증되었다.실제로 세포질 내막은 독특한 [5][16][18]침투를 나타내는 세포질막으로 잘 알려져 있어 세포질 내에서 구획화가 이루어지는 것처럼 보인다.따라서 Planctomycetota는 그램 음성 박테리아에 전형적인 세포질과 periplasm 두 개의 구획을 표시합니다.
G. opscuriglobus에서 관찰된 여분의 막은 세포 표면적을 부피 대비 3배로 증가시키며, 이는 스테롤 [16]합성과 관련이 있는 것으로 제안된다.
색소
많은 Planctomycetota 종들은 카로티노이드 색소의 생성으로 인해 분홍색 또는 주황색 색소를 보인다.카로티노이드는 식물과 곰팡이, 그리고 산화 스트레스로부터 보호하기 위해 일부 이종 영양 박테리아에 의해 생산된다.세 개의 다른 카로티노이드 색소가 Planctomycetota의 [19]두 다른 변종에서 확인되었다.
해양 환경에서 Planctomycetota는 종종 물기둥에 부유하거나 대조류 표면에 생물막으로 나타나며 유해한 자외선에 노출된다.Planctomycetota의 더 높은 색소종들은 아직 [20]잘 알려지지 않았지만 자외선에 더 강하다.
아나목스 세포의 고유 특성
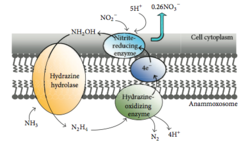
Planctomycetota에서 아나목스가 가능한 박테리아가 Brocadiales목을 [21]형성합니다.아나목스 박테리아의 세포는 직경이 약 0.8μm인 [7]구균형이며, 각각 막으로 둘러싸인 3개의 구획을 포함하는 것이 권장된다.외막은 세포와 원형질을 둘러싸고 있고 가장 안쪽 막은 아나목소좀을 둘러싸고 있는데,[18][22] 아나목소좀은 아나목소박테리아의 중심 구조이다.아나목스막 조성물은 다른 모든 생물과 유사하며 당지질로 [22]구성되어 있다.
생활사 및 재생산
성장
플랑크토마이세토타 [5][10][7][23]종은 다른 박테리아에 비해 천천히 성장하며, 종종 3-5개의 [5][23]세포로 이루어진 로제트 구조를 형성합니다.림노필라 종은 약 6-14일의 두 배 기간을 가지고 비교적 빠르게 [5][24]자라는 것으로 알려져 있다.반면 다른 Planctomycetota는 약 30일 [24]동안 두 배로 증가했습니다.그들의 느린 성장률을 [7][10]고려할 때, 많은 생태계에서 그들의 높은 풍부함은 놀랍습니다.

라이프 사이클
Planctomycetota는 종종 sessile stled 단계와 자유수영 [23]단계 사이에서 라이프스타일 전환을 한다.P. limnophila 종의 구성원들은 종종 세포 분열과 관련된 생활 방식을 바꾼다.세실 모세포는 자유수영 딸세포를 생성한다.그런 다음 다시 사이클을 시작하기 전에 도터 셀을 표면에 부착해야 합니다.그러나 모든 Planctomycetota가 운동성 단계를 가지고 있는 것은 아니며, 많은 종에서 관찰되는 라이프스타일 전환이 모든 Planctomycetota에서 [5]공통적인 것은 아닐 수 있다.

재생산
현재 박테리아 세포 분열에 대한 이해는 [15]대장균과 같은 모델 유기체에 기초하고 있다.거의 모든 박테리아에서 관찰되는 생식의 지배적인 형태는 2분열에 의한 세포 분열이며, 이것은 펩티도글리칸과 FtsZ로 [15][25]알려진 단백질의 합성을 포함한다.반면에, Planctomycetota의 많은 박테리아들은 [5][12][13]싹을 틔워 분열한다.
FtsZ 단백질은 진핵생물에 [26]존재하는 단백질인 튜불린의 구조와 유사하며 세포 분열 [5][6]시 격막 형성에 필수적이다.FtsZ 단백질의 부족은 종종 [5]치명적이다.펩티도글리칸은 또한 [25]이원분열에 의한 세포분열에서 상당한 역할을 한다.
Planctomycetota는 구성원에게 FtsZ [5][25][26]단백질이 없는 것으로 알려진 유일한 식물 중 하나이다.클라미디아에 있는 박테리아도 PVC 슈퍼문의 일원인 FtsZ가 [26]부족하다.Planctomycetota의 박테리아는 FtsZ가 부족하지만, 두 가지 뚜렷한 세포 분열 모드가 [5]관찰되었습니다.대부분의 Planctomycetota는 2분열로 나뉘는데, 주로 Phycisphaerae강의 종이다.반면에, Planctycetia강의 종들은 싹을 [5][12][13]틔워 분열한다.
발아에 관여하는 메커니즘은 효모세포에 대해 광범위하게 설명되어 왔다.그러나 Planctomycetota에서 관찰된 세균의 싹은 아직 [15]잘 알려져 있지 않다.발아는 P. 림노필라 종의 박테리아와 축대칭 [13]세포에서 모두 관찰되었다.P. limnophila 구성원의 세포 분열 동안, 딸 세포는 홀드퍼스트 또는 줄기가 있는 극과 반대쪽 영역에서 유래합니다.
Planctomycetota의 [12][13]박테리아들 사이의 세포 분열에서 상당한 다양성이 관찰되었다.마리스게르마니케의 세포분열 중에 봉아리에서 모세포로 [5][21]관상구조가 연결된다.Kolteria novifilia 종은 Planctomycetota의 독특한 분지군을 형성하고 있으며, 세포 중간에서 측방 싹으로 분열하는 것으로 알려진 유일한 종입니다.마지막으로, 살타토렐루스 군락의 구성원들은 2분열과 [12][13]싹을 모두 바꿀 수 있다.
유전적 특성
분자 시그니처
Planctomycetota는 특이한 세포 특성으로 알려져 있으며, 다른 모든 박테리아와의 구별은 두 개의 보존된 시그니처 인델(CSI)[27]의 공유 존재에 의해 추가적으로 뒷받침된다.이러한 CSI에 의해 PVC [28]그룹 내의 네이버 Phyla에서 그룹이 구분됩니다.Kuenia stuttuartiensis를 제외한 모든 Planctomycetota 종이 공유하는 추가적인 CSI가 발견되었습니다.이것은 K. stuttuartiensis가 Planctomycetota 문 안에서 깊은 가지를 형성한다는 생각을 뒷받침한다.
또한 CSI는 Planctomycetota를 포함한 PVC [27][28]슈퍼문 전체에 의해 공유되는 것으로 확인되었습니다.Planctomycetota는 또한 PVC 슈퍼문에 [29]속하는 구성원에게 독점적인 중요한 하우스키핑 기능을 하는 것이 특징인 중요한 보존 시그니처 단백질을 포함하고 있다.
일반적인 특징
로도피렐룰라 발틱타의 게놈 크기는 700만 개 이상의 염기로 추정되며, 이는 염기서열상 가장 큰 원핵생물 게놈 중 하나이다.광범위한 게놈 복제는 게놈 [6]배열의 약 25%를 차지한다.이것은 유기체가 돌연변이에 적응할 수 있는 방법일 수 있으며, 게놈의 일부가 손상되었을 때 중복을 허용할 수 있다.중합효소 연쇄반응 프라이머는 유전자와 일치하지 않는 경우가 많아 게놈 [9]배열에 어려움을 겪었다.
현미경으로 비교할 때, 일부 Planctomycetota의 결정적인 특징은 원점 근처에서 단일 비연결 rRNA 오퍼론이 식별될 수 있다는 것이다.유전자 물질의 변화는 내부 염색체 반전을 통해 이루어지며, 측방향 유전자 전달을 통한 것이 아니다.이것은 Planctomycetota 변종에서 다양한 방법을 만들어냅니다. 이러한 지역의 다중 트랜스포존 유전자가 재배열로 이동하는 역방향성을 가지기 때문입니다.
일부 Planctomycetota는 고농도 [6]질산염이 함유된 지역에서 번성하며 헤테로톡시산 발효에 필요한 유전자를 가지고 있다.젖산탈수소효소는 이 과정에서 중요한 역할을 한다.유전자 과정은 자외선 차단 반응도 있어 환경이 과도한 자외선 스트레스를 줄 때 발현되는 광분해효소 유전자 외에 recA, lexA, uvrA, uvrB, uvrC 유전자와도 관련이 있다.다른 스트레스 반응에는 과산화수소의 분해와 산화가 포함됩니다.
많은 Planctomycetota 또한 술파타아제 유전자를 발현한다.피렐룰라 균주 1의 게놈은 술파타아제 효소를 생성하는 단백질을 코드하는 데 기여하는 110개의 유전자를 포함하고 있다.다른 종류의 원핵생물인 Pseudomonas aeruginosa와 비교했을 때, 6개의 술파타아제만이 발생하며, 이러한 단백질을 발현하는 유전자는 2개에서 [6]5개의 쌍으로 포함되며, 보통 22개의 그룹으로 군집화된다.
분자 진화
Planctomycetota는 박테리아 내에서 발생하며 Planctomycetales와 진핵생물 사이의 이러한 유사성은 수렴 진화를 반영한다.Planctomycetota 내의 하위 그룹인 Gemmataceae의 획득 단백질군은 진핵생물 단백질과 배열 유사성이 낮지만 다른 Gemmataceae 단백질군과 [30]배열 유사성이 가장 높다.
Gemmataceae 내에 새로운 단백질 패밀리가 대량으로 출현하고 있다.1,000개 이상의 단백질 패밀리가 복제와 도메인 재배치에 의해 획득되었습니다.새로운 패럴로그는 신호 전달, 조절 시스템 및 단백질 상호작용 경로에서 기능합니다.이들은 세포의 기능적 구성과 관련이 있으며, 이는 보다 복잡한 [30]라이프스타일에 적응하는 것으로 해석될 수 있다.단백질 길이는 Gemmataceae에서 대부분의 다른 박테리아보다 길고 유전자는 링커를 가지고 있습니다.Planctomycetales에서 가장 긴 단백질과 진핵생물에서 가장 짧은 단백질 사이에는 겹치는 부분이 있다.유전자 병렬학, 단백질 길이, 단백질 도메인 구조 측면에서 원핵생물과 진핵생물은 뚜렷한 [30]경계를 가지고 있지 않다.
계통발생학
원래 형태학으로 인해 진핵생물로 분류되었던 유전자 염기서열 분석의 출현은 연구자들이 Planctomycetota가 [5]박테리아라는 도메인에 속한다는 것에 동의하게 했다.이 영역 내에서 Planctomycetota는 그들 자신의 문으로 분류되지만, 다른 연구자들은 또한 Phyla Verucomicrobia, Chlamidae, Lentisphaerae와 후보 문인 "Candidatus Omnitrophica"[9]를 포함하는 PVC라는 이름의 더 큰 슈퍼문 일부로 분류될 수 있다고 주장했습니다.이 슈퍼문 안에서, 그것의 구성원들은 16S rRNA 나무의 생성을 통해 밀접한 관련이 있는 것으로 밝혀졌다.Planctomycetota와 Chlamydiota는 모두 뉴클레오티드 전달체를 위한 단백질을 부호화하며, Verrucomic biota 또한 진핵 세포에서 공통적인 특징을 가지고 있는 것으로 밝혀졌다.따라서, 이 슈퍼문의 공통 조상은 진핵생물 [9]혈통의 시작이었을지도 모른다.PVC가 박테리아 [31]나무의 시작이 아니기 때문에 진핵생물 특징과 유전자의 존재는 보다 최근의 진핵생물 [9]조상이 아닌 측면 유전자 이동을 통해 설명될 가능성이 높다.
모든 종류의 살아있는 나무 [32]프로젝트의 작업에 기초한 계통 발생:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
생태학
분포와 풍부함
Planctomycetota의 일원들은 지리적으로나 [33]생태적으로 다양한 환경에서 발견되며, 수생과 육생 [5]서식지에서 모두 발견된다.수생 환경에서, 그것들은 담수와 해양 [33]시스템 모두에서 발견됩니다.Planctomycetota는 원래 수중 환경에만 존재한다고 믿었지만, 토양과 과염색 [35]환경에도 풍부한[34] 것으로 알려져 있다.그들은 남극과 [34][33]호주를 포함한 5개 대륙에 널리 분포한다.
현장 형광 교배는 다양한 환경에서 Planctomycetota를 검출하기 위해 사용되었으며 Planctomycetota는 pphagnum 늪에서 풍부하게 발견된다.몇몇 Planctomycetota는 해양 생물들의 소화기관에서 발견되는 반면, 다른 것들은 진핵 [9]생물들 사이에서 사는 경향이 있다.
유통에 대한 환경 영향
Planctomycetota는 해양 시스템에서 원핵생물 군집의 약 11%를 차지하고 있으며, 그들의 광대한 분포는 다양한 환경에서 서식할 수 있는 능력을 보여준다.그들은 또한 에어로빅과 혐기성 조건 모두에 적응할 수 있다.습도, 산소 수준 및 pH 수준과 같은 많은 요인이 분포에 영향을 미칠 수 있습니다.플랜트 균사체의 다양성과 풍부성은 상대 습도와 강하게 관련되어 있다.산소 수준의 영향은 개인의 에너지 수요를 보여준다.G. opscuriglobus를 포함한 Planctomycetota의 많은 종은 화학적인 영양성입니다.열수 분출구 지역을 차지하는 호열성 혐기성 종인 서모스틸라 마리나는 황화물을 생성하고 질산염으로 호흡하기 위해 원소 유황을 사용할 수 있다.Planctomycetota는 또한 pH가 4.2에서 11.[8]6 사이인 지역에 서식할 수 있다.
생태학적 영향과 전지구적 탄소 순환
Planctomycetota는 [6][20]물기둥에 있는 찌꺼기 입자를 광물화하고 분해하는 능력으로 지구 생물 화학과 기후에 큰 영향을 미칩니다.
Planctomycetota는 지구 탄소 [5][6][13][36]순환에서 중요한 역할을 한다.필수 및 조건성 호기성 화학 헤테로트로프로서 Planctomycetota에 의해 사용되는 탄소의 1차 공급원은 탄수화물이다.많은 Planctomycetota는 매우 복잡한 탄수화물을 분해할 수 있는 능력을 가지고 있으며, 이러한 영양소를 다른 유기체가 이용할 수 있게 한다.탄소를 재활용하는 이러한 능력은 많은 Planctomycetota에서 관찰되는 특정 C1 대사 유전자와 연관되어 있고 중요한 역할을 할 것으로 제안되고 있지만, 이 연구 영역은 여전히 잘 알려져 있지 않다.
Planctomycetota는 또한 많은 대조류에 의해 생성되는 황산 헤테로 다당류를 분해할 수 있는 많은 술파타아제 효소를 가지고 있다.Planctomycetota에 의한 황산 헤테로다당류의 분해는 에너지원으로 사용된다.일부 Planctomycetota는 카라게난 [36]분해능력이 있다고 제안되었다.
다른 유기체와의 연관성
플랑크토균은 대조류, 미세조류, 해양해면동물, 지의류,[8] 이끼류 등의 식물과 함께 종종 관찰된다.그들은 또한 튜브벌레에 [5]사는 지배적인 유기체인 심해 한랭 침출물에 서식하는 것이 관찰되었습니다.
대조류
Planctomycetota는 종종 영양분이 풍부한 해양 표면과 관련이 있다.그것들은 조류 표면에서 생물막으로 비교적 [7]풍부하게 발생한다.Kelps Laminaria hypotorea와 Ecklonia radiata와 같은 대조류는 Planctomycetota의 [5][37]중요한 서식지가 될 수 있다.에클로니아 방사선에 있는 박테리아 군집의 약 70%는 Planctomycetota였다.[5][10]거의 150종의 플랜토균종이 대조류의 생물로부터 분리되었고, 대조류와 관련된 이러한 군집은 주로 지리적 분포의 변화와 독립적이다.이것은 공생 [8]관계를 암시합니다.
다시마 숲은 기온 지역의 바위 해안선을 지배하고, Planctomycetota를 [5]포함한 많은 생물들에게 서식처, 피난처, 먹이를 제공합니다.해안 1차 생산성에 있어 다시마 숲의 상당한 역할을 고려할 때, Planctomycetota와 다시마의 연관성은 해안 [38]서식지에서 중요한 역할을 나타낼 수 있다.Planctomycetota는 [39]또한 표면에 부착되는 능력을 감안할 때 해양 [5][38]눈이라고도 알려진 물기둥의 잔해 성분으로 중요한 역할을 한다.
기후가 계속 따뜻해짐에 따라, 대조류와 관련된 Planctomycetota의 풍부함이 증가할 수 있다.미역 Caulerpa taxifolia는 높은 CO 조건에서2 배양되었으며, Planctomycetota의 풍부성은 일부 [5]종에서 10배까지 상당히 증가하였다.
미세조류 및 규조개 개화
대조류는 플랜토균 군집의 잘 알려진 기질이지만, 그 풍부함은 또한 [38][5]규조류와 같은 미세조류의 꽃과 관련이 있는 것으로 알려져 있다.시아노박테리아, 디아톰, 그리고 디노플라겔라테의 꽃은 Planctomycetota에 영양분을 공급하는데,[8] 이것은 연관성을 설명할 수 있다.
해면류
플랑크토마균종은 종종 해양 [8][39]해면의 표면과 관련이 있다.그들은 홀드패스트와 애착을 가지거나 공생 관계를 통해 스폰지와 상호작용합니다.다양한 Planctomycetota가 스펀지의 바이오 필름으로 존재한다.스펀지와 플랑크토마 [8]사이의 공생 관계는 스펀지의 건강에 기여하며, 스펀지는 종종 플랑크토마에게 적절한 서식지와 영양분을 제공한다.
이끼 군집과 구렁텅이 늪
Planctomycetota는 시베리아 북서부 지역의 이끼 군락에서 매우 풍부하고 매우 높은 다양성을 보였다.플랑크토마균은 또한 이끼 군집과 스파그넘 습지와 연관되어 있다.스피넘 습지는 많은 양의 탄소를 저장하여 지구 탄소 순환에 기여합니다.Planctomycetota는 세균 [8]군집의 약 15%를 차지하며, 주머니의 분해에 상당한 역할을 한다.
기타 세균 군집
Planctomycetota는 주로 Alphaproteobacteria, 박테로이드타, Gemmatimonadota, Verrucomic biobota와 같은 다른 박테리아 군집과의 연관성을 보여준다.많은 Planctomycetota의 성장은 종종 지역사회 내의 다른 박테리아에 의해 제공되는 필수 영양소에 의해 지원되며, 일부 Planctomycetota는 다른 [8]박테리아와의 공생 관계에 강하게 의존한다.
생리학
엔도사이토시스
세포질 내막 근처에 막 피복 단백질의 존재는 진핵생물 영역 밖에서 발견된 첫 번째 사례가 될 수 있는 세포질 내막 유사 흡수 시스템에 사용될 수 있다.하지만, 이제 단단한 펩티도글리칸 세포벽의 존재가 확인되었기 때문에, 이 세포벽을 통과할 수 있을 것 같지 않다.또한, 림노필라 내에서 이러한 막 외피 단백질 중 하나를 제거해도 고분자 [18]흡수가 감소하지 않았다.또한, 저온 전자 단층 촬영에 기초한 Planctomycetota의 3차원 재구성을 통해 원래 증배막에 있는 소포로 생각되었던 것이 실제로는 세포질막의 [5]주름일 뿐이라는 것을 발견했다.그러나 Planctomycetota는 고분자 다당류를 탄소의 유일한 공급원으로서 생존할 수 있다는 것이 입증되었고, 이는 그들이 세포질에 복잡한 탄소 기질을 통합할 수 있는 능력을 가져야 한다는 것을 의미한다.세 가지 가설이 제시되었다: 첫째, Planctomycetota는 세포벽 밖에서 복잡한 기질을 더 작은 단당류로 분해하는 효소를 배설하고, 이것은 다른 막을 통해 더 쉽게 운반될 수 있다.둘째, 복잡한 기질들은 Planctomycetota의 바깥쪽에 고정되고, 그 후 이러한 기질들을 서서히 올리고당으로 분해할 수 있으며, 올리고당은 특수 단백질에 의해 Planctomycetota의 배수로 운반될 수 있다.세 번째 가설은 Planctomycetota 세포벽 외부에서 발견된 분화구 구조입니다.이 구조들은 섬유들이 그들의 구덩이에 늘어선 채로 있는데, 그것은 전체 다당류를 흡수할 수 있고,[18] 그곳에서 소화될 수 있다.
삼투압 조절
거의 모든 박테리아는 펩티도글리칸 세포벽의 외형을 따라 세포질을 가지고 있다.진핵생물은 세포질이 핵과 같은 소기관들을 만들기 위해 여러 구획으로 나뉘어 있다는 점에서 다르다.Planctomycetota는 세포질막의 큰 침입을 가지고 있으며, 펩티도글리칸 세포벽에서 떨어져 나가고 periplasm의 여지를 남긴다는 점에서 독특하다.전통적으로 세포질막은 박테리아 세포의 삼투압을 조절하는 역할을 하는 것으로 여겨져 왔다.그러나 세포질막의 주름과 Planctomycetota 내에 큰 공간의 periplasm의 존재로 인해, 그들의 펩티도글리칸은 periplasm이 세포질에 [5]등가성이 되어 삼투압 장벽으로 작용한다.
혐기성 암모늄 산화(아나목스)
아나목스는 아질산염이 전자수용체 역할을 하는 암모늄을 산화시키는 과정이다.이 과정은 인간이 포도당 [40]산화로부터 에너지를 얻는 것과 같은 방식으로 유기체가 반응을 수행할 수 있도록 에너지를 생성한다.해양 환경에서는 식물성 플랑크톤이 N가스를 사용할 수 없고 대기 중으로 방출되기 때문에 궁극적으로2 물에서 질소를 제거한다.해양에서 발생하는 디니트로겐 가스의 최대 67%는[41] [42]아나목스이며 대기 중 질소 가스의 약 50%는 아나목스로부터 생성되는 것으로 생각됩니다.Planctomycetota는 Anamox를 수행할 수 있는 박테리아 중 가장 지배적인 문이며, 따라서 Anamox를 수행할 수 있는 Planctomycetota는 [43]질소의 전지구 순환에 중요한 역할을 합니다.
스테롤 합성
스테롤의 합성은 진핵생물에서 종종 관찰되고 박테리아에서 드물게 관찰되며 Planctomycetota에서는 [5][15]매우 드물게 관찰된다.라노스테롤과 같은 스테롤의 합성은 G. opscuriglobus에서 관찰되었다.라노스테롤은 진핵생물과 메틸영양성 유사모나도타와 점액박테리아 두 가지 다른 박테리아 그룹에서 흔하다.G. opscuriglobus에서 관찰된 스테롤의 합성은 Planctomycetota 내에서 특이하다.스테롤 합성은 Planctomycetota의 [15]막 유동성 조절과 관련이 있는 것으로 제안되며, G. opscuriglobus의 [17]적절한 성장과 번식에 필수적인 것으로 설명되어 왔다.
생명공학 및 인간 응용
최근에는 바이오 활성 [8][14]분자를 중심으로 제약업계에 대한 관심의 원천으로서 생명공학에서의 Planctomycetota의 잠재적인 역할에 대한 검토에 관심이 높아지고 있다.생물활성화합물은 주로 2차 [14]대사물로 존재하지만 Planctomycetota 2차 [44]대사물에 대해서는 거의 알려져 있지 않다.Planctomycetota는 Myxobacteria와 [44]같은 생물 활성 분자의 다른 알려진 생산자들로서 몇 가지 주요 특징을 가지고 있기 때문에 이것은 예상 밖이다.하지만, 진행 중인 많은 연구들이 Planctomycetota를 인간을 위한 소분자 약물 개발에 포함시키는 다양한 첫 단계 역할을 한다.
플랑크토균종은 진핵세포 내막계의 [35]기원과 진화의 다른 측면과 함께 핵의 기원에 대한 현재의 모델에 도전하는 데 있어 고려할 가치가 있다.
기후 변화
Planctomycetota와 그 사용에 대한 연구의 영향은 영양소 순환 과정과 관련하여 전 세계적으로 중요할 수 있으며, 전세계 해양 생물 지구 화학에 대한 이해를 증진하는 데 도움이 될 수 있다.그러나 Planctomycetota가 물과 공기를 포함한 대사 과정에 미치는 영향이 증가함에 따라, 그것은 또한 잠재적으로 기후 [35]변화에 영향을 미치면서 해양과 대기 사이의 교환에 역할을 할 수도 있다.
병원체로서의 플랜트 균사체
Planctomycetota 종은 최근 기회주의적 인간 [citation needed]병원체로 확인되었지만, 배지의 부족으로 Planctomycetota의 박테리아에 대한 연구가 인간의 [8]병원체로 제한되었습니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Oren A, Garrity GM (2021). "Valid publication of the names of forty-two phyla of prokaryotes". Int J Syst Evol Microbiol. 71 (10): 5056. doi:10.1099/ijsem.0.005056. PMID 34694987.
- ^ Euzéby JP, Parte AC. ""Planctomycetes"". List of Prokaryotic names with Standing in Nomenclature (LPSN). Retrieved August 26, 2021.
- ^ Sayers; et al. "Planctomycetes". National Center for Biotechnology Information (NCBI) taxonomy database. Retrieved 2016-03-20.
- ^ Garrity GM, Holt JG. (2001). "The Road Map to the Manual". In Boone DR, Castenholz RW, Garrity GM. (eds.). Bergey's Manual of Systematic Bacteriology. Vol. 1 (The Archaea and the deeply branching and phototrophic Bacteria) (2nd ed.). New York, NY: Springer-Verlag. pp. 119–166.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak Wiegand S, Jogler M, Jogler C (November 2018). "On the maverick Planctomycetes". FEMS Microbiology Reviews. 42 (6): 739–760. doi:10.1093/femsre/fuy029. PMID 30052954.
- ^ a b c d e f g h Glöckner FO, Kube M, Bauer M, Teeling H, Lombardot T, Ludwig W, et al. (July 2003). "Complete genome sequence of the marine planctomycete Pirellula sp. strain 1". Proceedings of the National Academy of Sciences of the United States of America. 100 (14): 8298–303. Bibcode:2003PNAS..100.8298G. doi:10.1073/pnas.1431443100. PMC 166223. PMID 12835416.
- ^ a b c d e Boersma AS, Kallscheuer N, Wiegand S, Rast P, Peeters SH, Mesman RJ, et al. (December 2020). "Alienimonas californiensis gen. nov. sp. nov., a novel Planctomycete isolated from the kelp forest in Monterey Bay". Antonie van Leeuwenhoek. 113 (12): 1751–1766. doi:10.1007/s10482-019-01367-4. PMID 31802338. S2CID 208641991.
- ^ a b c d e f g h i j k l Kaboré OD, Godreuil S, Drancourt M (2020). "Planctomycetes as Host-Associated Bacteria: A Perspective That Holds Promise for Their Future Isolations, by Mimicking Their Native Environmental Niches in Clinical Microbiology Laboratories". Frontiers in Cellular and Infection Microbiology. 10: 519301. doi:10.3389/fcimb.2020.519301. PMC 7734314. PMID 33330115.
- ^ a b c d e f Wagner, Michael; Horn, Matthias (2006-06-01). "The Planctomycetes, Verrucomicrobia, Chlamydiae and sister phyla comprise a superphylum with biotechnological and medical relevance". Current Opinion in Biotechnology. Environmental biotechnology/Energy biotechnology. 17 (3): 241–249. doi:10.1016/j.copbio.2006.05.005. ISSN 0958-1669. PMID 16704931.
- ^ a b c d Kohn, Timo; Rast, Patrick; Kallscheuer, Nicolai; Wiegand, Sandra; Boedeker, Christian; Jetten, Mike S. M.; Jeske, Olga; Vollmers, John; Kaster, Anne-Kristin; Rohde, Manfred; Jogler, Mareike (2020). "The Microbiome of Posidonia oceanica Seagrass Leaves Can Be Dominated by Planctomycetes". Frontiers in Microbiology. 11: 1458. doi:10.3389/fmicb.2020.01458. ISSN 1664-302X. PMC 7366357. PMID 32754127.
- ^ a b c d Lage OM, Bondoso J, Lobo-da-Cunha A (October 2013). "Insights into the ultrastructural morphology of novel Planctomycetes". Antonie van Leeuwenhoek. 104 (4): 467–76. doi:10.1007/s10482-013-9969-2. PMID 23857394. S2CID 17003623.
- ^ a b c d e Kumar D, Kumar G, Jagadeeshwari U, Sasikala C, Ramana CV (April 2021). ""Candidatus Laterigemmans baculatus" gen. nov. sp. nov., the first representative of rod shaped planctomycetes with lateral budding in the family Pirellulaceae". Systematic and Applied Microbiology. 44 (2): 126188. doi:10.1016/j.syapm.2021.126188. PMID 33647766. S2CID 232091472.
- ^ a b c d e f g h Wiegand S, Jogler M, Boedeker C, Pinto D, Vollmers J, Rivas-Marín E, et al. (January 2020). "Cultivation and functional characterization of 79 planctomycetes uncovers their unique biology". Nature Microbiology. 5 (1): 126–140. doi:10.1038/s41564-019-0588-1. PMC 7286433. PMID 31740763.
- ^ a b c Graça AP, Calisto R, Lage OM (2016). "Planctomycetes as Novel Source of Bioactive Molecules". Frontiers in Microbiology. 7: 1241. doi:10.3389/fmicb.2016.01241. PMC 4982196. PMID 27570520.
- ^ a b c d e f g h Rivas-Marin E, Peeters SH, Claret Fernández L, Jogler C, van Niftrik L, Wiegand S, Devos DP (January 2020). "Non-essentiality of canonical cell division genes in the planctomycete Planctopirus limnophila". Scientific Reports. 10 (1): 66. Bibcode:2020NatSR..10...66R. doi:10.1038/s41598-019-56978-8. PMC 6952346. PMID 31919386.
- ^ a b c d e Santarella-Mellwig R, Pruggnaller S, Roos N, Mattaj IW, Devos DP (2013-05-21). "Three-dimensional reconstruction of bacteria with a complex endomembrane system". PLOS Biology. 11 (5): e1001565. doi:10.1371/journal.pbio.1001565. PMC 3660258. PMID 23700385.
- ^ a b Rivas-Marin, Elena; Stettner, Sean; Gottshall, Ekaterina Y.; Santana-Molina, Carlos; Helling, Mitch; Basile, Franco; Ward, Naomi L.; Devos, Damien P. (2019-07-02). "Essentiality of sterol synthesis genes in the planctomycete bacterium Gemmata obscuriglobus". Nature Communications. 10 (1): 2916. Bibcode:2019NatCo..10.2916R. doi:10.1038/s41467-019-10983-7. ISSN 2041-1723. PMC 6606645. PMID 31266954.
- ^ a b c d e f g h i j Boedeker C, Schüler M, Reintjes G, Jeske O, van Teeseling MC, Jogler M, et al. (April 2017). "Determining the bacterial cell biology of Planctomycetes". Nature Communications. 8 (1): 14853. Bibcode:2017NatCo...814853B. doi:10.1038/ncomms14853. PMC 5394234. PMID 28393831.
- ^ Kallscheuer N, Moreira C, Airs R, Llewellyn CA, Wiegand S, Jogler C, Lage OM (December 2019). "Pink- and orange-pigmented planctomycetes produce saproxanthin-type carotenoids including a rare C45 carotenoid" (PDF). Environmental Microbiology Reports. 11 (6): 741–748. doi:10.1111/1758-2229.12796. PMID 31600855.
- ^ a b Viana F, Lage OM, Oliveira R (October 2013). "High ultraviolet C resistance of marine Planctomycetes". Antonie van Leeuwenhoek. 104 (4): 585–95. doi:10.1007/s10482-013-0027-x. hdl:1822/50752. PMID 24052365. S2CID 13153498.
- ^ a b Kohn T, Heuer A, Jogler M, Vollmers J, Boedeker C, Bunk B, et al. (2016). "Fuerstia marisgermanicae gen. nov., sp. nov., an Unusual Member of the Phylum Planctomycetes from the German Wadden Sea". Frontiers in Microbiology. 7: 2079. doi:10.3389/fmicb.2016.02079. PMC 5177795. PMID 28066393.
- ^ a b Kartal, Boran; de Almeida, Naomi M.; Maalcke, Wouter J.; Op den Camp, Huub J.M.; Jetten, Mike S.M.; Keltjens, Jan T. (2013-05-01). "How to make a living from anaerobic ammonium oxidation". FEMS Microbiology Reviews. 37 (3): 428–461. doi:10.1111/1574-6976.12014. ISSN 0168-6445. PMID 23210799.
- ^ a b c Peeters SH, Wiegand S, Kallscheuer N, Jogler M, Heuer A, Jetten MS, et al. (December 2020). "Three marine strains constitute the novel genus and species Crateriforma conspicua in the phylum Planctomycetes". Antonie van Leeuwenhoek. 113 (12): 1797–1809. doi:10.1007/s10482-019-01375-4. PMID 31894495. S2CID 209516837.
- ^ a b Jogler C, Glöckner FO, Kolter R (August 2011). "Characterization of Planctomyces limnophilus and development of genetic tools for its manipulation establish it as a model species for the phylum Planctomycetes". Applied and Environmental Microbiology. 77 (16): 5826–9. Bibcode:2011ApEnM..77.5826J. doi:10.1128/AEM.05132-11. PMC 3165242. PMID 21724885.
- ^ a b c d e Rivas-Marín E, Canosa I, Devos DP (2016). "Evolutionary Cell Biology of Division Mode in the Bacterial Planctomycetes-Verrucomicrobia-Chlamydiae Superphylum". Frontiers in Microbiology. 7: 1964. doi:10.3389/fmicb.2016.01964. PMC 5147048. PMID 28018303.
- ^ a b c Bernander R, Ettema TJ (December 2010). "FtsZ-less cell division in archaea and bacteria". Current Opinion in Microbiology. Growth and development: eukaryotes/prokaryotes. 13 (6): 747–52. doi:10.1016/j.mib.2010.10.005. PMID 21050804.
- ^ a b Gupta RS, Bhandari V, Naushad HS (2012). "Molecular Signatures for the PVC Clade (Planctomycetes, Verrucomicrobia, Chlamydiae, and Lentisphaerae) of Bacteria Provide Insights into Their Evolutionary Relationships". Frontiers in Microbiology. 3: 327. doi:10.3389/fmicb.2012.00327. PMC 3444138. PMID 23060863.
- ^ a b Gupta RS (July 2016). "Impact of genomics on the understanding of microbial evolution and classification: the importance of Darwin's views on classification". FEMS Microbiology Reviews. 40 (4): 520–53. doi:10.1093/femsre/fuw011. PMID 27279642.
- ^ Lagkouvardos I, Jehl MA, Rattei T, Horn M (January 2014). "Signature protein of the PVC superphylum". Applied and Environmental Microbiology. 80 (2): 440–5. Bibcode:2014ApEnM..80..440L. doi:10.1128/AEM.02655-13. PMC 3911108. PMID 24185849.
- ^ a b c Mahajan, Mayank; Yee, Benjamin; Hägglund, Emil; Guy, Lionel; Fuerst, John A; Andersson, Siv G E (2019-12-11). "Paralogization and New Protein Architectures in Planctomycetes Bacteria with Complex Cell Structures". Molecular Biology and Evolution. 37 (4): 1020–1040. doi:10.1093/molbev/msz287. ISSN 0737-4038.
- ^ Strous M, Pelletier E, Mangenot S (6 April 2006). "Deciphering the evolution and metabolism of an anammox bacterium from a community genome". Nature. 440 (7085): 790–794. Bibcode:2006Natur.440..790S. doi:10.1038/nature04647. PMID 16598256. S2CID 4402553.
- ^ "16S rRNA-based LTP release 123 (full tree)" (PDF). Silva Comprehensive Ribosomal RNA Database. Retrieved 2016-03-20.
- ^ a b c Fuerst, John (2004). "Planctomycetes: A phylum of emerging interest for microbial evolution and ecology". World Federation for Culture Collections Newsletter. 38. CiteSeerX 10.1.1.538.2883.
- ^ a b Buckley, Daniel H.; Huangyutitham, Varisa; Nelson, Tyrrell A.; Rumberger, Angelika; Thies, Janice E. (2006-07-01). "Diversity of Planctomycetes in Soil in Relation to Soil History and Environmental Heterogeneity". Applied and Environmental Microbiology. 72 (7): 4522–4531. Bibcode:2006ApEnM..72.4522B. doi:10.1128/AEM.00149-06. ISSN 0099-2240. PMC 1489350. PMID 16820439.
- ^ a b c Fuerst, J. A. (1995-07-01). "The planctomycetes: Emerging models for microbial ecology, evolution and cell biology". Microbiology. 141 (7): 1493–1506. doi:10.1099/13500872-141-7-1493. ISSN 1350-0872. PMID 7551018.
- ^ a b Woebken D, Teeling H, Wecker P, Dumitriu A, Kostadinov I, Delong EF, et al. (September 2007). "Fosmids of novel marine Planctomycetes from the Namibian and Oregon coast upwelling systems and their cross-comparison with planctomycete genomes". The ISME Journal. 1 (5): 419–35. doi:10.1038/ismej.2007.63. PMID 18043661. S2CID 23859244.
- ^ Bondoso J, Balagué V, Gasol JM, Lage OM (June 2014). "Community composition of the Planctomycetota associated with different macroalgae". FEMS Microbiology Ecology. 88 (3): 445–56. doi:10.1111/1574-6941.12258. PMID 24266389.
- ^ a b c Fuerst JA (October 2005). "Intracellular compartmentation in planctomycetes". Annual Review of Microbiology. 59 (1): 299–328. doi:10.1146/annurev.micro.59.030804.121258. PMID 15910279.
- ^ a b Izumi H, Sagulenko E, Webb RI, Fuerst JA (October 2013). "Isolation and diversity of planctomycetes from the sponge Niphates sp., seawater, and sediment of Moreton Bay, Australia". Antonie van Leeuwenhoek. 104 (4): 533–46. doi:10.1007/s10482-013-0003-5. PMID 23959164. S2CID 12315225.
- ^ Kartal, Boran (2011). Cultivation, Detection, andEcophysiology of AnaerobicAmmonium-Oxidizing Bacteria. San Diego CA: Academic Press. pp. 89–108. ISBN 978-0-12-381294-0.
- ^ Qian; et al. (2018). "Diversity and distribution of anammox bacteria in water column and sediments of the Eastern Indian Ocean". International Biodeterioration & Biodegradation. 133: 52–62. doi:10.1016/j.ibiod.2018.05.015.
- ^ Teeseling; et al. (2015). "Anammox Planctomycetes have a peptidoglycan cell wall". Nature Communications. 6: 6878. Bibcode:2015NatCo...6.6878V. doi:10.1038/ncomms7878. PMC 4432595. PMID 25962786.
- ^ Jing; et al. (2015). "A snapshot on spatial and vertical distribution of bacterial communities in the eastern Indian Ocean". Acta Oceanologica Sinica. 35 (6): 85–93. doi:10.1007/s13131-016-0871-4. S2CID 89295982.
- ^ a b Jeske, Olga; Jogler, Mareike; Petersen, Jörn; Sikorski, Johannes; Jogler, Christian (2013-10-01). "From genome mining to phenotypic microarrays: Planctomycetes as source for novel bioactive molecules". Antonie van Leeuwenhoek. 104 (4): 551–567. doi:10.1007/s10482-013-0007-1. ISSN 1572-9699. PMID 23982431. S2CID 18752686.