자기공명영상물리학
Physics of magnetic resonance imaging
자기공명영상물리학(MRI)은 MRI 기법의 기본적인 물리적 고려사항과 MRI 기기의 기술적 측면을 다룬다. MRI는 방사선과 핵의학에서 주로 사용하는 의료영상 기법으로 신체의 해부학적 구조와 생리를 조사하고, 종양, 염증, 뇌졸중 등 신경학적 조건, 근육과 관절의 장애, 심장과 혈관의 이상 등을 비롯한 병리학적 특성을 검출하기 위한 것이다. 조영제를 정맥주사 또는 관절에 주입하여 이미지를 개선하고 진단을 용이하게 할 수 있다. MRI는 CT나 X선과 달리 이온화 방사선을 사용하지 않아 어린이와 반복 주행 시 진단에 적합한 안전한 시술이다. 오늘날 특정 비자성 금속 임플란트, 달팽이관 임플란트, 심장박동기를 가진 환자들도 강한 자기장의 영향에도 불구하고 MRI를 가질 수 있다. 이는 구형 기기에는 적용되지 않으며, 의료 전문가에 대한 세부 정보는 기기 제조업체에서 제공한다.
특정 원자핵은 외부 자기장에 놓였을 때 전파 에너지를 흡수하고 방출할 수 있다. 임상 및 연구 MRI에서 수소 원자는 검사 중인 해부학적 구조에 근접한 안테나에 의해 수신되는 검출 가능한 무선 주파수 신호를 생성하기 위해 가장 많이 사용된다. 수소 원자는 사람과 다른 생물학적 유기체, 특히 물과 지방에 풍부하다. 이 때문에 대부분의 MRI 촬영은 기본적으로 체내 수분과 지방의 위치를 지도화한다. 전파의 펄스는 핵 스핀 에너지 전환을 자극하고 자기장 구배는 우주에서 신호를 국소화한다. 펄스 시퀀스의 매개변수를 변화시킴으로써, 그 안에서 수소 원자의 이완 성질에 기초하여 조직 간에 서로 다른 대비가 발생할 수 있다.
스캐너의 자기장(B0) 내부에 있을 때 양성자의 자기 모멘트는 자기장 방향과 평행하거나 반병행으로 정렬한다. 각각의 양성자는 두 개의 선형 중 하나만 가질 수 있지만, 양성자의 집합은 마치 어떤 선형도 가질 수 있는 것처럼 동작하는 것처럼 보인다. 대부분의 양성자들은 이것이 낮은 에너지 상태이기 때문에 B와0 평행하게 정렬한다. 그런 다음 무선 주파수 펄스를 적용하여 양자를 병렬에서 반병렬 정렬까지 흥분시킬 수 있으며, 후자만 나머지 논의와 관련이 있다. 그들을 평형 방향으로 되돌리는 힘에 반응하여, 양자는 중력의 영향으로 회전하는 운동(정진)을 하게 되는데, 이것은 마치 회전하는 바퀴와 같다. 양자는 스핀-래티스 이완 과정에 의해 낮은 에너지 상태로 되돌아갈 것이다. 이것은 신호를 주기 위해 수신기 코일의 전압 변화를 생성하는 자속으로서 나타난다. 복셀에서 양성자 또는 양성자 그룹이 공명하는 빈도는 양성자 또는 양성자 그룹 주위의 국소 자기장의 강도에 따라 달라지며, 더 강한 장은 더 큰 에너지 차이와 더 높은 주파수 광자에 해당한다. 공간에 걸쳐 선형적으로 변화하는 추가 자기장(경도)을 적용하여 이미징할 특정 슬라이스를 선택할 수 있으며, 신호(k-space)의 공간 주파수의 2-D 푸리에 변환을 취함으로써 이미지를 얻을 수 있다. 경사로 코일에 흐르는 전류에 대한 B로부터의0 자기 로렌츠 힘 때문에 경사로 코일은 환자들이 청력 보호가 필요한 큰 노킹 소리를 발생시키기 위해 움직이려고 할 것이다.
역사
MRI 스캐너는 Raymond Andrew FRS FRSE 교수가 핵자기공명에 대한 연구를 통해 1975년부터 1977년까지 노팅엄 대학에서 개발했다. 전신 스캐너는 1978년에 만들어졌다.[1]
핵자기
아원자 입자는 스핀의 양자역학적 특성을 가지고 있다.[2] H(양자), H, H, H, Na 또는 P와 같은 특정 핵은 0이 아닌 스핀을 가지며 따라서 자기 모멘트를 가진다. H와 같이 이른바 스핀 ½ 핵의 경우에는 두 개의 스핀 상태가 있으며, 때로는 위아래로 언급되기도 한다. C와 같은 핵은 중성자나 양성자가 없으며 순 스핀도 없다. 그러나 동위원소 C는 그렇게 한다.
이러한 회전은 강한 외부 자기장에 놓이면 자기장 방향을 따라 축을 중심으로 전처리된다. 양성자는 두 개의 에너지 고유 물질(Zeeman 효과: 저 에너지와 고 에너지)에 정렬되며, 매우 작은 분할 에너지로 분리된다.
공명과 이완
양자역학은 단일 양성자의 행동을 정확하게 모형화하는데 필요하다. 그러나 고전 역학은 양자의 앙상블의 행동을 적절히 묘사하는 데 사용될 수 있다. 다른 스핀 / 1 입자와 마찬가지로 단일 양성자의 스핀을 측정할 때마다 일반적으로 병렬 및 반병렬이라고 하는 두 가지 결과 중 하나만 가질 수 있다. 양성자 또는 양성자의 상태에 대해 논의할 때 우리는 병렬과 반병렬 상태의 선형 결합인 양성자의 파동 함수를 언급하고 있다.[3]
자기장 B가0 존재하는 곳에서 양자는 입자의 자이로 자기 비율과 자기장의 강도에 의해 결정되는 라르모 주파수에서 전처리되는 것으로 나타날 것이다. MRI에서 가장 일반적으로 사용되는 정전기장은 무선주파수(RF) 광자에 해당하는 전처리 현상을 일으킨다.
열역학적 평형에서 순종방향 자기화는 낮은 에너지 상태에서 양성자가 약간 초과하기 때문이다. 이것은 외부와 평행한 순 양극화를 준다. RF 펄스를 적용하면 이 순 편광 벡터를 옆으로 기울이거나(즉, 소위 90° 펄스로), 또는 심지어 반대로( 소위 180° 펄스로) 할 수 있다. 양자는 RF 펄스와 함께 위상이 되며, 따라서 서로 상극이 된다.
종방향 자석의 회수는 종방향 또는1 T 이완이라고 하며 시간 상수1 T와 함께 기하급수적으로 발생한다. 횡단면에서 위상 일관성의 상실을 가로 또는 T 이완이라고2 한다. 따라서1 T는 스핀 시스템의 엔탈피 또는 병렬 대 반병렬 스핀을 갖는 핵의 수와 연관된다. 반면에 T는2 계통의 엔트로피 또는 위상의 핵의 수와 관련된다.
무선 주파수 펄스가 꺼지면 횡방향 벡터 구성 요소는 진동 자기장을 생성하여 수신기 코일에 작은 전류를 유도한다. 이 신호를 자유 유도 붕괴(FID)라고 한다. 이상화된 핵자기 공명 실험에서 FID는 시간 상수 T로2 대략 기하급수적으로 분해한다. 그러나 실제 MRI에서는 서로 다른 공간 위치의 정적 자기장("동종")에 작은 차이가 있어 라모어 주파수가 신체에 걸쳐 달라지게 된다. 이것은 파괴적인 간섭을 발생시켜 FID를 단축시킨다. FID의 관찰된 붕괴에 대한 시간 상수를 T 이완*
2 시간이라고 하며, 항상 T보다2 짧다. 동시에 종방향 자기화는 T보다2 훨씬 큰 시간 상수 T로1 기하급수적으로 회복되기 시작한다(아래 참조).
MRI에서 정적 자기장은 자기장 그라데이션 코일에 의해 증가되어 스캔한 부위에 따라 달라지기 때문에 서로 다른 공간 위치가 서로 다른 전처리 주파수와 연관되게 된다. 전처리 주파수와 RF 주파수가 일치하는 필드가 있는 지역만 흥분된다. 일반적으로 이러한 필드 그라데이션은 스캔할 영역을 스위프하도록 변조되며, MRI의 다용성을 제공하는 것은 거의 무한대의 RF 및 그라데이션 펄스 시퀀스다. 필드 그라데이션 변경은 주파수 영역에서 응답 FID 신호를 확산시키지만, 이는 재점화 그라데이션(일명 "그라디스트 에코") 또는 무선 주파수 펄스(일명 "스핀-에코") 또는 확산 신호의 디지털 후처리 시에 복구 및 측정할 수 있다. T-완화가1 어느 정도 발생하여 스핀의 열 평형이 어느 정도 회복되었을 때 전체 과정을 반복할 수 있다. 반복 시간(TR)은 동일한 슬라이스의 연속적인 두 개의 절편 사이의 시간이다.[4]
일반적으로 연조직에서 T는1 약 1초인 반면 T와2 T는*
2 몇 십 밀리초다. 그러나 이러한 값은 외부 자기장뿐만 아니라 조직마다 크게 다를 수 있다. 이러한 행동은 MRI에 엄청난 연조직 대비를 주는 한 요인이다.
가돌리늄(III)을 함유한 MRI 조영제 등 이완 파라미터를 변경(단축)하는 작용, 특히 T1.
이미징
영상 구성표
필드 그라데이션과 무선 주파수 소출을 결합하여 이미지를 생성하기 위해 다음과 같은 여러 가지 방법이 고안되었다.
이러한 각 계획은 때때로 전문가용 애플리케이션에서 사용되지만, 오늘날 MR 이미지의 대부분은 슬라이스를 선택하는 2차원 푸리에 변환(2DFT) 기법 또는 3차원 푸리에 변환(3DFT) 기법에 의해 생성된다. 2DFT의 또 다른 이름은 스핀워프다. 다음에 이어지는 내용은 슬라이스 선택 기능이 있는 2DFT 기법에 대한 설명이다.
3DFT 기법은 슬라이스 선택이 없고 위상 인코딩이 두 개의 별도 방향으로 수행된다는 점을 제외하면 다소 유사하다.
에코 평면 이미징
특히 뇌 스캐닝이나 이미지가 매우 빠르게 필요한 곳에 사용되는 또 다른 방법을 EPI라고 한다.[5] 이 경우, 각각의 RF 흥분은 서로 다른 공간 인코딩을 가진 구배 메아리의 열차가 뒤따른다. 멀티플렉스-EPI는 전 뇌 기능 MRI(fMRI)나 확산 MRI와 같이 훨씬 빠르다.[6]
영상 대비 및 조영 증강
영상 대비는 샘플 내의 서로 다른 위치에서 복구된 NMR 신호의 강도 차이로 생성된다. 이는 흥분된 핵(보통 물 양성자)의 상대적 밀도, 펄스 시퀀스 이후 그러한 핵의 이완 시간 차이(T1, T, T2*
2) 및 특수 MR 스캔에서 논의된 다른 파라미터에 따라 달라진다. 대부분의 MR 영상의 대비는 사실 이러한 모든 효과가 혼합되어 있지만 영상 펄스 시퀀스의 신중한 설계를 통해 하나의 대비 메커니즘을 강조할 수 있고 다른 것들은 최소화 할 수 있다. 다른 조영 메커니즘을 선택하는 능력은 MRI에게 엄청난 유연성을 준다. 뇌에서 T-가중치1(T-weighting)는 백색의 신경 연결부가 하얗게 나타나게 하고 회백질의 뉴런 집합체가 회색으로 보이는 반면 뇌척수액(CSF)은 어둡게 나타난다. 백질, 회백질, 뇌척수액의 대비는 T 또는2 T 영상촬영을*
2 사용하여 역전되는 반면 양성자 밀도 가중치 영상은 건강한 피험자에게 거의 대비를 제공하지 않는다. 또한 뇌혈류(CBF), 뇌혈량(CBV) 또는 혈액산소화와 같은 기능 파라미터는 T1, T2, T에*
2 영향을 미칠 수 있으므로 적절한 펄스 시퀀스로 인코딩할 수 있다.
일부 상황에서는 영상 파라미터만 조정하여 관심 해부학 또는 병리학을 적절하게 보여줄 수 있는 충분한 영상 대비를 생성할 수 없으며, 이 경우 조영제를 투여할 수 있다. 이것은 위와 소장을 영상화하는 데 있어서, 구강으로 복용하는 물처럼 간단할 수 있다. 그러나 MRI에 사용되는 대부분의 조영제는 특정 자기 성질을 위해 선택된다. 가장 일반적으로, 파라마그네틱 조영제(대개 가돌리늄[7][8] 화합물)가 주어진다. 가돌리늄 강화 조직과 액체는 T-가중1 이미지에서 매우 밝게 나타난다. 이는 혈관 조직(예: 종양)의 검출에 높은 민감도를 제공하며 뇌관류(예: 뇌졸중)의 평가를 허용한다. 최근 가돌리늄 기반 조영제의 독성 및 신장 기능이 손상된 사람에게 미치는 영향에 대한 우려가 제기되었다. (아래 안전/조영제 참조)
최근에는 산화철 나노입자와 같은 초파라믹 콘트라스트제를 사용할 수 있게 되었다.[9][10] 이러한 작용제는 T-가중*
2 영상에 매우 어둡게 나타나며, 정상적인 간 조직이 그 작용제를 유지하므로 간 영상촬영에 사용될 수 있지만, 비정상적인 부위(예: 흉터, 종양)는 그렇지 않다. 구강으로도 복용할 수 있으며, 위장의 시각화를 개선하고, 위장의 물이 다른 기관(예: 췌장)을 가리는 것을 예방하기 위해 복용할 수 있다. 황산바륨과 같은 직경자성 물질도 위장관에 잠재적으로 사용될 수 있도록 연구되어 왔으나, 자주 사용되지 않는다.
k-space
1983년, Ljunggren과[11] Twieg는[12] 독립적으로 k-space 형식주의를 도입하였는데, 이는 서로 다른 MR 영상 기법을 통일하는 데 있어 매우 귀중한 것으로 입증된 기술이다. 그들은 선형 자기장 구배 G와 수신기-코일이 존재하는 상태에서 자유롭게 핵 스핀을 처리하는 앙상블 사이의 상호작용에 의해 생성되는 변위 MR 신호 S(t)가 효과적인 스핀 밀도의 푸리에 변환과 같다는 것을 보여주었다. 기본적으로 이 신호는 패러데이의 유도 법칙에서 파생된다.
여기서:
즉, 시간이 경과함에 따라 신호는 적용된 자기장 구배 벡터에 비례하는 궤적의 속도 벡터로 k-공간에서 궤적을 추적한다. 유효 스핀 밀도라는 용어로, 우리는 RF의 신호를 유도하기 위해 사용할 수 있는 가로 자기화 양에 영향을 미치는 다른 현상에 대해1 T 준비, T2 붕괴, T 붕괴, 탈착, 유량, 확산 등의 영향에 대해 보정된 진정한 스핀 밀도(→을 의미한다. 수신 코일의 전자기장과 관련된 프로브 또는 그 위상.
기본 k-공간 공식에서, 샘플링된 데이터의 역 푸리에 변환인 viz를 취함으로써 I→){\를 재구성하는 것이 바로 뒤따른다.
k-공간 형식주의를 사용하면서, 겉으로 보기에는 복잡해 보이는 여러 가지 생각이 단순해졌다. 예를 들어, 위상 부호화(일명 스핀워프법)의 역할을 이해하는 것은 매우 쉬워진다(특히 물리학자들에게는). 판독(또는 보기) 구배가 일정한 표준 스핀 에코 또는 그라데이션 에코 스캔(예: G)에서는 RF 노출당 k-공간 한 줄이 스캔된다. 위상 인코딩 그라데이션이 0이면 스캔한 선이 k축이다x. RF 흥분과 판독 구배 시작 사이에 0이 아닌 위상 인코딩 펄스가 추가되면 이 라인은 k-공간에서 위아래로 이동하며, 즉, ky = 상수를 스캔한다.
k-공간 형식주의는 또한 다른 스캐닝 기법을 비교하는 것을 매우 쉽게 만든다. 싱글샷 EPI에서는 모든 k-space가 사인파 또는 지그재그 궤적을 따라 한 번의 샷으로 스캔된다. k-space의 교대선은 반대 방향으로 스캔되므로 재구성에 고려해야 한다. 멀티샷 EPI와 빠른 스핀 에코 기법은 흥분당 k-space의 일부만 획득한다. 각 샷에서 서로 다른 인터리브 세그먼트를 획득하고, k-스페이스가 충분히 잘 가려질 때까지 샷을 반복한다. k-공간 중심에 있는 데이터는 k-공간 가장자리에 있는 데이터보다 낮은 공간 주파수를 나타내기 때문에 k-공간 중심에 대한 TE 값은 이미지의 T 대비를2 결정한다.
영상 대비를 결정하는 데 있어 k-space 중심부의 중요성은 보다 진보된 영상 기법에 활용될 수 있다. 그러한 기법 중 하나는 나선형 획득이다. 즉 회전 자기장 구배가 적용되어 k-space의 궤적이 중심에서 가장자리로 나선형으로 나오게 한다. T와2 T의*
2 붕괴로 인해 신호는 획득 시작 시 가장 크므로, 특히 빠른 이동 시 기존의 지그재그 획득과 비교할 때 먼저 k-space의 중심을 획득하면 소음비(CNR) 대비가 개선된다.
→ → 은(는) 결합 변수(푸리에 변환에 관한)이므로, 니퀴스트 정리를 사용하여 k-space의 한 단계가 이미지의 시야(정확하게 샘플링되는 최대 주파수)와 k-sampled의 최대값을 결정한다는 것을 보여줄 수 있다.결의안을 무효화한다. 즉,
(이러한 관계는 각 축에 독립적으로 적용된다.)
펄스 시퀀스 예제
타이밍 다이어그램에서 수평축은 시간을 나타낸다. 수직 축은 무선 주파수 펄스의 (상단 열) 진폭, (중간 열) 3개의 직교 자기장 구배 펄스의 진폭, (하단 열) 수신기 아날로그-디지털 변환기(ADC)를 나타낸다. 무선 주파수는 이미징될 핵종의 Larmor 주파수에서 전송된다. 예를 들어 1T의 자기장에서 H의 경우 42.5781MHz의 주파수가 사용된다. 세 개의 필드 그라데이션은 GX(일반적으로 환자의 왼쪽에서 오른쪽 방향으로, 다이어그램에서 빨간색으로 표시됨), GY(일반적으로 환자의 앞뒤 방향으로, 다이어그램에서 녹색으로 표시됨), GZ(일반적으로 환자의 머리에서 머리에서 발끝 방향으로, 도표에서는 파란색으로 표시됨)로 표시된다. 음으로 진행되는 구배 펄스가 표시되는 경우, 오른쪽에서 왼쪽으로, 앞뒤로 또는 발가락에서 머리까지 구배 방향의 반전을 나타낸다. 인체 스캐닝의 경우 1–100 mT/m의 그라데이션 강도가 사용된다. 그라데이션 강도가 높을수록 해상도가 향상되고 영상촬영 속도가 빨라진다. 여기에 표시된 펄스 시퀀스는 가로(축) 영상을 생성할 것이다.
펄스 시퀀스의 첫 번째 부분인 SS는 "슬라이스 선택"을 달성한다. 형상의 펄스(여기서 sinc 변조 표시)는 슬래브 또는 슬라이스 내에서 종방향 핵자기화 90°의 너트를 유발하여 횡방향 자성을 생성한다. 펄스 시퀀스의 두 번째 부분인 PE는 절편 선택 핵 자기화에 대한 위상 변화를 제공하며, Y 방향의 위치에 따라 변화한다. 펄스 시퀀스의 세 번째 부분인 또 다른 슬라이스 선택(동일한 슬라이스)은 다른 형태의 펄스를 사용하여 슬라이스 내에서 횡방향 핵자기화 180° 회전을 유발한다. 이 횡방향 자기화는 한 번에 T에서E 스핀 에코를 형성하기 위해 다시 집중한다. 스핀 에코 중에는 주파수 인코딩(FE)이나 판독 구배(readout gradient)가 적용되어 핵자석의 공명 주파수는 X방향에 있는 위치에 따라 달라진다. 신호는 수직선으로 나타낸 대로 이 기간 동안 ADC에 의해 n번FE 샘플링된다. 일반적으로 128개에서 512개 사이의 샘플 중 n개를FE 채취한다.
그러면 종방향 자기화는 어느 정도 회복될 수 있고 시간 T가R 지나면 전체 시퀀스를 n번 반복하지만PE 위상-인코딩 구배가 증가(녹색 그라데이션 블록의 수평 부화에 의해 나타남)한다. 일반적으로 128과 512회 사이의 n이PE 반복된다.
시간E T(회전 에코 최대값)에서 위상이 Y 방향으로 공간 위치만 인코딩하도록 G와X G의Z 음진 로브를 가한다.
일반적으로 T는E 5ms ~ 100ms 사이인 반면 T는R 100ms ~ 2000ms 사이인 경우
2차원 매트릭스(일반적으로 128 × 128과 512 × 512 × 512 사이의 치수)를 획득하여 이른바 k-space 데이터를 생산한 후, 친숙한 MR 이미지를 제공하기 위해 2차원 역 푸리에 변환을 실시한다. 푸리에 변환의 규모나 단계를 취할 수 있는데, 전자가 훨씬 더 흔하다.
주 시퀀스 개요
이 표에는 흔하지 않은 실험 시퀀스가 포함되어 있지 않다.
| 그룹 | 순서 | 압브르. | 물리학 | 주요 임상적 특성 | 예 |
|---|---|---|---|---|---|
| 스핀 에코 | T1 가중치 | T1 | 짧은 반복 시간(TR) 및 에코 시간(TE)을 사용하여 스핀-대기 이완 측정. |
기타 시퀀스에 대한 표준 기반 및 비교 |  |
| T2 가중치 | T2 | 긴 TR 및 TE 시간을 사용하여 스핀-스핀 이완 측정 |
기타 시퀀스에 대한 표준 기반 및 비교 |  | |
| 양성자 밀도 가중치 | PD | 긴 TR(T1을 줄이기 위해) 및 짧은 TE(T2를 최소화하기 위해)[16] | 관절 질환과 부상.[17] | 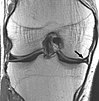 | |
| 그라데이션 에코(GRE) | 정상 상태 자유 처리 | SSFP | 연속적인 사이클에 걸쳐 안정적이고 잔류적인 가로 자석화 유지.[19] | 심장 MRI 영상 생성(사진)[19] |  |
| 유효 T2 또는 "T2-star" | T2* | 메아리 시간이 길고 플립 각도가[20] 작은 상한 그라데이션 리콜 에코(GRE) | 헤모시딘 퇴적물(사진)[20] 및 출혈의 낮은 신호 |  | |
| 민감도 가중치 | SWI | 손상된 그라데이션 호출 에코(GRE), 완전 흐름 보정, 긴 에코 시간, 위상 영상과 크기 영상을[21] 결합 | 소량의 출혈(Diffuse Axonal inclusion)[21] 또는 칼슘 검출. | 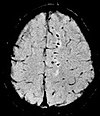 | |
| 반전 복구 | 짧은 타우 반전 복구 | 스루 | 지방의 신호가 0인 반전 시간을 설정하여 지방을 억제한다.[22] | 부종에서 높은 신호,[23] 예를 들어 더 심한 스트레스 골절에서. 신 씨는 다음과 같이 부목을 그었다. | 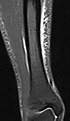 |
| 유체 감쇠 역회전 복구 | 플레어 | 유체를 무효로 하는 반전 시간을 설정하여 유체 억제 | 열상경색, 다발성 경화증(MS) 플라크, 아발성 출혈 및 뇌막염(사진)[24]의 높은 신호. | 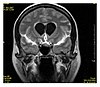 | |
| 이중 반전 복구 | DIR | 뇌척수액과 백질을 두 번 뒤집어서 동시에 억제한다.[25] | 다중 경화 플라크의 높은 신호(사진)[25] | 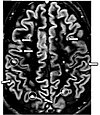 | |
| 확산 가중치(DWI) | 재래식 | DWI | 물 분자의 브라운 운동 측정.[26] | 뇌경색(사진)[27] 발생 후 몇 분 내에 높은 신호 발생 |  |
| 외관확산계수 | ADC | DWI 가중치가 다른 기존의 여러 DWI 영상을 촬영하여 T2 가중치를 감소시켰으며, 그 변화는 확산에 해당한다.[28] | 뇌경색(사진)[29] 후 낮은 신호 분. |  | |
| 확산 텐서 | DTI | 주로 신경섬유의 방향으로 물 분자를 전체적으로 더 크게 움직이는 브라운관에 의한 트랙토그래피(사진)이다.[30] |
| 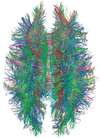 | |
| 관류 가중치(PWI) | 동적 민감도 대비 | DSC | 가돌리늄 조영제 주입으로 인한 민감성 유발 신호 손실 시 시간 경과에 따른 변화를 측정한다.[32] |  | |
| 동맥 스핀 라벨 표시 | Asl. | 영상 슬래브 아래 동맥혈의 자기 라벨링으로, 이후 관심 영역으로 들어간다.[34] 그것은 가돌리늄 대비를 필요로 하지 않는다.[35] | |||
| 동적 대비가 향상 | DCE | 가돌리늄 대조도 볼루스에 의해 유도된 회전-격자 이완(T1)의 단축에서 시간 경과에 따른 변화를 측정한다.[36] | 고속 GD 대비 흡수 속도는 다른 특징과 함께 악성(malignancy)을 암시한다(사진).[37] |  | |
| 기능성 MRI(functional MRI) | 혈액-산소 레벨 종속 영상화 | 굵게 | 헤모글로빈의 산소 포화도에 의존하는 자성의 변화는 조직 활동을 반영한다.[38] | 수술 전에 할당된 작업(예: 말하는 것, 움직이는 손가락)을 수행하는 것으로부터 뇌 활동을 국소화하는 것도 인지 연구에 사용된다.[39] | 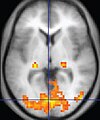 |
| 자기 공명 혈관 조영(MRA) 및 정맥 | 비행시간 | 토프 | 이미징 영역으로 들어가는 혈액은 아직 자성 포화 상태가 아니어서 짧은 에코 시간과 흐름 보정을 사용할 때 훨씬 높은 신호를 준다. | 동맥류, 협착 또는 해부의[40] 감지 |  |
| 위상 대비 자기 공명 영상화 | PC-MRA | 스핀의 속도에 비례하는 위상 변화를 인코딩하기 위해 크기는 동일하지만 방향은 반대인 두 개의 그라데이션이 사용된다.[41] | 동맥류, 협착 또는 해부(사진)의 검출.[40] | 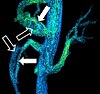 (VIPR) |
MRI 스캐너
시공 및 운영
MRI 스캐너의 주요 구성 요소는 시료를 양극화하는 주자석, 주자기장의 불균형성 교정을 위한 심코일, MR 신호의 국소화에 사용되는 그라데이션 시스템과 RF 시스템이 시료를 흥분시키고 결과 NMR 신호를 검출하는 것이다. 전체 시스템은 하나 이상의 컴퓨터에 의해 제어된다.
자석
자석은 스캐너에서 가장 크고 가장 비싼 부품이며, 스캐너의 나머지 부분은 스캐너 주위에 만들어진다. 자석의 강도는 테슬라(T)로 측정한다. 임상 자석은 일반적으로 0.1–3.0 T 범위에서 자기장 강도를 가지며, 연구 시스템은 인간 사용을 위해 최대 9.4 T, 동물 시스템을 위해 최대 21 T까지 사용할 수 있다.[42] 미국에서는 최대 4 T의 현장 강도가 FDA의 임상 사용을 승인받았다.[43]
주 자석의 강도만큼이나 중요한 것은 그 정밀도다. 자석의 중심(또는 기술적으로 알려진 바와 같이, ISO-중앙) 내 자선의 직선성은 거의 완벽해야 한다. 이것은 동질성으로 알려져 있다. 스캔 영역 내의 변동(전계 강도의 불균형)은 100만분의 3(3ppm) 미만이어야 한다. 세 가지 유형의 자석이 사용됨:
- 영구 자석: 강자성 물질로 만든 재래식 자석(예: 네오디뮴과 같은 희토류 원소를 함유한 강철 합금)을 사용하여 정적 자기장을 제공할 수 있다. MRI에 사용될 수 있을 만큼 강력한 영구 자석은 매우 크고 부피가 클 것이다. 그들은 100톤 이상의 무게가 나갈 수 있다. 영구자석 MRI는 유지 비용이 매우 저렴하다. 이것은 다른 종류의 MRI 자석에 대해서는 말할 수 없지만 영구 자석을 사용하는 데는 상당한 단점이 있다. 다른 MRI 자석(보통 0.4T 미만)에 비해 약한 자기장 강도를 얻을 수 있을 뿐 정밀도와 안정성이 제한적이다. 영구 자석은 또한 특별한 안전 문제를 야기한다; 그들의 자기장을 "꺼뜨릴" 수 없기 때문에, 강자성 물체는 일단 직접 접촉하면 그것들로부터 제거하기가 사실상 불가능하다. 영구 자석은 또한 설치 장소에 가져올 때 각별한 주의가 필요하다.
- 저항성 전자석: 구리선에서 감긴 솔레노이드는 영구 자석의 대안이다. 장점은 초기 비용이 낮다는 것이지만, 현장 강도와 안정성은 제한적이다. 전자석은 작동 중에 상당한 전기 에너지를 필요로 하므로 작동 비용이 많이 들 수 있다. 이 디자인은 본질적으로 구식이다.
- 초전도 전자석: 니오비움-티타늄 또는 니오비움-틴 합금이 액체 헬륨에 의해 4K(-269°C, -452°F)로 냉각되면 초전도체가 되어 전류 흐름에 대한 저항을 상실한다. 초전도체로 구성된 전자석은 매우 높은 안정성과 함께 매우 높은 전기장 강도를 가질 수 있다. 그러한 자석의 건설은 비용이 엄청나게 많이 들고 극저온 헬륨은 비용이 많이 들고 다루기 어렵다. 하지만, 이러한 비용에도 불구하고, 헬륨 냉각 초전도 자석은 오늘날 MRI 스캐너에서 발견되는 가장 흔한 유형이다.
대부분의 초전도 자석은 극저온이라고 불리는 선박 안에 액체 헬륨에 담근 초전도 와이어의 코일을 가지고 있다. 때로는 액체 질소가 함유된 두 번째 냉동고를 포함한 열 절연에도 불구하고, 주변 열은 헬륨을 서서히 끓어오르게 한다. 따라서 이러한 자석은 액체 헬륨을 정기적으로 보충해야 한다. 일반적으로 콜드헤드라고도 알려진 극저온 냉각기는 일부 헬륨 증기를 액체 헬륨 욕조에 다시 담기 위해 사용된다. 현재 몇몇 제조업체는 '무결정' 스캐너를 제공하고 있는데, 이 스캐너는 액체 헬륨에 담그는 대신 극저온 냉각기에 의해 자석 와이어가 직접 냉각된다.[44] 또는 액체 헬륨을 전략 지점에 조심스럽게 배치하여 자석을 냉각시켜 액체 헬륨 사용량을 획기적으로 줄이거나 [45]고온 초전도체를 대신 사용할 수 있다.[46][47]
자석은 다양한 모양으로 이용할 수 있다. 그러나 영구 자석은 가장 자주 'C'자석이고, 초전도 자석은 가장 자주 원통형이다. C형 초전도 자석과 박스형 영구 자석도 사용됐다.
자기장 강도는 영상 화질을 결정하는 중요한 요인이다. 자기장이 높을수록 신호 대 잡음 비율이 높아져 분해능이 높아지거나 스캔 속도가 빨라진다. 그러나 전계 강도가 높을수록 유지관리 비용이 더 많이 드는 자석이 필요하며 안전성에 대한 우려가 커졌다. 현장 강도는 1.0–1.5T로 일반 의료용 비용과 성능 사이의 좋은 절충이다. 그러나 일부 병원은 현재 3.0 T 스캐너를 사용하고 있으므로, 특정 전문의 사용(예: 뇌 영상촬영)의 경우 보다 높은 현장 강도가 바람직하다.
심스
MR 스캐너를 병원이나 클리닉에 배치할 때, MR 스캐너의 주 자기장은 스캔에 사용될 수 있을 만큼 동질적이지 않다. 그렇기 때문에 샘플을 이용해 전장을 미세하게 튜닝하기 전에 자석의 자기장을 측정하여 심을 쳐야 한다.
샘플을 스캐너에 넣은 후, 주 자기장이 그 샘플 내의 민감도 경계로 왜곡되어 신호 드롭아웃(신호가 없는 영역)과 획득한 영상의 공간 왜곡을 일으킨다. 예를 들어, 인간이나 동물의 경우, 뇌의 전두엽을 상상하기 어렵게 만드는 (공기의 파라마그네틱 산소 때문에) 시누스와 같은 공기 이슈 경계에서 그 효과가 특히 두드러진다. 필드 동질성을 복원하기 위해 심 코일 세트가 스캐너에 포함되어 있다. 이것들은 보통 실온에서 구면 고조파들의 여러 순서로 분포된 필드 보정을 생성할 수 있는 저항성 코일이다.[48]
샘플을 스캐너에 넣은 후 심 코일의 전류를 조절하여 B 필드를0 '흔들림'한다. 필드 동질성은 필드 그라데이션이 없는 경우 FID 신호를 검사하여 측정한다. 잘 닦이지 않은 표본의 FID는 종종 많은 혹이 있는 복잡한 부패 봉투를 보여줄 것이다. 그런 다음 심 전류를 조정하여 균일한 B장을0 나타내는 큰 진폭 붕괴 FID를 생성한다. 그 과정은 보통 자동화된다.[49]
그라데이션
그라데이션 코일은 영상 볼륨에 걸쳐 자기장을 선형적으로 변화시켜 양자의 위치를 공간적으로 인코딩하는 데 사용된다. 그런 다음 Larmor 주파수는 x, y, z-ax에서 위치 함수로 변화한다.
그라데이션 코일은 대개 자기장 강도와 방향을 빠르고 정확하게 조정할 수 있는 정교한 증폭기에 의해 구동되는 저항성 전자석이다. 일반적인 그라데이션 시스템은 20 ~ 100 mT/m의 그라데이션(즉, 1.5 T 자석에서는 최대 z축 그라데이션이 적용될 때 1 m 길이의 보어 한쪽 끝에는 1.45 T, 다른[50] 쪽에는 1.55 T가 될 수 있다.)을 생성할 수 있다. 직교 그라데이션은 자유롭게 결합할 수 있기 때문에 어떤 평면도 영상화를 위해 선택할 수 있다.
스캔 속도는 그라데이션 시스템의 성능에 따라 달라진다. 더 강한 그라데이션은 더 빠른 이미징 또는 더 높은 해상도를 허용한다. 마찬가지로, 더 빠른 전환이 가능한 그라데이션 시스템도 더 빠른 스캔을 허용할 수 있다. 그러나 구배 성능은 신경 자극에 대한 안전 우려로 제한된다.
구배 증폭기와 구배 코일의 중요한 특징으로는 슬루 레이트와 구배 강도가 있다. 앞에서 언급한 바와 같이, 그라데이션 코일은 주 자기장으로부터 추가 또는 빼는 선형적으로 변화하는 추가 자기장을 생성한다. 이 추가 자기장은 viz. x, y 및 z의 3방향으로 구성 요소를 가지지만 자기장을 따라 있는 구성 요소(일반적으로 z축이라고 하며, 따라서 G로z 표시됨)만 영상촬영에 유용하다. 주어진 축을 따라 구배는 영점 위치의 한 쪽에 있는 자기장에 더해지고 다른 쪽에 있는 자기장에서 빼게 된다. 추가 장은 경사도가므로 센티미터 당 가우스 또는 미터당 밀리테라(mT/m) 단위를 가진다. MRI에 사용되는 고성능 그라데이션 코일은 일반적으로 1.5 T MRI에 대해 약 30 mT/m 이상의 그라데이션 자기장을 생성할 수 있다. 그라데이션 시스템의 슬루 레이트는 그라데이션이 얼마나 빨리 켜지거나 꺼질 수 있는지를 나타내는 척도다. 일반적으로 고성능 구배는 최대 100–200 T·m−1·s의−1 슬루 레이트를 가진다. 슬루 레이트는 그라데이션 코일(작은 코일보다 큰 코일을 높이거나 내리는데 더 많은 시간이 소요됨)과 그라데이션 앰프의 성능(코일의 인덕턴스를 극복하는 데 많은 전압이 소요됨)에 따라 달라지며 이미지 품질에 상당한 영향을 미친다.
무선주파수계통
무선 주파수(RF) 전송 시스템은 RF 신디사이저, 파워앰프, 송신 코일로 구성된다. 그 코일은 보통 스캐너 몸체에 내장되어 있다. 송신기의 동력은 가변적이지만, 하이엔드 전신 스캐너는 최대 35 kW의 피크 출력 전력을 가질 수 있으며,[51] 평균 1 kW의 전력을 유지할 수 있다. 이러한 전자기장은 대개 아마추어 무선에서 사용하는 최고 전력을 초과하는 전력에서 수십 MHz의 RF 범위(흔히 전자기 스펙트럼의 단파 무선 부분에 있음)에 있지만, MRI 기계에 의해 발생하는 RF 간섭은 거의 없다. 그 이유는 MRI가 무선 송신기가 아니기 때문이다. "전송 코일"에서 생성되는 RF 주파수 전자기장은 전기장 구성 요소의 변경과 관련이 거의 없는 자기 근거리장이다(예: 모든 재래식 전파 송신이 그러함). 따라서 MRI 송신기 코일에서 생성되는 고출력 전자기장은 RF 주파수에서 많은 전자기 방사선을 생성하지 않으며, 전력은 코일 공간에 국한되어 '전파'로 복사되지 않는다. 따라서 송신 코일은 무선 주파수에서는 좋은 전자파장 송신기가 되지만, 무선 주파수에서는 좋지 않은 전자파 방사선 송신기가 된다.
수신기는 코일, 프리앰프, 신호 처리 시스템으로 구성된다. 피험자 내부의 핵 이완에 의해 생성되는 RF 전자기 방사선은 참 전자파 방사선(전파)이며, 피험자를 RF 방사선으로 남겨두지만, 주변의 무선 튜너가 집어 들 수 있는 상당한 RF 간섭을 일으키지 않을 정도로 전력이 낮다(게다가 MRI 스캐너는 일반적으로 금속 m에 위치한다).esh 줄지어 있는 방들은 패러데이 우리 역할을 한다.)
RF 송수신 및 MR 신호 수신을 위해 통합 코일을 사용하여 스캔하는 것은 가능하지만, 작은 영역이 이미징되는 경우 근접하게 맞는 소형 코일을 사용하여 더 나은 영상 화질(즉, 더 높은 신호 대 잡음 비율)을 얻을 수 있다. 머리, 무릎, 손목, 가슴과 같은 신체 부위 또는 내부(예: 직장)에 가깝게 맞는 다양한 코일을 사용할 수 있다.
MRI 기술의 최근 발전은 다중 데이터 채널을 병렬로 획득할 수 있는 정교한 다중 요소 단계 배열[52] 코일의 개발이었다. 이 '병렬 영상' 기법은 자기 그라데이션에서 발생하는 공간 코딩의 일부를 다른 코일 요소의 공간 민감도로 대체함으로써 가속 이미지를 허용하는 고유한 획득 방식을 사용한다. 그러나 가속도가 증가하면 신호 대 잡음 비도 감소하고 영상 재구성에서 잔여 아티팩트를 생성할 수 있다. 자주 사용되는 두 가지 병렬 획득 및 재구성 체계는 SENSE와[53] GRAPPA로 알려져 있다.[54] 병렬 영상 기법에 대한 자세한 검토는 다음에서 확인할 수 있다.[55]
참조
- ^ 2001년 7월 20일 R 에드워드 독립 부고
- ^ Callaghan P (1994). Principles of Nuclear Magnetic Resonance Microscopy. Oxford University Press. ISBN 978-0-19-853997-1.
- ^ "Quantum philosophy". Questions and Answers in MRI. Retrieved 1 June 2019.
- ^ 26페이지 인:
- ^ Poustchi-Amin M, Mirowitz SA, Brown JJ, McKinstry RC, Li T (2000). "Principles and applications of echo-planar imaging: a review for the general radiologist". Radiographics. 21 (3): 767–79. doi:10.1148/radiographics.21.3.g01ma23767. PMID 11353123.
- ^ Feinberg DA, Moeller S, Smith SM, Auerbach E, Ramanna S, Gunther M, Glasser MF, Miller KL, Ugurbil K, Yacoub E (December 2010). "Multiplexed echo planar imaging for sub-second whole brain FMRI and fast diffusion imaging". PLOS ONE. 5 (12): e15710. Bibcode:2010PLoSO...515710F. doi:10.1371/journal.pone.0015710. PMC 3004955. PMID 21187930.
- ^ Weinmann HJ, Brasch RC, Press WR, Wesbey GE (March 1984). "Characteristics of gadolinium-DTPA complex: a potential NMR contrast agent". AJR. American Journal of Roentgenology. 142 (3): 619–24. doi:10.2214/ajr.142.3.619. PMID 6607655.
- ^ Laniado M, Weinmann HJ, Schörner W, Felix R, Speck U (1984). "First use of GdDTPA/dimeglumine in man". Physiological Chemistry and Physics and Medical NMR. 16 (2): 157–65. PMID 6505042.
- ^ Widder DJ, Greif WL, Widder KJ, Edelman RR, Brady TJ (February 1987). "Magnetite albumin microspheres: a new MR contrast material". AJR. American Journal of Roentgenology. 148 (2): 399–404. doi:10.2214/ajr.148.2.399. PMID 3492120.
- ^ Weissleder R, Elizondo G, Wittenberg J, Rabito CA, Bengele HH, Josephson L (May 1990). "Ultrasmall superparamagnetic iron oxide: characterization of a new class of contrast agents for MR imaging". Radiology. 175 (2): 489–93. doi:10.1148/radiology.175.2.2326474. PMID 2326474.
- ^ Ljunggren S (1983). "A simple graphical representation of Fourier-based imaging methods". Journal of Magnetic Resonance. 54 (2): 338–343. Bibcode:1983JMagR..54..338L. doi:10.1016/0022-2364(83)90060-4.
- ^ Twieg DB (1983). "The k-trajectory formulation of the NMR imaging process with applications in analysis and synthesis of imaging methods". Medical Physics. 10 (5): 610–21. Bibcode:1983MedPh..10..610T. doi:10.1118/1.595331. PMID 6646065.
- ^ a b c d "Magnetic Resonance Imaging". University of Wisconsin. Archived from the original on 10 May 2017. Retrieved 14 March 2016.
- ^ a b c d Johnson KA. "Basic proton MR imaging. Tissue Signal Characteristics". Harvard Medical School. Archived from the original on 5 March 2016. Retrieved 14 March 2016.
- ^ "MRI Questions, Fast Spin Echo". MRIQuestions.com. Retrieved 18 May 2021.
- ^ Graham D, Cloke P, Vosper M (31 May 2011). Principles and Applications of Radiological Physics E-Book (6 ed.). Elsevier Health Sciences. p. 292. ISBN 978-0-7020-4614-8.}
- ^ du Plessis V, Jones J. "MRI sequences (overview)". Radiopaedia. Retrieved 13 January 2017.
- ^ Lefevre N, Naouri JF, Herman S, Gerometta A, Klouche S, Bohu Y (2016). "A Current Review of the Meniscus Imaging: Proposition of a Useful Tool for Its Radiologic Analysis". Radiology Research and Practice. 2016: 8329296. doi:10.1155/2016/8329296. PMC 4766355. PMID 27057352.
- ^ a b Luijkx T, Weerakkody Y. "Steady-state free precession MRI". Radiopaedia. Retrieved 13 October 2017.
- ^ a b Chavhan GB, Babyn PS, Thomas B, Shroff MM, Haacke EM (2009). "Principles, techniques, and applications of T2*-based MR imaging and its special applications". Radiographics. 29 (5): 1433–49. doi:10.1148/rg.295095034. PMC 2799958. PMID 19755604.
- ^ a b Di Muzio B, Gaillard F. "Susceptibility weighted imaging". Retrieved 15 October 2017.
- ^ Sharma R, Taghi Niknejad M. "Short tau inversion recovery". Radiopaedia. Retrieved 13 October 2017.
- ^ Berger F, de Jonge M, Smithuis R, Maas M. "Stress fractures". Radiology Assistant. Radiology Society of the Netherlands. Retrieved 13 October 2017.
- ^ Hacking C, Taghi Niknejad M, et al. "Fluid attenuation inversion recoveryg". radiopaedia.org. Retrieved 3 December 2015.
- ^ a b Di Muzio B, Abd Rabou A. "Double inversion recovery sequence". Radiopaedia. Retrieved 13 October 2017.
- ^ Lee M, Bashir U. "Diffusion weighted imaging". Radiopaedia. Retrieved 13 October 2017.
- ^ Weerakkody Y, Gaillard F. "Ischaemic stroke". Radiopaedia. Retrieved 15 October 2017.
- ^ Hammer M. "MRI Physics: Diffusion-Weighted Imaging". XRayPhysics. Retrieved 15 October 2017.
- ^ An H, Ford AL, Vo K, Powers WJ, Lee JM, Lin W (May 2011). "Signal evolution and infarction risk for apparent diffusion coefficient lesions in acute ischemic stroke are both time- and perfusion-dependent". Stroke. 42 (5): 1276–81. doi:10.1161/STROKEAHA.110.610501. PMC 3384724. PMID 21454821.
- ^ a b Smith D, Bashir U. "Diffusion tensor imaging". Radiopaedia. Retrieved 13 October 2017.
- ^ Chua TC, Wen W, Slavin MJ, Sachdev PS (February 2008). "Diffusion tensor imaging in mild cognitive impairment and Alzheimer's disease: a review". Current Opinion in Neurology. 21 (1): 83–92. doi:10.1097/WCO.0b013e3282f4594b. PMID 18180656.
- ^ Gaillard F. "Dynamic susceptibility contrast (DSC) MR perfusion". Radiopaedia. Retrieved 14 October 2017.
- ^ Chen F, Ni YC (March 2012). "Magnetic resonance diffusion-perfusion mismatch in acute ischemic stroke: An update". World Journal of Radiology. 4 (3): 63–74. doi:10.4329/wjr.v4.i3.63. PMC 3314930. PMID 22468186.
- ^ "Arterial spin labeling". University of Michigan. Retrieved 27 October 2017.
- ^ Gaillard F. "Arterial spin labelling (ASL) MR perfusion". Radiopaedia. Retrieved 15 October 2017.
- ^ Gaillard F. "Dynamic contrast enhanced (DCE) MR perfusion". Radiopaedia. Retrieved 15 October 2017.
- ^ Turnbull LW (January 2009). "Dynamic contrast-enhanced MRI in the diagnosis and management of breast cancer". NMR in Biomedicine. 22 (1): 28–39. doi:10.1002/nbm.1273. PMID 18654999.
- ^ Chou I. "Milestone 19: (1990) Functional MRI". Nature. Retrieved 9 August 2013.
- ^ Luijkx T, Gaillard F. "Functional MRI". Radiopaedia. Retrieved 16 October 2017.
- ^ a b "Magnetic Resonance Angiography (MRA)". Johns Hopkins Hospital. Retrieved 15 October 2017.
- ^ Keshavamurthy J, Ballinger R et al. "Phase contrast imaging". Radiopaedia. Retrieved 15 October 2017.
- ^ "In vivo MR Imaging at 21.1 T" (PDF).
- ^ Duggan-Jahns, Terry. "The Evolution of Magnetic Resonance Imaging: 3T MRI in Clinical Applications". eRADIMAGING.com. eRADIMAGING.com. Retrieved 24 June 2013.
- ^ Obasih KM, Mruzek (1996). "Thermal design and analysis of a cryogenless superconducting magnet for interventional MRI therapy". In Timmerhaus KD (ed.). Proceedings of the 1995 cryogenic engineering conference. New York: Plenum Press. pp. 305–312. ISBN 978-0-306-45300-7.
- ^ https://www.medgadget.com/2018/09/philips-helium-free-mri-system-combines-productivity-with-high-quality-imaging.html
- ^ https://www.nextbigfuture.com/2017/01/japan-makes-progress-toward-realization.html
- ^ https://nationalmaglab.org/magnet-development/magnet-science-technology/publications-mst/highlights-mst/bi-2223-nmr-magnets
- ^ Chen CN, Hoult DH (1989). Biomedical Magnetic Resonance Technology. Medical Sciences. Taylor & Francis. ISBN 978-0-85274-118-4.
- ^ Gruetter R (June 1993). "Automatic, localized in vivo adjustment of all first- and second-order shim coils" (PDF). Magnetic Resonance in Medicine. 29 (6): 804–11. doi:10.1002/mrm.1910290613. PMID 8350724. S2CID 41112243.
- ^ 이것은 비현실적으로 그라데이션이 자석 보어의 끝부분까지 선형이라고 가정한다. 이러한 가정은 교육학적 목적에 적합하지만, 대부분의 상용 MRI 시스템에서는 훨씬 더 작은 거리 후에 경사가 현저하게 감소한다. 실제로, 경사도 영역의 감소는 현대 상용 MRI 시스템의 유용한 시야의 주요 구분 기호다.
- ^ Oppelt A (2006). Imaging Systems for Medical Diagnostics: Fundamentals, Technical Solutions and Applications for Systems Applying Ionizing Radiation, Nuclear Magnetic Resonance and Ultrasound. Wiley-VCH. p. 566. ISBN 978-3-89578-226-8.
- ^ Roemer PB, Edelstein WA, Hayes CE, Souza SP, Mueller OM (November 1990). "The NMR phased array". Magnetic Resonance in Medicine. 16 (2): 192–225. doi:10.1002/mrm.1910160203. PMID 2266841. S2CID 9482029.
- ^ Pruessmann KP, Weiger M, Scheidegger MB, Boesiger P (November 1999). "SENSE: sensitivity encoding for fast MRI". Magnetic Resonance in Medicine. 42 (5): 952–62. CiteSeerX 10.1.1.139.3032. doi:10.1002/(SICI)1522-2594(199911)42:5<952::AID-MRM16>3.0.CO;2-S. PMID 10542355.
- ^ Griswold MA, Jakob PM, Heidemann RM, Nittka M, Jellus V, Wang J, Kiefer B, Haase A (June 2002). "Generalized autocalibrating partially parallel acquisitions (GRAPPA)". Magnetic Resonance in Medicine. 47 (6): 1202–10. CiteSeerX 10.1.1.462.3159. doi:10.1002/mrm.10171. PMID 12111967. S2CID 14724155.
- ^ Blaimer M, Breuer F, Mueller M, Heidemann RM, Griswold MA, Jakob PM (2004). "SMASH, SENSE, PILS, GRAPPA: How to Choose the Optimal Method" (PDF). Topics in Magnetic Resonance Imaging. 15 (4): 223–236. doi:10.1097/01.rmr.0000136558.09801.dd. PMID 15548953. S2CID 110429.
추가 읽기
- Pykett IL (1 May 1982). "NMR Imaging in Medicine" (PDF). Scientific American. 246 (5): 78–88. Bibcode:1982SciAm.246e..78P. doi:10.1038/scientificamerican0582-78. PMID 7079720. Archived from the original (PDF) on 10 March 2016.
- Sprawls P (2000). Magnetic Resonance Imaging: Principles, Methods, and Techniques. Medical Physics Publishing. ISBN 978-0-944838-97-6.
- Haacke EM, Brown RF, Thompson M, Venkatesan R (1999). Magnetic resonance imaging: Physical principles and sequence design. New York: J. Wiley & Sons. ISBN 978-0-471-35128-3.
- Mansfield P (1982). NMR Imaging in Biomedicine: Supplement 2 Advances in Magnetic Resonance. Elsevier. ISBN 978-0-323-15406-2.
- Fukushima E (1989). NMR in Biomedicine: The Physical Basis. Springer Science & Business Media. ISBN 978-0-88318-609-1.
- Blümich B, Kuhn W (1992). Magnetic Resonance Microscopy: Methods and Applications in Materials Science, Agriculture and Biomedicine. Wiley. ISBN 978-3-527-28403-0.
- Blümer P (1998). Blümler P, Blümich B, Botto RE, Fukushima E (eds.). Spatially Resolved Magnetic Resonance: Methods, Materials, Medicine, Biology, Rheology, Geology, Ecology, Hardware. Wiley-VCH. ISBN 978-3-527-29637-8.
- Liang Z, Lauterbur PC (1999). Principles of Magnetic Resonance Imaging: A Signal Processing Perspective. Wiley. ISBN 978-0-7803-4723-6.
- Schmitt F, Stehling MK, Turner R (1998). Echo-Planar Imaging: Theory, Technique and Application. Springer Berlin Heidelberg. ISBN 978-3-540-63194-1.
- Kuperman V (2000). Magnetic Resonance Imaging: Physical Principles and Applications. Academic Press. ISBN 978-0-08-053570-8.
- Blümich B (2000). NMR Imaging of Materials. Clarendon Press. ISBN 978-0-19-850683-6.
- Jin J (1998). Electromagnetic Analysis and Design in Magnetic Resonance Imaging. CRC Press. ISBN 978-0-8493-9693-9.

















