노르보르미드
Norbormide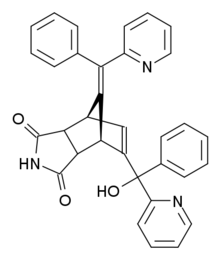 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 5-(α-Hydroxy-α-2-pyridylbenzyl)-7-(α-2-pyridylbenzylidene)-5-norborenene-2,3-dicarboximide. | |
| 체계적 IUPAC 이름 (10E)-8-[하이드록시(페닐)피리딘-2-yl메틸]-10-[페닐(피리딘-2-yl)메틸리덴]-4-아자트리시클로[5.2.12,6.0]dec-8-ene-3,5-디온 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.012.354 |
| EC 번호 |
|
| 케그 | |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C33H25N3O3 | |
| 어금질량 | 511.570 |
| 위험 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 | 독성의 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
노르보르미드(Raticate, Shoxin)는 설치류 살충제로 사용되는 독성 화합물이다. 여러 작용 메커니즘을 가지고 있어 혈관수축기와 칼슘 채널 차단제 역할을 하지만 [1]쥐에게는 선택적으로 독성이 있으며, 랫드 미토콘드리아의 투과성 전환 모공을 여는 종별 특수 작용으로 인해 다른 종에 대한 독성이 상대적으로 낮다.[2]
미국 비상계획 및 공동체 알권리법 제302조(미국법전 제42조 제11002)에 규정된 미국 내에서는 극도로 위험한 물질로 분류되며, 상당량을 생산, 저장 또는 사용하는 시설별로 엄격한 보고 요건이 적용된다.[3]
역사
1960년대 초에 노르보르미드는 항응고제 쥐의 독으로 작용하도록 개발되었다. 그러나 1970년대에는 항응고제 독소가 설치류에 더 효과적인 것 같았기 때문에 이 설치류 살충제의 이용률이 감소했다.[4] NRB는 Rattus속(R. norvegius, R. exulans, R. rattus)의 설치류만을 죽이며, 다른 설치류와 포유류에게는 적당히 순진하다.[5] 많은 사람들이 그것의 선택적 특징을 단점으로 보고 있지만, 뉴질랜드의 랜드케어 연구소의 과학자들은 이 설치류 살충제를 개선하고 몇 가지 유사점을 개발할 방법을 찾고 있다.[6][7][8]
구조 및 반응도
노르보르미드는 5-(α-hydroxy-α-2-pyridylbenzyl)-7-(α-2-pyridylbenzylidene)-5-norborenene-2,3-dicarboximide의 유기 화합물이다. 그 구조는 노보른자 고리로 이루어져 있으며, 이중 결합 반대쪽에 있는 이미드 고리와 합쳐진다. 이 이중 결합의 탄소 원자 중 하나는 히드록실, 피리딜, 페닐 그룹에 묶인 또 다른 탄소 원자와 연결되어 있다. 노르보른 링의 브리징 탄소는 피리딜과 페닐 그룹이 부착된 탄소 원자에 이중 결합된다.[9] 노르보르미드에는 8개의 가능한 스테레오이오모이드가 있다. 외생성 이중 결합에는 시스/트랜스 이등분체가 있다. 이미드 링은 엔도 또는 엑소 방향을 가질 수 있으며, 히드록실 그룹 에리스로와 threo isomer는 가능하다.[10] 노르보르미드의 혈관수축기 성질은 입체화학에 매우 의존하는 것으로 밝혀졌다. 쥐에게는 엔도 이소머만이 독성이 있고, 이소머는 에리스로 이소머보다 10배나 강력하다.[1] 시스엔도-트레오 이소머는 가장 강력한 혈관확장기 특성을 가진 이소머로 밝혀졌다.[11] 이 구조에서는 히드록실 그룹과 인접한 피리딘 링 사이에 수소 결합이 있다.[5] 연구에 따르면 노르보르미드 독성은 구조적 변화에 민감하며, 거의 모든 경우 구조적인 변화로 인해 독성이 감소한다. 오직 특정 집단과 이미드의 NH 양성자를 대체하는 것만이 노르보르미드 그 자체에 필적하는 독성 활동을 줄 수 있다.[12]
합성
NRB는 쥐와 쥐에게 미끼 부끄럼을 유발하기 때문에 종종 치사량 이하로만 섭취하기 때문에 NRB 자체보다 독성이 강한 NRB 유도체를 찾아 연구가 수행되었다. 이 경우 대체는 NRB의 이미드 그룹에서만 이루어졌다. 이러한 각 파생상품에 대한 공통구조는 그림 4.1에 나타나 있으며, 여기서 R은 변화 가능한 그룹이다.
위치 R에는 서로 다른 탄화수소 그룹이 배치되었다. 그들 중 NRB만큼 독성이 강한 사람은 아무도 없었으므로 다른 전략을 시도했다. 두 번째 연구에서 NRB의 다른 링 유사점을 살펴보았다. 이러한 다른 링 유사점들 중 NRB만큼 독성이 강한 것은 없었다.[12] 연구된 또 다른 형태의 반응은 프로드마약이다. 이러한 약물은 미끼의 수줍음을 극복하기 위해 합성되었다. 이 연구의 목적은 NRB보다 더 좋은 맛을 내는 프로드러브를 만드는 것이었고, 일단 몸에 들어가면 NRB로 대사되는 것이었다. 그림 4.2;4.3 및 4.4에서 볼 수 있는 세 가지 서로 다른 출발 구조가 사용되었다. 그림 4.5와 4.6에서 출발 구조물이 NRB로부터 어떻게 합성되었는지 보여준다. 단지 19번 화합물(그림 4.7)만이 유망했는데, 이는 증상의 시작을 늦추고 쥐가 더 입맛에 맞기 때문이다(그림 4.8 참조). 그러나 이 화합물을 사용하기 위해서는 더 많은 연구가 있어야 한다.[12]
사용 가능한 양식
서로 다른 스테레오아오머
노르보르미드 합성을 하는 동안 8개의 가능한 스테레오 중 5개의 스테레오이오머, 즉 모든 엔도 스테레오이오머와 시스 엑소 스테레오머가 상당량으로 형성된다. 노르보르미드의 효력은 대부분 트랜스엔도-트레오(LD50 = 0.50mg/kg(랫드))와 시스-엔도-트레오 이소머(LD50 = 0.15mg/kg(랫드))에 기인한다. 이 두 개의 등유체는 상업용 혼합물의 약 절반을 형성한다.[12]
파생상품
독성이 더 강한 노르보르미드의 파생 화합물을 찾는 연구가 진행되었다. 잡종 그룹의 추가나 대체는 훨씬 더 독성이 강한 화합물을 제공하는 것으로 판명된 적이 없다. 대부분의 경우, 독성이 현저히 떨어지는 화합물을 얻었다.[12] 노르보르미드를 설치류 살충제로 사용하는 문제는 미끼 수줍음인데, 이는 쥐가 조금 먹고 나면 쥐가 병에 걸려 독소를 피한다는 것을 의미하며, 또한 맛도 나쁘도록 되어 있다. 최근 연구들은 독성 물질을 천천히 방출하여 독성 효과를 지연시키는 노르보르미드의 약물을 찾고 있다. 이러한 성질을 가진 것으로 보이는 약물이 발견되었다. 사용법을 최종적으로 사용할 수 있기 전에 미세화를 위한 후속 연구가 수행되어야 한다.[1]
작용기전
혈관확장기 효과의 메커니즘은 칼슘 유입의 변조에 의해 매개될 것으로 예측된다. 이러한 칼슘의 유입은 근세포의 수축으로 이어질 수 있다. 아마도 칼슘의 유입은 랫드 말초동맥 근세포에서 인지질 C(PLC) 결합 수용체에 의해 매개될 것이다.[13][14]
세르히오 보바 외 모든 연구. 호흡기, 비뇨기 및 위장 매끄러운 근육에서는 노르보르미드에 의한 수축이 없다는 것을 보여주었다. 노르보르미드의 증상은 더 잘 알려진 Ca2+ 엔트리 차단제와 매우 유사했다. 그러므로 노르보르미드는 종에 특유할 뿐만 아니라 조직에도 특유하다.[15]
노르보르미드는 세포 내 미토콘드리아에 강한 영향을 미친다. 그러므로 노르보르미드는 외부 미토콘드리아막(OMM)을 통해 내부 미토콘드리아 공간으로 전이된다. 이 위치 또는 매트릭스에서 투과성 전환 모공(PTP)을 유도한다. 이 PTP는 내부 미토콘드리아 멤브레인(IMM) 채널로, 이 채널의 개방으로 약 1500Da의 배타 크기를 가진 이온의 투과성이 증가하게 된다.[16] 노르보리미드의 운반은 말초 벤조디아제핀 수용체라고도 알려진 번역 단백질(TSPO)에서 온다. TSPO는 랫드의 노르보르미드 운반에 선택적이다. 그림 6.1은 쥐, 마우스 및 기니피그 LPSO의 중요한 정렬을 보여준다. 아미노산에는 약간의 차이가 있지만, 113의 위치는 개, 인간, 닭과 같은 종과 다른 종 사이에 매우 유사하다. 쥐가 113 위치에 있는 경우 메티오닌(M) 다른 종은 류신 아미노산을 가지고 있다. 이것은 아마도 쥐와 다른 종들 사이의 다른 이동량에 대한 결과일 것이다.[16]
신진대사
화합물의 독성학적 특성은 다양한 종에서 종종 다른 신진대사 경로와 연관되어 있다. 그러한 이유로 독성과 신진대사의 상관관계가 관찰되어 체외 및 체내 조건 모두에서 세포대사에 대한 명확한 통찰력을 얻었다.[17][18][19]
체외 실험
쥐와 다른 설치류들의 간 조제에 대한 체외 연구 결과, 히드록실화가 NRB의 대사 과정에서 주요한 과정이라는 것이 밝혀졌다. 더욱이 쥐의 성별 사이의 대사물들은 서로에게서 벗어나는 것 같았다.[5] 무엇보다도 NRB가 간 S9 분율과 배양되었을 때, 몇 가지 신진대사 제품이 관찰되었다. S9 분수는 "적합한 매질에서 9000 g에서 20분간 원심분리하여 장기(일반적으로 간) 균질산염으로부터 얻은 초산분수"로 정의되었다. 이 분수는 시토솔과 마이크로솜을 포함한다.[20] S9 분수는 두 가지 성분, 즉 시토크롬 P450 이소형태를 통합한 마이크로솜 성분(위상 I 대사)[21]과 전이효소(위상 II 대사)를 포함하는 시토솔릭 성분으로 구성된다.[22] NRB(U, V, W en Y)의 활성 내분자 4개가 혼합되어 랫드 간 S9와 배양 후 세포질 준비에서 4개의 주요 대사물이 형성되었다. 이소머는 별도로 순수한 화합물이 아니지만 순수한 V이소머와 U와 V이소머의 혼합물을 이용한 연구는 각각의 이소머가 랫드에서 하나의 제품으로 형성되기 위해 신진대사를 거치게 된다고 지적했다. 질량분석 결과 모든 대사물이 NRB의 히드록시화 대사물과 일치하는 질량을 가지고 있음을 확인했다. 암컷 쥐는 수컷 쥐보다 NRB에 더 민감하기 때문에 대사물의 수준은 수컷 쥐보다 암컷이 더 높다.[5] 같은 대사물이 기니피그에서 발견되었지만, 이러한 설치류들의 신진대사 수준은 쥐에 비해 상당히 낮다. 생쥐에서 두 개의 대사물이 검출되었다. 즉, 랫드 준비물에서도 발견된 V 이소머의 대사물(V1)과 V 이소머의 새로운 대사물(V2)이다. (그림 7.1) 이 데이터는 NRB에 대한 민감성과 다른 유형의 대사물 및 다른 수준의 대사물 생산 사이의 연관성을 인정한다.
생체내 실험
경구 투여 후 10분, 30분 후 쥐로부터 혈액을 채취한 후 모화합물이나 히드록시화 대사물을 찾아 혈장과 적혈구 분수를 분석하였다. 그러나 둘 다 발견되지 않았으며, 이는 흡수가 이루어지지 않았거나 화합물이 몸에서 빠른 간격을 거쳤다는 것을 의미한다. 전혈 검체는 암컷과 수컷 쥐의 검체에서 모화합물과 분자 질량이 226인 대사물(M3)의 흔적을 확실히 보여주었다. 이 대사물이 발생한 수준은 수컷보다 암컷 쥐에서 다시 한번 더 높게 나타났다. M3는 다른 쥐나 쥐 조직에서 발견되지 않았다. 이것은 M3가 쥐의 내장 미세플로라에 의해 형성될 수 있다는 것을 암시한다.[23] NRB를 경구 투여한 후, 쥐와 쥐 간을 모두 검사한 결과 모화합물의 흔적이 드러났다. 성별과 종의 대사물 수준을 비교했을 때, 수컷 쥐나 쥐보다 암컷 쥐에서 훨씬 더 많은 양이 발견되었다. 암컷 및 수컷 랫드의 HPLC 크로마토그램 간 준비물은 4개 대사물(U1, V1, M1, M1, M2)의 검출 결과를 나타낸다.(그림 7.2) 질량 분광법을 사용하여 이를 식별하고 쉽게 식별했다. 왜냐하면 수산화 대사물이 NRB보다 +16A 더 높았기 때문이다. 이러한 연구는 대사물이 시험관내 준비에서 발견된 것과 동일하다는 것을 확인했다.[5][23] 그 대사물들은 쥐 간의 준비에서 발견되지 않았다. 더욱이 쥐뿐만 아니라 쥐에서도 경구 투여 후 NRB 모화합물이나 그 대사물이 심장에서 발견되지 않았다. 이러한 검출 가능한 대사물의 부족은 NRB가 극도로 낮은 수준에서 치명적인 영향을 유발할 수 있음을 암시한다.[23]
동물에 대한 부작용과 영향
역효과
노르보르미드의 영향은 내분자(endo-isomer)에 의해 발생하지만, exo-isomers R, T, X는 쥐의 동맥이 매끄러운 근육에 수축 효과를 보이지 않았다. 근육에 이완 효과만 있을 뿐이었다.[5] 로즈코우키시의 동물 연구에서, 그는 NRB에 의해 야기되는 효과는 되돌릴 수 없다는 것을 보여주었다.[24] 또 다른 연구는 체내 노르보르미드로 처리된 쥐의 심혈관 효과 이후 호흡기압이 있었다는 것을 보여주었다.[25]
동물에 미치는 영향
NRB는 특히 쥐에게 독성이 있지만 다른 설치류나 포유류에게는 비교적 무해하다. 실험한 모든 동물과 쥐 대동맥 및 외혈관 평활근 조직에서도 NRB는 동맥에 혈관확장제 특성을 나타낸다.[13] NRB의 또 다른 효과는 스테로이드-호르몬 합성의 늦은 단계를 강화하여 쥐와 쥐의 부신에서 코르티코스테론과 알도스테론 생성을 자극하는 것이다.[14]
독성
NRB의 독특한 독성은 여러 종의 설치류를 사용하여 동물 실험을 수행함으로써 결정되었다. 독성 선량은 구두로 투여되었다.[26] 표에서 정의된 LD50 데이터는 화합물의 특정 독성을 나타낸다. 쥐, 특히 암컷은 적은 양의 NRB를 투여한 후에도 독소의 효과를 경험한다. NRB는 기니피그와 생쥐에게도 독성이 있지만 덜하다. 인간의 LD50 값에 대해 이용할 수 있는 신뢰할 수 있는 정보가 없다. 비록 NRB는 설치류 살충제이고 특히 갈색 쥐에게 독성이 있지만, 인간은 흡입과 피부 접촉을 통해 NRB에 노출될 수 있다.
노출 급성 독성 수준 경구 LD50(mg/kg)
- 쥐 (수) 15
- 쥐 (암) 5
- 기니피그 620
- 마우스 2250
쥐의 급성 독성 연구
쥐에게 치사량의 NRB는 시안화 독성과 관련된 징후와 매우 유사한 행동 변화를 일으킨다. NRB 독성의 첫 징후는 투여 후 약 10분 후에 나타난다. 처음에 쥐들은 운동 활동 증가와 불규칙성의 징후를 보이기 시작한다. 그 후, 쥐의 뒷다리는 약해지고 아헨이 된다. 그들의 호흡은 고갈되기 시작하고 짧은 시간 안에 쥐들은 일련의 경련적인 움직임에 시달린다. 이 경련은 사망에 이은 것으로, 알비노 실험용 쥐에서는 30분 이내에, 야생동물에서는 2시간 내에 발생한다.[24] Langendorff 준비, 시험관 내 기술에서 번번이에 격리된 쥐 심장을 진찰한 후, 전 방향 항법 보조 장치 또한 쥐의 심장에 심각한species-selective 독성 효과를 유발하는 것으로 밝혀졌다.[24]곳 µg 전 방향 항법 보조 장치 피의 흐름의 감소에 따른 관상 혈관, 감소된 심장 수축과는 줄고 심장 박동이 따르기로 주입됐다.쥐의 심장은 매우 불규칙적으로 뛰기 시작했다. 이러한 돌이킬 수 없는 효과는 아마도 예상한 대로 심장 근육(심초음파)에 표시되지 않고 관상동맥에 바로 표시되었다.[24] 또한 NRB 치료를 받은 쥐는 과호흡에 따른 심혈관 질환을 앓고 있는 것으로 확인됐다.[25] 최근의 연구는 고립된 랫드 준비에서 미토콘드리아 투과성 전환 모공(MPTP)을 활성화하는 NRB의 능력을 제시한다. 세포 사멸과 괴사는 MPT 모공에 의해 조절된다. 미토콘드리아 막의 그러한 호전성이 독이 든 동물의 세포대사에 문제를 일으킨다는 것은 이해할 수 있다.[8]
포유류와 조류 독성 연구
라투스속은 NRB에 매우 민감하지만 다른 동물들은 독성 효과를 경험하지 않는다. 정밀 검사 결과, 1000mg/kg의 노르보르미드는 고양이, 닭, 개, 원숭이, 쥐, 돼지 또는 새에게 경구 투여할 때 독성 징후를 나타내지 않았다. 이것은 아래 표에서 확인되었다. 그래서 NRB는 비래트 종에 대해 비교적 무해하다고 해도 무방하다.[24]
참조
- ^ a b c Rennison D, Bova S, Cavalli M, Ricchelli F, Zulian A, Hopkins B, Brimble MA (April 2007). "Synthesis and activity studies of analogues of the rat selective toxicant norbormide". Bioorganic & Medicinal Chemistry. 15 (8): 2963–74. doi:10.1016/j.bmc.2007.02.012. PMID 17321141.
- ^ Zulian A, Petronilli V, Bova S, Dabbeni-Sala F, Cargnelli G, Cavalli M, et al. (July 2007). "Assessing the molecular basis for rat-selective induction of the mitochondrial permeability transition by norbormide". Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1767 (7): 980–8. doi:10.1016/j.bbabio.2007.04.002. PMID 17509521.
- ^ "40 C.F.R.: Appendix A to Part 355—The List of Extremely Hazardous Substances and Their Threshold Planning Quantities" (PDF) (July 1, 2008 ed.). Government Printing Office. Archived from the original (PDF) on February 25, 2012. Retrieved October 29, 2011.
- ^ Telle HJ (1967). "Some fields observations on the observations on the acceptability and effectiveness of norbormide to Rattus norvegicus". Who/VBC. 67 (39): 10.
- ^ a b c d e f Ravindran S, Hopkins B, Bova S, Rennison D, Brimble M, Tingle M (January 2009). "In vitro metabolism of norbormide in rat, mouse and guinea pig liver preparations". Environmental Toxicology and Pharmacology. 27 (1): 144–8. doi:10.1016/j.etap.2008.09.007. PMID 21783932.
- ^ Bova S, Trevisi L, Cima L, Luciani S, Golovina V, Cargnelli G (February 2001). "Signaling mechanisms for the selective vasoconstrictor effect of norbormide on the rat small arteries". The Journal of Pharmacology and Experimental Therapeutics. 296 (2): 458–63. PMID 11160631.
- ^ Cavalli M, Omiciuolo L, Cargnelli G, Cima L, Hopkins B, Bova S (September 2004). "Distribution of the vasoconstrictor and vasorelaxant effects of norbormide along the vascular tree of the rat". Life Sciences. 75 (18): 2157–65. doi:10.1016/j.lfs.2004.04.022. PMID 15325842.
- ^ a b Ricchelli F, Dabbeni-Sala F, Petronilli V, Bernardi P, Hopkins B, Bova S (June 2005). "Species-specific modulation of the mitochondrial permeability transition by norbormide". Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1708 (2): 178–86. doi:10.1016/j.bbabio.2005.03.002. PMID 15953474.
- ^ Nilsson, B, Norbormide의 비활성 경주 동료의 Steroxhemistry - 선택적 쥐 독성 물질. 액타 케미카 스칸디나비카, 1968. 22. 2.
- ^ Steel PJ, Brimble MA, Hopkins B, Rennison D (May 2004). "Two stereoisomers of the rat toxicant norbormide". Acta Crystallographica Section C. 60 (Pt 5): o374-6. doi:10.1107/S0108270104006845. hdl:10092/365. PMID 15131397.
- ^ 2004년 브림블 M.A., 예.
- ^ a b c d e Poos GI, Mohrbacher RJ, Carson EL, Paragamian V, Puma BM, Rasmussen CR, Roszkowski AP (July 1966). "Structure-activity studies with the selective rat toxicant norbormide". Journal of Medicinal Chemistry. 9 (4): 537–40. doi:10.1021/jm00322a021. PMID 5968018.
- ^ a b Rennison D, Laita O, Bova S, Cavalli M, Hopkins B, Linthicum DS, Brimble MA (July 2012). "Design and synthesis of prodrugs of the rat selective toxicant norbormide". Bioorganic & Medicinal Chemistry. 20 (13): 3997–4011. doi:10.1016/j.bmc.2012.05.014. PMID 22658693.
- ^ a b Neri G, Tortorella C, Andreis PG, Bova S, Malendowicz LK, Ziolkowska A, Nussdorfer GG (March 2003). "Norbormide enhances late steps of steroid-hormone synthesis in rat and mouse adrenal cortex". The Journal of Steroid Biochemistry and Molecular Biology. 84 (4): 479–83. doi:10.1016/s0960-0760(03)00060-8. PMID 12732293. S2CID 10840313.
- ^ Bova S, Cavalli M, Cima L, Luciani S, Saponara S, Sgaragli G, Cargnelli G, Fusi F (June 2003). "Relaxant and Ca2+ channel blocking properties of norbormide on rat non-vascular smooth muscles". European Journal of Pharmacology. 470 (3): 185–91. doi:10.1016/s0014-2999(03)01797-7. PMID 12798957.
- ^ a b Zulian A, Sileikytė J, Petronilli V, Bova S, Dabbeni-Sala F, Cargnelli G, Rennison D, Brimble MA, Hopkins B, Bernardi P, Ricchelli F (December 2011). "The translocator protein (peripheral benzodiazepine receptor) mediates rat-selective activation of the mitochondrial permeability transition by norbormide". Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1807 (12): 1600–5. doi:10.1016/j.bbabio.2011.08.007. PMID 21889488.
- ^ Mitchell JR, Jollow DJ, Potter WZ, Davis DC, Gillette JR, Brodie BB (October 1973). "Acetaminophen-induced hepatic necrosis. I. Role of drug metabolism". The Journal of Pharmacology and Experimental Therapeutics. 187 (1): 185–94. PMID 4746326.
- ^ Henderson RF (December 1996). "Species differences in the metabolism of benzene". Environmental Health Perspectives. 104 Suppl 6: 1173–5. doi:10.1289/ehp.961041173. PMC 1469720. PMID 9118889.
- ^ Tingle MD, Mahmud R, Maggs JL, Pirmohamed M, Park BK (November 1997). "Comparison of the metabolism and toxicity of dapsone in rat, mouse and man". The Journal of Pharmacology and Experimental Therapeutics. 283 (2): 817–23. PMID 9353403.
- ^ Duffus JH, Nordberg M, Templeton DM (January 2007). "Glossary of Terms Used in Toxicology, 2nd Edition". Pure and Applied Chemistry. 79 (7): 1153–344. doi:10.1351/pac200779071153. S2CID 98296965.
- ^ Greim H, Snyder R (2008). Toxicology and risk assessment: a comprehensive introduction. Wiley-Interscience. p. 387.
- ^ Vogel GH (2006). Drug discovery and evaluation: safety and pharmacokinetic assays. Springer. p. 509.
- ^ a b c Ravindran S, Hopkins B, Bova S, Tingle M (July 2009). "In vivo metabolism of norbormide in rats and mice". Environmental Toxicology and Pharmacology. 28 (1): 147–51. doi:10.1016/j.etap.2009.03.013. PMID 21783995.
- ^ a b c d e Roszkowski AP (August 1965). "The pharmacological properties of norbormide, a selective rat toxicant". The Journal of Pharmacology and Experimental Therapeutics. 149 (2): 288–99. PMID 4953462.
- ^ a b Yelnosky J, Lawlor R (September 1971). "Cardiovascular effects of norbormide". European Journal of Pharmacology. 16 (1): 117–9. doi:10.1016/0014-2999(71)90065-3. PMID 5157526.
- ^ Russel RU. "Norbormide - a Rattus-specific toxic agent". J. Forensic Sci. 1965: 80–83.


