신경필라멘트
Neurofilament| NF-L 저분자량 신경필라멘트 단백질 | |||||||
|---|---|---|---|---|---|---|---|
| 식별자 | |||||||
| 기호 | NEFL | ||||||
| 엔씨비유전자 | 4747 | ||||||
| HGNC | 7739 | ||||||
| 오밈 | 162280 | ||||||
| RefSeq | NM_006158 | ||||||
| 유니프로트 | P07196 | ||||||
| 기타자료 | |||||||
| 로커스 | 8번 씨 p21 | ||||||
| |||||||
| NF-M 중분자량 신경필라멘트 단백질 | |||||||
|---|---|---|---|---|---|---|---|
| 식별자 | |||||||
| 기호 | NEFM | ||||||
| Alt. 기호 | NEF3 | ||||||
| 엔씨비유전자 | 4741 | ||||||
| HGNC | 7734 | ||||||
| 오밈 | 162250 | ||||||
| RefSeq | NM_005382 | ||||||
| 유니프로트 | P07197 | ||||||
| 기타자료 | |||||||
| 로커스 | 8번 씨 p21 | ||||||
| |||||||
| NF-H 고분자량 신경필라멘트 단백질 | |||||||
|---|---|---|---|---|---|---|---|
| 식별자 | |||||||
| 기호 | NEFH | ||||||
| 엔씨비유전자 | 4744 | ||||||
| HGNC | 7737 | ||||||
| 오밈 | 162230 | ||||||
| RefSeq | NM_021076 | ||||||
| 유니프로트 | P12036 | ||||||
| 기타자료 | |||||||
| 로커스 | 22번 씨 Q12.1-13.1 | ||||||
| |||||||
| 알파-인테넥신 뉴런 중간 필라멘트 단백질 | |||||||
|---|---|---|---|---|---|---|---|
| 식별자 | |||||||
| 기호 | A인 | ||||||
| Alt. 기호 | NEF5 | ||||||
| 엔씨비유전자 | 9118 | ||||||
| HGNC | 6057 | ||||||
| 오밈 | 605338 | ||||||
| RefSeq | NM_032727 | ||||||
| 유니프로트 | Q5SYd2 | ||||||
| 기타자료 | |||||||
| 로커스 | 10번 씨 q24 | ||||||
| |||||||
| 주변신경 중간 필라멘트 단백질 | |||||||
|---|---|---|---|---|---|---|---|
| 식별자 | |||||||
| 기호 | PRPH | ||||||
| Alt. 기호 | NEF4 | ||||||
| 엔씨비유전자 | 5630 | ||||||
| HGNC | 9461 | ||||||
| 오밈 | 170710 | ||||||
| RefSeq | NM_006262.3 | ||||||
| 유니프로트 | P41219 | ||||||
| 기타자료 | |||||||
| 로커스 | 12번 씨 Q13.12 | ||||||
| |||||||
| 네스틴 뉴런 줄기세포 중간 필라멘트 단백질 | |||||||
|---|---|---|---|---|---|---|---|
| 식별자 | |||||||
| 기호 | NES | ||||||
| 엔씨비유전자 | 10763 | ||||||
| HGNC | 7756 | ||||||
| 오밈 | 600915 | ||||||
| RefSeq | NP_006608 | ||||||
| 유니프로트 | P48681 | ||||||
| 기타자료 | |||||||
| 로커스 | 1번 씨 Q23.1 | ||||||
| |||||||
신경필름(NF)은 뉴런의 세포질에서 발견되는 IV형 중간필름으로 분류된다. 그것들은 지름 10nm의 단백질 고분자이고 길이가 많은 마이크로미터다.[1] 미세관(약 25nm), 미세섬유(7nm)와 함께 뉴런 사이토스켈레톤을 형성한다. 그것들은 주로 축에 대한 구조적 지지와 신경 전도 속도에 영향을 미치는 축의 직경을 조절하는 데 기능한다고 여겨진다. 신경필름을 형성하는 단백질은 중간 필라멘트 단백질 계열의 구성원으로 유전자 조직과 단백질 구조에 따라 6가지 유형으로 나뉜다. 타입 I과 타입 II는 상피로 표현되는 케라틴이다. 타입 III는 비멘틴, 데스민, 주변기, 글루알섬유산성단백질(GFAP)을 함유하고 있다. IV형은 신경필름단백질 L, M, H, interexin으로 구성된다. V형은 핵 라민으로 구성되며, VI형은 단백질 네스틴으로 구성된다. IV형 중간 필라멘트 유전자는 모두 다른 중간 필라멘트 유전자 배열에서 발견되지 않은 두 개의 고유한 인트론을 공유하며, 하나의 원시형 IV 유전자에서 공통적인 진화 기원을 제시한다.
신경세포의 세포질에 확장되는 단백질의 필라멘트를 신경섬유라고 부르기도 한다.[2] 이 이름은 몇몇 신경퇴행성 질환의 신경섬유 엉클에서 사용된다.
신경필라멘트단백질
신경필름의 단백질 구성은 동물성 식물마다 매우 다양하다. 대부분은 포유류의 신경섬유에 대해 알려져 있다. 역사적으로 포유류의 신경필라멘트는 원래 신경필라멘트 단백질 L(저분자량; NFL), M(중분자량; NFM)과 H(고분자량; NFH)라고 불리는 3개의 단백질로만 구성되어 있다고 생각되었다. 이 단백질들은 축류 수송에 관한 연구로부터 발견되었고 종종 "신경계 3중"으로 언급된다.[3] 그러나 이제 신경필름에도 단백질인 내넥신[4](interexin)이 들어 있고 말초신경계의 신경필름에도 단백질 주변성이 들어 있다는 것이 명백해졌다.[5] (이것은 망막에서 발현되는 주변성 2와는 다르다.) 따라서 포유류 신경필름은 최대 5개의 서로 다른 단백질의 이단층이다: NfL, NfM, NfH, interexin-alpha, peripherin. 5개의 신경필라멘트 단백질은 서로 다른 신경세포 유형과 다른 발달 단계에서 다른 조합으로 공동 결합할 수 있다. 주어진 신경세포에서 신경필름의 정확한 구성은 그 당시 세포 내 신경필름단백질의 상대적 표현 수준에 따라 달라진다. 예를 들어 NfH 표현은 뉴런 발달이 낮고 골수축이 있는 뉴런에서는 산후적으로 증가한다.[6] 성인의 신경계에서는 작은 무광택 액손의 신경 필라멘트가 더 많은 NfH와 적은 NfH를 포함하고 있는 반면, 대형 미광택 액손의 신경 필라멘트는 더 많은 NfH와 더 적은 주변기를 포함하고 있다. 타입 III 중간 필라멘트 서브 유닛인 비멘틴은 망막의 수평 뉴런과 같은 타입 IV 단백질과 연관되어 성인의 뉴런과 매우 특이한 뉴런 몇 개를 발달시키는 과정에서 발현된다.
| 단백질 | 아미노산 | NCBI Ref Seq | 예측 분자 질량 | 겉보기 분자질량(SDS-PAGE) |
|---|---|---|---|---|
| 주변기호 | 470 | NP_006253.2 | 53.7 kDa | ~56kDa |
| 인터넥신 | 499 | NP_116116.1 | 55.4 kDa | ~66kDa |
| 신경필라멘트단백질L | 543 | NP_006149.2 | 61.5kDa | ~70kDa |
| 신경필라멘트단백질M | 916 | NP_005373.2 | 102.5kDa | ~160kDa |
| 신경필라멘트단백질H | 1020 | NP_066554.2 | 111.9 kDA | ~200kDa |
3중 단백질은 상대적 크기(낮음, 중간, 높음)를 기준으로 이름이 지어진다. SDS-PAGE에 의해 결정되는 각 단백질의 겉보기 분자 질량은 아미노 시퀀스에서 예측된 질량보다 크다. 이는 이들 단백질의 변칙적인 전기생성 이동 때문이며, 특히 충전된 아미노산 함량이 높고 광범위한 인산화 작용으로 신경필라멘트 단백질 M과 H의 경우 극단적이다. 세 가지 신경필름 트리플트 단백질 모두 글루탐산과 리신잔류물이 풍부한 폴리펩타이드 시퀀스가 길게 늘어져 있고, NfM과 특히 NfH는 탠덤하게 반복되는 세린인산화 부위도 다수 함유하고 있다. 이러한 부위는 거의 모두 펩타이드 리신세린프로라인(KSP)을 함유하고 있으며, 인산화효소는 일반적으로 덴드리트틱 신경필름이 아닌 축에서 발견된다. 휴먼 NfM은 13개의 KSP 사이트를 보유하고 있으며, 휴먼 NF-H는 이 중 44개를 생성하고 나머지 45개를 반복하는 두 개의 아일로부터 표현된다.
신경필라멘트 조립체 및 구조
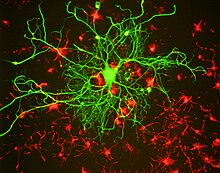
다른 중간 필라멘트 단백질과 마찬가지로, 신경필라멘 단백질은 대부분 구조화되지 않은 아미노 단자와 카복시 단자 영역 옆에 있는 막대형 3차 구조 때문에 로드 영역으로 알려진 공통 중심 알파 나선 영역을 공유한다. 두 신경필름단백질의 로드영역은 디머라이징되어 알파헬리컬 코일(Alpha-heelic coiled coil)을 형성한다. 두 개의 디머가 시차 대위법으로 연결되어 테트라머를 형성한다. 이 테트라머는 신경필라멘트의 기본 소단위(즉, 건물블록)로 생각된다. 테트라머 서브유닛은 측면과 측면으로 결합하여 단위 길이 필라멘트를 형성하고, 그 다음에는 성숙한 신경필라멘트 폴리머를 형성하기 위해 안네랄 엔드투엔드로 연결되지만, 주로 이질적인 단백질 구성과 신경필름 또는 신경필라멘트 프로를 결정화하지 못하기 때문에 폴리머 내에서 이러한 서브유닛의 정확한 구성은 알려져 있지 않다.teins. 구조 모델은 일반적으로 필라멘트 단면에서 8개의 테트라머(32 신경필라멘트 폴리펩타이드)를 가정하지만, 선형 질량 밀도의 측정은 이것이 달라질 수 있음을 시사한다.
신경필라멘트 단백질의 아미노 단자 영역은 수많은 인산화 부위를 포함하고 있으며 필라멘트 조립 중 서브 유닛 상호작용에 중요한 것으로 보인다. 카복시 단자 영역은 알파 나선 또는 베타 시트가 없는 본질적으로 정렬되지 않은 영역으로 보인다. 신경필름단백질의 크기가 다른 것은 주로 카복시 단자 영역의 길이 차이 때문이다. 이들 영역에는 산성 물질과 기초 아미노산 잔류물이 풍부하다. NFM과 NFH의 카복시 단자 영역은 가장 길고 체내 인산화, 글리코실화 등의 변환 후 수정에 의해 광범위하게 수정된다. 그것들은 필라멘트 백본에서 방사상으로 투영되어 병 브러시의 칫솔과 유사한 고충전 및 비정형 영역의 촘촘한 브러시 테두리를 형성한다. 이러한 엔트로피적으로 펄럭이는 영역은 각 필라멘트 주위에 배타 영역을 정의하여 필라멘트를 주변 영역과 효과적으로 간격을 두도록 제안되었다. 이런 방식으로 카복시 단자 투영법은 신경필름 폴리머의 공간충전 특성을 최대화한다. 전자 현미경으로 보면, 이 영역들은 이웃한 필라멘트와 접촉하는 것처럼 보이는 측면이라고 불리는 투영으로 나타난다.
신경필라멘트함수
신경필름은 특히 액손의 고농도의 척추동물 뉴런에서 발견되는데, 이들은 모두 액손의 긴 축을 따라 평행하게 배열되어 연속적으로 겹치는 배열을 형성한다. 그들은 축 직경을 증가시키는 공간을 채우는 구조로서 기능하도록 제안되었다. 액손 직경에 대한 이들의 기여는 액손 내 신경 필라멘트 수와 패킹 밀도에 의해 결정된다. 액손에 있는 신경필름의 수는 신경필름 유전자 발현과[7] 축전달에 의해 결정된다고 생각된다. 필라멘트의 포장 밀도는 인접 필라멘트 사이의 간격을 정의하는 옆팔에 의해 결정된다. 측두엽의 인산화 작용은 확장성을 증가시켜 인접 필라멘트의[9][10] 측두 사이에 이분 계수를 결합함으로써 인접 필라멘트[8] 사이의 간격을 증가시키는 것으로 생각된다.
개발 초기에 액손은 상대적으로 적은 신경필름을 포함하고 있는 좁은 공정이다. 골수화 된 축은 더 많은 신경필름을 축적하는데, 이것은 축수체의 확장을 촉진한다. 액손이 성장하여 목표 세포와 연결되면 액손의 지름이 5배까지 증가할 수 있다.[11] 이는 신경세포 몸체에서 수출되는 신경필름의 증가와 운반속도의 둔화에 기인한다. 성숙한 골수화 차축에서 신경필름은 가장 풍부한 단일 세포질 구조가 될 수 있으며 차축 단면적의 대부분을 차지할 수 있다. 예를 들어, 큰 골수축은 한 단면에 수천 개의 신경필름을 포함할 수 있다.
신경필라멘트 이송
신경 필라멘트는 액손에 대한 구조적 역할 외에도 액손 수송의 화물이다.[3] 액손에 들어 있는 신경필라멘트 단백질의 대부분은 신경세포체에서 합성되는데, 약 30분 내에 신경필라멘트 폴리머로 빠르게 조립된다.[12] 이 조립된 신경필라멘트 폴리머는 미세관 운동단백질에 의해 구동되는 미세관 트랙을 통해 액손에 따라 운반된다.[13] 필라멘트는 양방향으로, 즉 액손 팁(테로그라드)을 향해, 그리고 세포 본체를 향해(역방향) 이동하지만, 순방향은 테로그라드다. 필라멘트는 짧은 시간 척도(초 또는 분)에서 최대 8µm/s의 속도로 이동하며 평균 속도는 약 1µm/s이다.[14] 그러나 긴 시간(시간 또는 일)의 평균 속도는 움직임이 매우 드물기 때문에 느리고, 긴 일시 중지에 의해 중단되는 짧은 단거리 단거리 단거리들로 구성된다.[15][16] 따라서 오랜 시간 동안 신경필름은 축 이송의 느린 구성 요소로 이동한다.
임상 및 연구 애플리케이션
신경필라멘 단백질에 대한 수많은 특정 항체가 개발되었고 상업적으로 이용 가능하다. 이 항체들은 면역항체 현미경이나 면역항체화학물질을 이용하여 세포와 조직의 신경필라멘트 단백질을 검출하는 데 사용될 수 있다. 그러한 항체는 뉴런과 그 과정을 역사학 부분과 조직 배양에서 식별하는데 널리 사용된다. 6 타입의 중간 필라멘트 단백질 네스틴은 뉴런과 글리아를 발달시키는 과정에서 표현된다. 네스틴은 뉴런 줄기세포의 표적으로 여겨지고 있으며, 이 단백질의 존재는 신경생식을 정의하는 데 널리 사용된다. 이 단백질은 개발이 진행되면서 없어진다.
신경필라멘트 항체는 진단 신경병학에서도 흔히 사용된다. 이러한 항체로 얼룩을 지우면 뉴런(신경필라멘트 단백질에 양성)과 글리아(신경필라멘트 단백질에 음성)를 구별할 수 있다.
중추신경계에[17][18] 영향을 미치는 질병에서 신경필름단백질을 축손상 바이오마커로 사용하는 것에도 임상적 관심이 상당하다 뉴런이나 축삭이 변질되면 신경필름단백질이 혈액이나 뇌척수액으로 방출된다. 따라서 뇌척수액과 혈장 내 신경필라멘트 단백질의 면역항진제는 신경장애의 축 손상 지표로 작용할 수 있다.[19] NfL은 근위축성 측경화증,[20] 다발경화증,[21] 그리고 최근에는 헌팅턴병에서 질병 모니터링에 유용한 표식이다.[22] 급성 허혈성 뇌졸중에[23] 따른 기능적 결과의 예후 표기로도 평가되고 있다.
신경필름 이상을 가진 돌연변이 쥐는 근위축성 측경화증을 닮은 표현형을 가지고 있다.[24]
참고 항목
참조
- ^ Yuan, A; Rao, MV; Veeranna; Nixon, RA (15 July 2012). "Neurofilaments at a glance". Journal of Cell Science. 125 (Pt 14): 3257–63. doi:10.1242/jcs.104729. PMC 3516374. PMID 22956720.
- ^ "Definition of Neurofibril". www.merriam-webster.com. Retrieved 6 December 2019.
- ^ a b Hoffman PN, Lasek RJ (August 1975). "The slow component of axonal transport. Identification of major structural polypeptides of the axon and their generality among mammalian neurons". The Journal of Cell Biology. 66 (2): 351–66. doi:10.1083/jcb.66.2.351. PMC 2109569. PMID 49355.
- ^ Yuan A, Rao MV, Sasaki T, Chen Y, Kumar A, Liem RK, et al. (September 2006). "Alpha-internexin is structurally and functionally associated with the neurofilament triplet proteins in the mature CNS". The Journal of Neuroscience. 26 (39): 10006–19. doi:10.1523/jneurosci.2580-06.2006. PMC 6674481. PMID 17005864.
- ^ Yuan A, Sasaki T, Kumar A, Peterhoff CM, Rao MV, Liem RK, et al. (June 2012). "Peripherin is a subunit of peripheral nerve neurofilaments: implications for differential vulnerability of CNS and peripheral nervous system axons". The Journal of Neuroscience. 32 (25): 8501–8. doi:10.1523/jneurosci.1081-12.2012. PMC 3405552. PMID 22723690.
- ^ Nixon RA, Shea TB (1992). "Dynamics of neuronal intermediate filaments: a developmental perspective". Cell Motility and the Cytoskeleton. 22 (2): 81–91. doi:10.1002/cm.970220202. PMID 1633625.
- ^ Molecular biology of the cell (4th ed.). Garland Science. 2002. ISBN 978-0-8153-3218-3.
- ^ Eyer J, Leterrier JF (June 1988). "Influence of the phosphorylation state of neurofilament proteins on the interactions between purified filaments in vitro". The Biochemical Journal. 252 (3): 655–60. doi:10.1042/bj2520655. PMC 1149198. PMID 2844152.
- ^ Kushkuley J, Chan WK, Lee S, Eyer J, Leterrier JF, Letournel F, Shea TB (October 2009). "Neurofilament cross-bridging competes with kinesin-dependent association of neurofilaments with microtubules". Journal of Cell Science. 122 (Pt 19): 3579–86. doi:10.1242/jcs.051318. PMID 19737816.
- ^ Kushkuley J, Metkar S, Chan WK, Lee S, Shea TB (March 2010). "Aluminum induces neurofilament aggregation by stabilizing cross-bridging of phosphorylated c-terminal sidearms". Brain Research. 1322: 118–23. doi:10.1016/j.brainres.2010.01.075. PMID 20132798. S2CID 9615612.
- ^ Alberts, D (2015). Molecular biology of the cell (Sixth ed.). p. 947. ISBN 9780815344643.
- ^ Black MM, Keyser P, Sobel E (April 1986). "Interval between the synthesis and assembly of cytoskeletal proteins in cultured neurons". The Journal of Neuroscience. 6 (4): 1004–12. doi:10.1523/JNEUROSCI.06-04-01004.1986. PMC 6568432. PMID 3084715.
- ^ Wang L, Ho CL, Sun D, Liem RK, Brown A (March 2000). "Rapid movement of axonal neurofilaments interrupted by prolonged pauses". Nature Cell Biology. 2 (3): 137–41. doi:10.1038/35004008. PMID 10707083. S2CID 41152820.
- ^ Fenn JD, Johnson CM, Peng J, Jung P, Brown A (January 2018). "Kymograph analysis with high temporal resolution reveals new features of neurofilament transport kinetics". Cytoskeleton. 75 (1): 22–41. doi:10.1002/cm.21411. PMC 6005378. PMID 28926211.
- ^ Brown A (November 2000). "Slow axonal transport: stop and go traffic in the axon". Nature Reviews. Molecular Cell Biology. 1 (2): 153–6. doi:10.1038/35040102. PMID 11253369. S2CID 205010517.
- ^ Brown A, Wang L, Jung P (September 2005). "Stochastic simulation of neurofilament transport in axons: the "stop-and-go" hypothesis". Molecular Biology of the Cell. 16 (9): 4243–55. doi:10.1091/mbc.E05-02-0141. PMC 1196334. PMID 16000374.
- ^ Petzold A (June 2005). "Neurofilament phosphoforms: surrogate markers for axonal injury, degeneration and loss" (PDF). Journal of the Neurological Sciences. 233 (1–2): 183–98. doi:10.1016/j.jns.2005.03.015. PMID 15896809. S2CID 18311152.
- ^ Khalil M, Teunissen CE, Otto M, Piehl F, Sormani MP, Gattringer T, et al. (October 2018). "Neurofilaments as biomarkers in neurological disorders" (PDF). Nature Reviews. Neurology. 14 (10): 577–589. doi:10.1038/s41582-018-0058-z. PMID 30171200. S2CID 52140127.
- ^ Jonsson M, Zetterberg H, van Straaten E, Lind K, Syversen S, Edman A, et al. (March 2010). "Cerebrospinal fluid biomarkers of white matter lesions - cross-sectional results from the LADIS study". European Journal of Neurology. 17 (3): 377–82. doi:10.1111/j.1468-1331.2009.02808.x. PMID 19845747. S2CID 31052853.
- ^ Rosengren LE, Karlsson JE, Karlsson JO, Persson LI, Wikkelsø C (November 1996). "Patients with amyotrophic lateral sclerosis and other neurodegenerative diseases have increased levels of neurofilament protein in CSF". Journal of Neurochemistry. 67 (5): 2013–8. doi:10.1046/j.1471-4159.1996.67052013.x. PMID 8863508. S2CID 36897027.
- ^ Teunissen CE, Iacobaeus E, Khademi M, Brundin L, Norgren N, Koel-Simmelink MJ, et al. (April 2009). "Combination of CSF N-acetylaspartate and neurofilaments in multiple sclerosis". Neurology. 72 (15): 1322–9. doi:10.1212/wnl.0b013e3181a0fe3f. PMID 19365053. S2CID 22681349.
- ^ Niemelä V, Landtblom AM, Blennow K, Sundblom J (27 February 2017). "Tau or neurofilament light-Which is the more suitable biomarker for Huntington's disease?". PLOS ONE. 12 (2): e0172762. Bibcode:2017PLoSO..1272762N. doi:10.1371/journal.pone.0172762. PMC 5328385. PMID 28241046.
- ^ Liu, Daoshen; Chen, Jing; Wang, Xuanying; Xin, Jialun; Cao, Ruili; Liu, Zhirong (June 2020). "Serum Neurofilament Light Chain as a Predictive Biomarker for Ischemic Stroke Outcome: A Systematic Review and Meta-analysis". Journal of Stroke and Cerebrovascular Diseases. 29 (6): 104813. doi:10.1016/j.jstrokecerebrovasdis.2020.104813. PMID 32305278.
- ^ Lalonde R, Strazielle C (2003). "Neurobehavioral characteristics of mice with modified intermediate filament genes". Reviews in the Neurosciences. 14 (4): 369–85. doi:10.1515/REVNEURO.2003.14.4.369. PMID 14640321. S2CID 23675224.




