데이븐포트 다이어그램
Davenport diagram산염기 생리학에서 데이븐포트 다이어그램은 Horace W. 데이븐포트에 의해 개발된 그래픽 도구이며, 임상의나 연구자가 호흡 및/또는 대사산염기 장애에 따른 혈중 중탄산 농도와 혈중 pH를 설명할 수 있다.이 다이어그램은 폐포와 폐포 모세혈관의 생리적으로 복잡한 계면에서 이산화탄소, 중탄산수 및 수성 양성자 사이의 가능한 모든 화학적 평형 상태를 설명하는 3차원 표면을 보여준다.다이어그램에 표시된 표면은 실험적으로 결정되지만, 데이븐포트 다이어그램은 임상 환경에서 거의 사용되지 않지만, 연구자는 혈액산 기반 화학에 대한 생리학적 변화의 영향을 상상할 수 있다.임상 사용을 위해 두 가지 최신 혁신이 있습니다. 이상에[1] 대한 텍스트 설명을 제공하는 산염기 다이어그램과 [2]고도에 적합한 텍스트 설명을 제공하는 높은 고도 버전입니다.
파생
혈액 샘플이 폐포나 시험관내 실험실 실험에서 공기에 노출되면 공기 중의 이산화탄소는 수용액 내의 이산화탄소 유도체 및 다른 종과 빠르게 평형을 이룬다.그림 1은 산염기 생리와 관련된 혈액 내 이산화탄소의 가장 중요한 평형 반응을 보여준다.
이 방정식에서 HB/B- 완충 시스템은 다양한 양성자화 및 탈양성자 상태의 헤모글로빈과 같이 혈액에 존재하는 모든 비-중탄산 완충제를 나타낸다.사람의 혈액에는 많은 다른 비탄산 완충제가 존재하기 때문에, 주어진 PCO에서2 도달하는 최종 평형 상태는 매우 복잡하며 이론만으로는 쉽게 예측할 수 없다.데이븐포트 다이어그램은 실험 결과를 묘사함으로써 이 복잡한 시스템의 동작을 설명하는 간단한 접근방식을 제공합니다.
그림 2는 교과서 및 문헌에 일반적으로 묘사된 데이븐포트 다이어그램을 보여줍니다.다이어그램이 어떻게 해석되는지를 이해하려면 우선 다이어그램이 어떻게 파생되는지 이해하는 것이 좋습니다.다음 실험을 생각해 보세요.건강한 환자로부터 소량의 혈액 샘플을 채취하여 이산화탄소(PCO2)의 분압이 40mmHg로 유지되는 챔버에 넣는다.평형에 도달하면 그림 3과 같이 pH와 중탄산염 농도를 측정하여 차트에 표시한다.
다음으로 강산을 첨가한 후 강염기를 첨가하여 혈액 시료의 pH를 변화시키면서 챔버 내의 P를CO2 일정하게 유지한다.pH가 변화함에 따라 시료의 적정곡선이 생성된다(그림4).이 적정곡선은 실험 내내 챔버가 이 부분압으로 유지되었기 때문에 40 mmHg의 P에서만CO2 유효하다.
다음으로, 실험자가 동일한 환자로부터 동일한 새로운 혈액 샘플을 얻는다고 가정해 보십시오.그러나 P가CO2 40 mmHg인 챔버에 시료를 넣는 대신 챔버를 P가CO2 60 mmHg인 챔버로 리셋한다.평형 후에는 새로운 pH와 새로운 중탄산염 농도를 나타내는 새로운 지점에 도달한다(그림 5).새로운 높은CO2 P에서의 중탄산염 농도는 첫 번째 측정에서보다 큰 반면 pH는 더 작다는 점에 유의하십시오.어느 결과도 놀랄 일은 아니다.P가CO2 증가하면 시스템의 총 이산화탄소 양이 증가했음을 의미합니다.이산화탄소 가스는 용액 속의 이산화탄소 유도체와 평형 상태에 있기 때문에 중탄산염을 포함한 이산화탄소 유도체의 농도도 증가해야 한다.중탄산염 분자의 형성은 양성자의 방출과 함께 이루어지기 때문에 pH의 하락도 놀랍지 않다(그림 1 참조).
이 같은 실험을 이산화탄소의 다양한 부분 압력에서 반복하면 일련의 포인트를 얻을 수 있습니다.이 점들을 통해 완충선(그림 6)이라고 하는 선을 그을 수 있습니다.
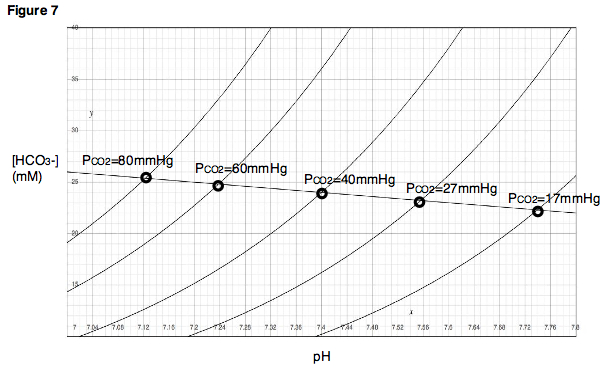
버퍼 라인을 사용하여 실험적으로 결정된 점에 가까운 범위 내에서 P를CO2 변화시킨 결과를 예측할 수 있습니다.또, 각 실험점에 대해서, P를 일정하게 유지하면서CO2 pH를 변화시키는 적정 실험을 실시할 수 있어 이산화탄소 분압 마다 적정 곡선을 작성할 수 있다(그림 7).데이븐포트 다이어그램에서 이러한 적정 곡선은 이산화탄소의 고정된 부분 압력에서 생성되기 때문에 등각선이라고 불립니다.
Davenport 다이어그램을 이해하는 데 있어 중요한 개념은 P가 증가함에 따라CO2 pH의 변화 크기가 용액에 존재하는 비탄산 버퍼의 버퍼링 파워에 의존한다는 점에 주목하는 것입니다.강한 비탄산염 완충제가 존재한다면, 그들은 중탄산염의 형성에 의해 방출되는 대부분의 양성자를 빠르게 흡수할 것이고, pH는 주어진 중탄산염 농도의 상승에 대해 거의 변화하지 않을 것이다.그 결과 경사가 매우 가파른 완충 라인이 됩니다(그림 8).한편, 약한 비탄산버퍼만 존재하는 경우(또는 비탄산버퍼가 전혀 존재하지 않는 경우), 특정 중탄산염 농도의 변화에 대해 pH의 큰 변화가 관찰되어 버퍼라인의 기울기가 0에 가까워집니다.
중탄산염 라인의 기울기는 비중탄산 버퍼가 전혀 없는 경우에도 평형 조건에서는 실제로 0(즉 수평이 되지 않음)에 도달하지 않는다는 점에 유의하십시오.이는 앞에서 언급한CO2 바와 같이 P의 증가에 따른 양성자의 생산은 중탄산 이온의 생산과 병행하기 때문이다.따라서 P의 증가로CO2 인한 pH의 감소는 항상 중탄산염 농도의 약간의 증가를 수반하여 발생해야 한다.마찬가지로, 비슷한 이유로 pH의 증가는 중탄산염 농도의 약간의 감소와 함께 일어나야 한다.
3차원 표면의 2차원 표현
데이븐포트 다이어그램에 나타나는 관계는 P, 중탄산염 농도 및 pH의CO2 세 변수 간의 관계임을 기억하십시오.따라서 그림 7은 지형도, 즉 3차원 표면의 2차원 표현으로 생각할 수 있으며, 각 등각선은 서로 다른 부분 압력 또는 "고도"를 나타낸다.
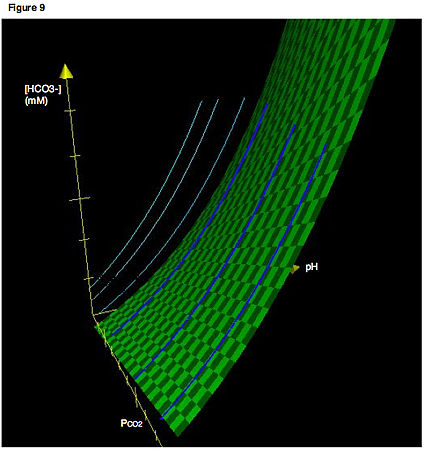
좀 더 정확한 묘사는 세 개의 축을 사용합니다.그림 9는 데이븐포트 다이어그램을 3차원으로 나타낸 것입니다.밝은 파란색 선은 우리가 보통 접하는 것과 같은 이등분선을 나타내며, 2차원 평면에 국한됩니다.짙은 파란색 곡선은 등각선의 실제 위치를 입체적으로 보여준다.따라서 연한 파란색 선은 단순히 3차원 공간의 등각선을 2차원 평면에 투영한 것입니다.다시 말하지만, 이등분은 단지 적정 곡선, 즉 P가 일정하게 유지된 상태에서CO2 pH가 변화할 경우 추적되는 경로임을 기억하십시오.녹색 표면은 시스템의 평형을 만족시키는 P, [HCO3−] 및 pH의CO2 모든 조합을 나타냅니다.실제 3차원 방향에 있는 모든 등각선은 이 표면에만 국한되어야 합니다.
두 번째 주요 개념은 버퍼 라인을 따라 이동하는 것이 P의 변화에CO2 대응해야 한다는 것입니다.따라서 등분선처럼 일반적인 데이븐포트 다이어그램(예: 그림 6)에 그려진 완충선은 실제로 3차원 공간에 존재하는 선을 2차원 평면에 투영하는 것이다.등각선과 마찬가지로 실제 3차원 방향의 버퍼라인은 시스템의 평형을 만족시키는 P, [HCO3−], pH의CO2 값을 나타내는 표면에 한정된다.그림 10에서 진한 빨간색 선은 3차원 공간에서의 실제 버퍼 라인이며, 연한 빨간색 선은 2차원 평면에 대한 버퍼 라인 투영이다.(특정 시스템에 대해 복수의 병렬 버퍼 회선을 결정하는 방법에 대해서는 나중에 설명하겠습니다).
호흡 및 대사성 산염기 장애
데이븐포트 다이어그램의 가장 중요한 특징 중 하나는 호흡 및/또는 신진대사의 변화에 따른 평형 표면의 한 지점에서 다른 점으로의 이동을 묘사하는 데 유용하다는 것이다.신체 내 산-염기 균형에 영향을 미치는 네 가지 근본적인 변화가 발생할 수 있습니다: 호흡 산증, 호흡 알칼리증, 대사 산증 및 대사 알칼리증.또한 호흡산증 후 대사알칼로시스로의 보상적 이행과 같은 호흡과 대사장애가 동시에 발생할 수 있다.
호흡 장애
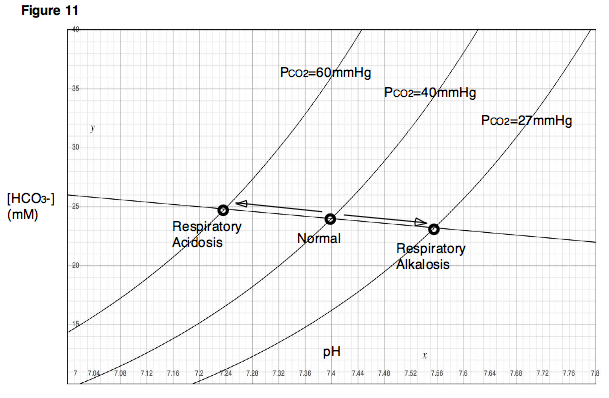
호흡의 변화가 혈액의 pH에 어떻게 영향을 미칠 수 있는지 이해하기 위해 폐의 P에 대한CO2 환기의 영향을 고려합니다.만약 누군가가 숨을 참는다면, 혈액은 폐에 있는 폐포에 이산화탄소를 계속 전달할 것이고, 폐에 있는 이산화탄소의 양은 증가할 것이다.한편, 만약 누군가가 과호흡을 한다면, 신선한 공기가 폐로 빨려 들어가 이산화탄소가 빠르게 배출될 것이다.첫 번째 경우는 이산화탄소가 폐에 축적되어 있기 때문에 폐포CO2 P가 매우 높아집니다.두 번째 경우, 이산화탄소가 폐에서 빠르게 빠져나가기 때문에 폐포CO2 P는 매우 낮을 것이다.이 두 가지 상황, 즉 호흡 억제와 과호흡은 이산화탄소의 부분 압력이 변화하고 그에 따른 pH 변화가 관찰된 앞에서 설명한 실험과 즉시 유사한 효과를 발생시킨다는 점에 유의한다.데이븐포트 다이어그램에서 알 수 있듯이, 높은 P를CO2 초래하는 호흡 억제는 혈액의 pH를 낮출 것입니다.과호흡은 반대의 결과를 가져올 것이다.호흡저하로 인한 혈중 pH의 저하를 호흡산증이라고 한다.과호흡으로 인한 혈중 pH의 증가를 호흡기 알칼리증이라고 한다(그림 11).
대사 장애
혈액의 대사성분 변화도 혈액의 pH에 영향을 미칠 수 있다.다시 한 번, 혈액 샘플에 강한 산이나 강한 염기가 첨가되면 그에 따라 pH와 중탄산염 농도가 변화하여 적정 곡선이 생긴다는 것을 상기시켜 주십시오.예를 들어 수산화 이온은 용액에 첨가될 때 유리 수소 이온과 반응하여 용액의 pH를 증가시킵니다.또한 수산화 이온은 용액 중의 탄산으로부터 양성자를 추출하여 중탄산염 농도를 증가시킨다.수산화 이온을 추가한 후 다이어그램에서 새로운 위치는 더 이상 원래 버퍼 라인에 있지 않습니다.그러나 용액에 강산이나 강염기를 더 첨가하지 않고 P를CO2 변화시키면 상기 원래 완충선과 거의 평행한 새로운 완충선을 결정할 수 있다.
마찬가지로, 생체와 같은 생리 시스템에서, 예를 들어 위의 산성 성분을 토해냄으로써 양성자를 제거하면 pH가 증가하고 중탄산염 농도가 증가하여 시스템이 새롭고 더 높은 완충선에 도달하게 됩니다.이러한 장애를 대사성 알칼로시스라고 한다(그림 12).또는 당뇨병 케토산증 때 발생하는 것처럼 양성자가 산성 대사물의 형태로 혈류에 첨가되면 중탄산염 농도와 함께 pH가 떨어집니다.이런 종류의 장애를 대사성 산증이라고 한다.대사성 산증의 경우, 새로운 완충선은 원래 라인보다 아래에 있습니다.
레퍼런스
- ^ Grogono, Alan (1 April 2019). "Acid–Base Reports Need a Text Explanation". Anesthesiology. 130 (4): 668–669. doi:10.1097/ALN.0000000000002628. Retrieved 1 April 2019.
- ^ Grogono, Alan (1 January 2021). "Correcting Acid Base Interpretation for High Altitudes". Anesthesiology. 134 (1): 133–135. doi:10.1097/ALN.0000000000003581. Retrieved 1 January 2021.
- Davenport, Horace W. (1974). The ABC of Acid-Base Chemistry: The Elements of Physiological Blood-Gas Chemistry for Medical Students and Physicians (Sixth ed.). Chicago: The University of Chicago Press.
- 보론, 월터 F.와 불프, 에밀 L.(2003)의료용 생리학: 세포 및 분자적 접근법.필라델피아: 손더스.