캐스케이드 반응
Cascade reaction
도미노 반응 또는 탠덤 반응이라고도 알려진 계단식 반응은 최소한 두 개의 연속적인 반응으로 구성되는 화학적 과정으로, 각각의 후속 반응은 이전 단계에서 형성된 화학적 기능성 때문에만 발생한다.[1]계단식 반응에서는 순서를 구성하는 각 반응이 자연적으로 발생하므로 중간체의 격리가 필요하지 않다.용어의 가장 엄격한 정의에서, 연속적인 계단 사이에서 반응 조건은 변하지 않으며, 초기 단계 이후에 새로운 시약이 첨가되지 않는다.[1][2]이와는 대조적으로, 1-pot 시술은 유사하게 중간체의 격리 없이 최소 2개의 반응을 연속적으로 수행하도록 허용하지만, 새로운 시약의 추가나 첫 번째 반응 후의 조건의 변경을 배제하지는 않는다.따라서 어떤 계단식 반응도 1단계의 절차인 반면, 그 반대의 경우는 사실이 아니다.[1]종종 분자 내 변형만으로 구성되지만, 계단식 반응도 분자간에서 발생할 수 있으며, 이 경우 다분자 반응의 범주에 속하기도 한다.[3]
계단식 배열의 주요 이점은 높은 원자 경제성과 여러 화학적 과정에 의해 생성되는 폐기물의 감소, 그리고 그것들을 수행하는 데 필요한 시간과 작업이다.[1][3][4]계단식 반응의 효율성과 효용성은 전체 순서에서 형성된 결합의 수, 공정을 통한 구조적 복잡성의 증가 정도, 그리고 더 넓은 등급의 기판에 대한 적용성의 측면에서 측정할 수 있다.[2][5]
캐스케이드 반응의 가장 초기 예는 1917년 로빈슨에 의해 보고된 트로피논의 합성이다.[6]그 이후로 총합성 영역에서 계단식 반응의 사용이 급증했다.마찬가지로 캐스케이드 방식의 유기적 방법론의 개발도 엄청나게 성장했다.이러한 계단식 배열의 증가된 관심은 지난 몇 십 년 동안 발표된 수많은 관련 검토 기사에 반영되어 있다.[1][2][3][4][5][7][8][9][10]초점 영역은 키랄 유기촉매 또는 키랄 전이금속 복합체를 채택하여 계단식 공정의 비대칭 촉매 개발이다.[3][7][10][11]
계단식 반응의 분류는 변환의 여러 단계의 다양한 특성 때문에 때때로 어렵다.K. C. 니콜라우는 관련 단계의 메커니즘에 기초하여 계단식 별표를 핵포함성/전기영양성, 급진성, 순환성 순환성 또는 전이금속 분석성이라고 표시한다.두 종류 이상의 반응이 폭포 속에 포함되는 경우, 그 구별은 다소 자의적이 되고, 그 과정은 논쟁의 여지가 있을 정도로 "주요 주제"[4]라고 여겨질 수 있는 것에 따라 라벨이 붙는다.캐스케이드 반응의 놀라운 합성 효용성을 강조하기 위해, 아래의 사례의 대부분은 복잡한 분자의 총합성으로부터 나온다.
핵우편성/전기성 폭포
핵포함/전기포함 폭포는 키 스텝이 핵포함 또는 전기포함 공격을 구성하는 계단식 배열로 정의된다.[4]
그러한 캐스케이드의 예는 광폭 항생제의 짧은 항정신제 종합에서 볼 수 있다(--클로로암페니콜, Rao 등(Scheme 1) 보고).[3][12]여기서, 치랄 에폭시알콜 1은 NaH가 있는 곳에서 먼저 디클로로아세토나이트릴로 처리되었다.그 결과 중간 2는 BF3·EtO2 매개 계단식 반응을 보였다.에폭시드 링의 분자 내 개구부는 중간 3을 산출했는데, 이는 과도한 BF3·ETO에2 의해 수력분해가 촉진된 상황에서 전체 수율 71%에서 (–-클로로암페니콜(4)을 공급했다.[3][12]
또한 천연물 페탈렌의 총합성(Scheme 2)에도 핵포질 캐스케이드가 사용되었다.[4][13]이 절차에서 과립 에스테르 5는 (5-메틸사이클로펜트-1-en-1-yl)리튬과 프로필릴리튬으로 처리되었다.두 개의 핵포함 공격은 주로 중간 6을 위한 트랜스 추가로 발생했으며, 이는 자연적으로 사이클로부텐 링의 4㎛-컨트롤 전기 순환 개방을 거쳤다.결과적으로 변형된 종 7은 컨포머 8에 맞춰 평형을 이루었고, 이 종은 매우 경직된 중간 9에 대해 8˚의 전기 사이클링을 더 쉽게 받았다.종 10과 같은 9개의 변형 유도 양성자를 방출할 수 있는 잠재력을 선택적으로 얻었다.캐스케이드는 전체 수율 76%에 11개 제품을 공급한 분자 내 알돌 응결로 완성됐다.더 정교하게 목표치를 달성했다(±-펜탈렌(12)).[4][13]
유기체 분석성 폭포
핵분열/전자분열 시퀀스의 하위 범주는 키 핵분열 공격이 유기분석에 의해 구동되는 유기 분석적 계단식으로 구성된다.
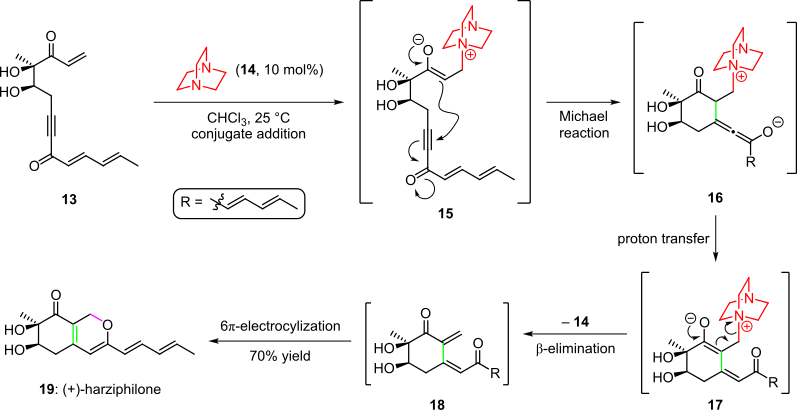
2004년 소렌센 외 연구진(Scheme 3)이 보고한 천연물 하르시필론 합성에 유기농 캐스케이드가 채용되었다.[4][14]여기서, 유기 촉매 14를 사용한 에논 시동 물질 13의 처리로, 중간 15를 결합 첨가를 통해 산출했다.이후 계통의 3중 결합에 에놀레이트를 첨가한 근육내 Michael에 의한 사이클링은 16종을 주었고, 16종은 양성자 전이 및 tautomerization 후 중간 17종을 공급했다.캐스케이드는 전체 수율 70%에서 유기 촉매 제거와 결과물인 시스 디에논 18 ~ (+---하르히필론(19)의 자발적 6elect 전기 순환 고리 폐쇄로 완성되었다.[4][14]
Raabe 외 연구진은 2006년에 뛰어난 삼중 유기물 분석성 폭포를 보고하였다.선형 알데하이드(20), 니트로알카네(21) 및 α,β-불포화 알데하이드(22)를 유기산학적으로 응축하여 중간에서 탁월한 이질회수성을 가진 테트라 대체 시클로헥산 카르발데하이드(24)와 완전한 엔노콘트롤(Scheme 4)을 제공할 수 있다.변환은 쉽게 구할 수 있는 친선 유도 장기 촉매 23에 의해 매개된다.[15]
변환은 Michael 추가/Michael 추가/aldol 결로 시퀀스(Scheme 5)를 통해 진행되도록 제안되었다.[15]첫 번째 단계에서는 알데히드 20을 니트로알카인 21에 첨가한 마이클이 에나민 카탈루션을 통해 발생하며 니트로알카인 25를 산출한다.유기촉매와 함께 α,β-불포화 알데히드 22의 응축은 25의 결합 첨가를 촉진하여 중간 에나민 26을 주는데, 이 에나민은 이미늄 종 27에 대해 분자 내 알돌 응결을 겪기 쉽다.유기촉매 23은 제품 24와 함께 가수분해로 재생되어 삼중 계단식 사이클을 마감한다.[15]
래디컬 캐스케이드
급진적 폭포는 핵심 단계가 급진적 반응을 구성하는 폭포다.자유 급진 종들의 높은 반응성은 계단식 반응에 확실히 적합한 급진적 기반 합성 접근법을 만들어낸다.[4]
급진적 폭포의 합성 효용성에 대해 가장 널리 알려진 예 중 하나는 (±-hirsutene), 1985년 (Scheme 6)의 총합성에 채택된 사이클화 시퀀스다.[4][16]여기서, 알킬 요오드화 28은 1차적 급진적 중간 29로 전환되었고, 이 중 5-exo-트리거 사이클링을 거쳐 반응성 종 30을 공급했다.이후 5 exo-dig의 급진적 사이클화는 중간 31로 이어지며, 이는 급랭과 동시에 목표치(±-hirsutene(32)를 전체 수율 80%로 부여했다.[4][16]
계단식 급진적 공정도 (–--morphine (Scheme 7)의 총합물 중 하나에 사용되었다.[4][17][18]아릴브로마이드 33은 트라이앤부틸틴 하이드라이드 처리로 해당 급진종 34로 전환됐다.그 후 에테르 연결의 입체화학성 덕택에 5 엑소 트리거 사이클화가 일어나 중간 35를 입체적으로 주었다.폭포의 다음 단계에서, 35의 기하학적 제약은 운동적으로 선호하는 5-엑소-트리거 사이클 경로를 금지한다. 대신 2차 벤질릭 급진 종 36은 기하학적으로 허용되는 6-엔도-트리거 사이클링을 통해 얻어졌다.이후 페닐 황비닐 라디칼을 제거한 결과 전체 수율 30%에서 37개 제품이 생산되었으며, 이는 (--모핀(38)에 더 자세히 설명되었다.[4][17][18]
순환 계단식 계단식
아마도 계단식 변환에서 가장 광범위하게 부딪히는 종류의 과정일 수 있는데, 주기적 반응은 사이클로어더화, 전기순환 반응, 그리고 기호성 재배열을 포함한다.[4]위에서 언급한 핵동성/전기생성 및 급진적 계단식 사례 중 일부는 순환 과정과 관련이 있지만, 이 절에는 오직 순환 과정으로 구성되거나 그러한 반응이 거의 틀림없이 핵심 단계를 구성하는 계단식 시퀀스만 포함되어 있다.
순환식 폭포의 대표적인 예가 1982년 니콜라우 외 연구진(Scheme 8)이 보고한 내분산 폭포다.[4][19]여기에서 고도로 불포화된 39계통은 처음에는 결합 테트라인 40종에 수소가화되었고, 가열 후 8㎛의 회전 전기 순환 고리 폐쇄를 거치면서 순환 중간 41이 생성되었다.두 번째 자발적 전기 자전거화, 이번에는 6˚ 변성 고리 폐쇄로 41개가 자전거 종 42로 변환되었는데, 그 기하학과 입체화학은 이후의 분자 내 디엘-알데르 반응을 선호했다.따라서 내분산 B(43)의 메틸에스테르를 전체 수율 23%에서 얻었다.[4][19]
자연적으로 발생하는 알칼로이드(----빈도로신(----빈도로신)의 총합성에 근육 내 이질-사이클로 추가 반응을 포함하는 순환 시퀀스를 채택했다.[4][20]높은 온도와 압력 감소에 따른 삼이소프로필 벤젠의 1,3,4-oxadiazole 44 용액에서 대상에 대한 신속한 접근이 이루어졌다.먼저 반전기 수요 이질-다이얼-알데르 반응이 일어나 중간 45를 주었다.열역학적으로 유리한 질소 손실은 1,3-디폴 함유 종 46을 생성했다.1,3-디폴과 인도레 시스템의 자발적 근육 내[3+2] 사이클 추가는 전체 수율 78%에서 내분 제품 47을 형성했다.더욱 정교하게 연구한 결과 목표 천연제품은 48개였다.[4][20]
해로벤 그룹이 2005년에 보고한 (–-colombiasin A)의 총합성에는 전기 순환 계단식 계단식(Scheme 10)이 포함되었다.[4][21]극초단파 조사를 통해 열을 받을 때, 편평한 파생 모델 49는 사이클로부텐 링의 전기적 개방 과정을 거쳤으며, 이어 자전거 중간 51을 생성하는 6˚ 전기 순환 링 폐쇄를 거쳤다.그 토토머라이징은 방향족 52종을 주었고, 방향족은 공기에 노출되자마자 전체 수확량 80%에서 제품 53으로 산화되었다.그런 다음 대상(---colombiasin A(54)은 열방사성 Diels-Alder 반응을 거쳐 테르트-부틸 보호 그룹의 분할을 통해 53년부터 획득되었다.[4][21]
1981년 Hopf 그룹에 의해 보고된 바와 같이 특정 [2,2]패러시클로판도 주기적 계단진행을 통해 얻을 수 있다(Scheme 11).[1][22]이 순서에서 1,2,4,5헥사테트라엔 55와 디에노필 56 사이의 디엘-알데르 반응은 처음에는 매우 반응성이 높은 중간 57을 형성했고, 그 후에는 감광하여 [2,]파라시클로판 58을 산출했다.[1][22]
전이 금속 촉매 캐스케이드
전이-금속-캐스케이드 시퀀스는 유기물 화학의 신기함과 파워를 합성 효용과 캐스케이드 반응의 경제성과 결합하여 유기물 합성에 더욱 생태학적으로 그리고 경제적으로 바람직한 접근법을 제공한다.[4]
예를 들어, 로듐 카탈루션은 59형식의 아큐리틱 단색체를 하이드로폼화 캐스케이드(Scheme 12)에서 4H-크롬 제품을 4H-크롬으로 변환하는 데 사용되었다.[8][23]첫째, 59년 덜 강직적으로 방해를 받는 올레핀 결합의 선택적 로듐-분석 하이드로폼화는 불포화 알데히드 60을 산출했고, 같은 조건에서 카르보닐-엔 반응을 통해 중간 61로 전환되었다.종 62에 대한 두 번째 로듐 촉매 하이드로폼화는 응결이 뒤따른 후 63형식의 4H크롬 제품을 전체 수율 40%로 형성했다.[8][23]
다우벤 그룹(Scheme 13)이 보고한 티글리안의 합성에서 사이클링/사이클링 추가 캐스케이드를 개시하기 위해 로듐 촉매도 채용되었다.[2][24]로듐을 사용한 디아조이미드 64의 처리(II) 아세테이트 다이머는 인접한 카보닐 그룹과의 분자 내 사이클링 후 반응성 일라이드 65를 생성하는 카보노이드 생성.그 후 자연발생적으로 대상 티글리안 66을 감당할 수 있는 근육내[3+2] 사이클로 추가가 발생했다.[2][24]
금 강직으로 매개된 67형식 중 1,6-ennes 1,6-ennes의 공식 근육내[4+2] 사이클로 추가는 전이금속 촉매 캐스케이드(Scheme 14)의 또 다른 예다.[25][26]다양한 1,6-ennes가 68a–b 복합체가 있는 곳에서 온화한 조건에서 반응하여 중간에서 우수한 수율에서 세발순환 제품 69를 생산했다.[25][26]
이 공식 사이클로 추가는 계획 15에 제시된 계단식 과정을 통해 진행되도록 제안되었다.[25][26]촉매의 양이온 형태를 가진 1,6-에닌 67의 복잡성은 중간 70을 산출하는데, 이 경우 활성 삼중 결합이 올레핀 기능에 의해 공격되어 대체 사이클로프로판 71을 산출한다.세 개의 엠블러드 링의 전기적 개방은 계양 72종을 형성하는데, 이 종은 프리델-크래프트 형태의 반응을 거친 후 다시 역모화하여 세발순환 제품 69를 준다.[25][26]금단지와 불포화계통의 상호 작용의 특성 때문에, 이 과정은 전기적 폭포화계통으로도 간주될 수 있었다.
팔라듐 촉매의 예로는 3플레이트 기질 75(Scheme 16)에서 (+-xestokinone)를 제조할 때 사용되는 비대칭 폴리에네 헥 사이클화로 표현된다.[4][27]아릴-트리플레이트 결합을 치랄 디프인산인산 리간드(S)-비납이 존재하는 팔라듐(0) 복합체에 산화 첨가하면 치랄 팔라듐이 생성된다.II) 복합 77.이 단계는 트리플플레이트 음이온의 분리, 이웃한 올레핀의 연결, 그리고 중간 79를 산출하기 위해 나프틸 그룹을 올레핀에 1,2-삽입하는 것이다.나머지 올레핀 그룹에 두 번째 철새 삽입 후 β-제거가 발생하여 전체 수율 82%의 81 제품을 공급할 수 있으며 적당한 항저항성을 갖는다.팔라듐(0) 촉매도 이 단계에서 재생되기 때문에 계단식 재생을 허용한다.[4][27]
다단계 탠덤 반응
다단계 탠덤 반응(또는 계단식 반응)[28]은 일련의 화학적 변환(보통 두 단계 이상)으로 연속적으로 발생하여 시동 물질을 복잡한 제품으로 변환한다.이러한 종류의 유기 반응은 천연물 총합성에서 마주치는 어려운 구조를 구성하기 위해 고안된 것이다.
스피로케탈 이오노포레 항생제 루티엔노신 1의 총합에서 중심 스피로케탈 골격은 다단계 탠덤 반응에 의해 생성되었다(그림 2).[29]A 파편과 B 파편이 한 번에 결합해 최종 제품인 루티엔노신을 감당할 수 있도록 더욱 정교하게 다듬을 수 있는 핵심 중간 G를 형성했다.
네 가지 화학적 변화가 이 탠덤 반응에서 일어났다.첫째, A 파편을 n-부틸리튬으로 처리하면 탄소 음이온이 형성되어 B 파편의 알킬리오다이드 부분을 공격하여 중간 C(1단계)를 발생시킨다.그 후 중간 C(2단계)에 대한 기저 매개 제거 반응을 통해 3, 4-디드롭디란 파생상품 D가 형성되었다.중간 D에서 1, 3-diol moiety의 보호 그룹은 diol 제품 E(3단계)를 주기 위해 산성 처리로 제거되었다.척추측만증 제품 G는 분자내 케탈 형성 반응을 통해 생성되었다.이 다단계 탠덤 반응은 이 복잡한 스피로케탈 구조의 건설을 크게 단순화시켰고 루티엔노신의 총합성을 향한 경로를 완화시켰다.
참조
- ^ a b c d e f g h 티에체, L. F., 베이퍼스, U. 안젤로 화학. 인트. 1993년, 32년, 131-163년.
- ^ a b c d e f 파드와, A.; 버, S. K. 테트라헤드론 2007, 63, 5341–5378.
- ^ a b c d e f g 펠리셰르, H. 테트라헤드론 2006, 62, 1619–1665.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae 니콜라우, K. C.; 에드몬드, D. J.; 불거, P. G. 안젤로. 화학. 인트. 2006년 12월 45일 7134–7186.
- ^ a b 티에체, L.F.1996년 개정판, 96년, 115–136년.
- ^ 로빈슨, R. J. Chem. Soc. Trans. 1917, 111, 762.
- ^ a b 펠리셰르, H. 테트라헤드론 2006, 62, 2143–2173.
- ^ a b c d 와실크, J. C.; 오브리, S. J.; 베이커, R. T.; 바잔, G. C.2005년 개정판, 105년, 1001년–1020.
- ^ 채프먼, C.; 프로스트, C.합성(Stutg).2007, 2007, 1–21.
- ^ a b 엔더스, D.; 그론달, C.; 휴틀, M. R. M. 안젤. 화학. 인트. 2007년 1월 46일 1570–1581.
- ^ Grondal, C., Jeanant, M., Enders, D. Nat. 2010년, 2, 167–178.
- ^ a b 바스카르, 사티쉬 쿠마르, 브이, 벤카테츠와라오, B.사면체: 비대칭 2004, 15, 1279–1283.
- ^ a b 파켓, 엘에이, 젠그, 에프오르그 2002년 4월 4547-4549년
- ^ a b 스타크, L.M.; 페카리, K.; 소렌센, E. J. Proc. 나틀. 아카드. Sci. U.S. A. 2004, 101, 12064–12066.
- ^ a b c d e 엔더스, D., Hüttl, M. R. M. G. G. Nature 2006, 441, 861–863.
- ^ a b Curran, D. P.; Chen, M.H.테트라헤드론 레트, 1985, 26, 4991–4994.
- ^ a b 파커, K. A.; 포카스, D. J. Am. 1992년 Soc. 114, 9688–9689.
- ^ a b 파커, K. A.; 포카스, D. J. Org. 2006년 71, 449–455.
- ^ a b 니콜라우, K. C.; 페타시스, Zipkin, R. E.; 우에니시, J. Am. Chem. Soc. 1982, 104, 5555–5557.
- ^ a b 엘리엇, G. I.; 벨시키, J.; 이시카와, H. 리, Y.; 보거, D. L. 안젤. 화학. 인트. 2006년 에드, 45, 620–622.
- ^ a b 해로벤, D. C.; 파스코, D. D.D., 데무르타스; 본, H. O. 안젤로. 화학. 인트.2005년 12월 44일 1221–1222.
- ^ a b H.H.; Bohm, I.; Kleinschroth, J. Org. 1981년, 60년, 41년.
- ^ a b 로겐벅, R.; 에일브라흐트, P.테트라헤드론 레트 1999, 40, 7455–7456.
- ^ a b Dauben, W. G.; Dinges, J.; Smith, T. C. J. Org. 1993, 58, 7635–7637.
- ^ a b c d e f 지메네스 누녜스, 에차바르렌, 에이엠 화학 2008년 108년 3326년 개정판
- ^ a b c d 니에토 오버후버, C.; 로페스, S.; 에차바르렌, A. M. J. Am. 화학. Soc. 2005, 127, 6178–6179.
- ^ a b 매드포드, 앤더슨, 크리스토폴리, 키이, B. A. J. Am. Chem. Soc. 1996, 118, 10766–10773.
- ^ 니콜라우, K. C.; 에드몬드, 데이비드 J.; 벌거, 폴 G.안젤라, 화학.2006년 12월 45일 7134-7186
- ^ 디즈마틴, D. 코테차, N. R.;Ley, S. V.; Mantegani, S.; Menendez, J. C.; Organ, H. M.; White, A. D., Tetrahedron, 1992, 48, 1899-7938.
외부 링크
| Wikiquote는 다음과 관련된 인용구를 가지고 있다: 캐스케이드 반응 |









![Scheme 11. Pericyclic sequence for the synthesis of [2,2]paracyclophanes](http://upload.wikimedia.org/wikipedia/commons/thumb/b/be/Scheme_11_-_peri_-_pcyclophane.svg/681px-Scheme_11_-_peri_-_pcyclophane.svg.png)


![Scheme 14. Gold-catalyzed formal intramolecular [4+2] cycloaddition of 1,6-enynes](http://upload.wikimedia.org/wikipedia/commons/thumb/2/2b/Scheme_14_-_metal_-_gold_enyne.svg/481px-Scheme_14_-_metal_-_gold_enyne.svg.png)
![Scheme 15. Proposed cascade process in the formal intramolecular [4+2] cycloaddition of 1,6-enynes](http://upload.wikimedia.org/wikipedia/commons/thumb/b/ba/Scheme_15_-_metal_-_gold_enyne_mech.svg/751px-Scheme_15_-_metal_-_gold_enyne_mech.svg.png)