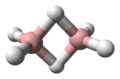보라네
Boranes
보란스는 BHxy 공식과 관련 음이온을 가진 화합물에 붙여진 이름이다. 그러한 붕소들은 많이 알려져 있다. 가장 흔한 것은 1에서 12개의 붕소 원자를 가진 것이다. 실제 적용은 거의 없지만, 붕소는 탄화수소에서 볼 수 있는 패턴과 강하게 다른 구조와 결합을 나타낸다. 붕소와 탄화수소의 하이브리드 자동차도 잘 발달되어 있다.[1]
역사
붕소 화학의 발달은 구조와 결합뿐만 아니라 합성 방법의 혁신으로 이어졌다. 첫째, 디보레인 및 그것의 많은 파생상품들을 다루기 위해 새로운 합성기술이 필요했는데, 그것은 모두 화포성이며 휘발성이 있다. 알프레드 스톡은 이러한 목적을 위해 유리 진공 라인을 발명했다.[2]
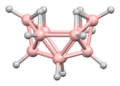
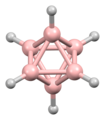
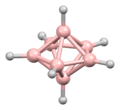
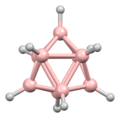
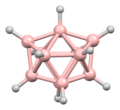
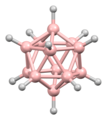
디보레인의 구조는 발견된 지 여러 해 후인 1943년에 정확하게 예측되었다.[3] 붕소 하이드라이드 성단의 구조는 1948년부터 데카보레인의 특성화에 따라 결정되었다. William Lipscomb는 1976년에 이것과 많은 후속 결정학적 조사로 노벨 화학상을 받았다. 이러한 조사는 삼각형 구조, 즉 BH 센터들의 삼각형 배열 네트워크들의 전범성을 밝혀냈다.
성단의 결합은 다면체 골격 전자쌍 이론과 붕소의 구조를 예측하는 데 사용될 수 있는 Wade의 법칙으로 이어졌다.[4] 이 규칙들은 많은 성단 화합물의 구조를 설명하기 위해 발견되었다.
붕소에 대한 관심은 제2차 세계 대전 동안 우라늄 동위원소 농축을 위한 우라늄 보로하이드와 풍선 부풀리기의 수소 공급원으로서 증가하였다. 미국에서는 슐레신저가 이끄는 팀이 음이온 보론 하이드라이드와 관련 알루미늄 하이드라이드의 기본 화학물질을 개발했다. 슐레신저의 연구는 유기합성을 위한 많은 붕소 하이드라이드 시약들을 위한 기초를 마련했는데, 대부분은 그의 제자 허버트 C에 의해 개발되었다. 갈색. 보라색을 기반으로 한 시약은 현재 유기합성에 널리 사용되고 있다. 브라운은 이 작품으로 1979년 노벨 화학상을 받았다.[5]
화학 공식 및 명명 규칙
붕소 군집은 다음과 같이 분류된다. 여기서 n은 단일 군집 내 붕소 원자의 수입니다.[1][6][7]
| 클러스터형 | 화학식 | 예 | 메모들 |
|---|---|---|---|
| 하이퍼클로소- | BnHn | 불안정한 상태, 파생상품이 알려져[8] 있음 | |
| 폐점하다 | BnHn2− | 세슘 도데카보 | |
| 니도- | BnHn+4 | 펜타보레인(9) | |
| 아라크노- | BnHn+6 | 펜타보레인(11) | |
| 히포- | BnHn+8 | 인덕트에서만 찾을 수 있음 |
체계적 명칭을 위한 국제순수화학연합(Union of Pure and Applied Chemistry) 규칙은 복합체의 한 부류를 나타내는 접두사에 기초하고 있으며, 그 뒤에 붕소 원자의 수와 마지막으로 괄호 안에 있는 수소 원자의 수가 있다. 의미에 대한 모호성이 없는 경우, 예를 들어 하나의 구조형식만 가능한 경우 등 다양한 세부사항을 생략할 수 있다. 구조물의 몇 가지 예는 다음과 같다.
보라네
BH3디보레인(6)
B2H6아라크노테트라보레인(10)
B4H10펜타보레인(9)
B5H9데카보레인(14)
B10H14
도데카보(12)
B12H122−
음이온의 명칭은 다음과 같다.
- 팔하수도펜타보, BH58−
수소 카운트는 먼저 붕소 카운트 다음에 지정된다. -ate 접미사에는 음이온이 적용된다. 이온 전하 값은 화학 공식에 포함되지만 체계적 이름의 일부로 포함되지는 않는다.
붕소 내 본딩
붕소는 비분류적으로 결합되는 화합물이다. 즉, 분자 내 모든 인접 원자 쌍들 간에 2-센트, 2-전자 결합을 형성하기에 충분한 전자가 없다. 더 큰 붕소에서의 결합에 대한 설명은 윌리엄 립스콤에 의해 공식화되었다. 여기에는 다음이 포함되었다.
- 3-중앙 2-전자 B-H-B 수소교량
- 3-중앙 2-전자 B-B-B 결합
- 2-중앙 2 전자 본드(B-B, B-H 및 BH2 단위)
립스콤의 방법론은 대체로 분자 궤도 접근법으로 대체되었다. 이를 통해 다중 중심 결합의 개념을 확장할 수 있다. 예를 들어, 이코사헤드 이온[BH1212]2-에서 완전 대칭(Ag 대칭) 분자 궤도(A 대칭)는 모든 12개 붕소 원자 사이에 균등하게 분포한다. Wade의 규칙은 원자의 수와 그 사이의 연결성 측면에서 구조를 합리화하는 데 사용될 수 있는 강력한 방법을 제공한다.
멀티클러스터 붕소

비교적 드물기는 하지만 여러 개의 멀티클러스터 붕소가 특징지어졌다. 예를 들어 BH26(BH의3 원천)를 가진 붕소 군집의 반응은 붕소 원자의 공유에 의해 붕소 군집 서브 유니트가 결합되는 결막보란 종을 형성할 수 있다.[10]
- B6H10 + (BH3) → B7H11 + H2
- B7H11 + B6H10 → B13H19 + H2
서브 유니트가 B-B 결합으로 결합되는 다른 결합기들은 니도-보레에 대한 초보라색 조사에 의해 만들어질 수 있다. 일부 B-B 커플링 결막은 PtBr을2 촉매로 사용하여 생산될 수 있다.[11]
Wade의 규칙과 유사하게, 전자 계수 체계는 멀티클러스터 붕소를 예측하거나 합리화하기 위해 개발되었다.
| 접두사 | 의미 | 예 |
|---|---|---|
| 클라도- | 가지를 뻗은 군집. | |
| 결막의 | 결합한 군집. | |
| 메갈로의 | 여러 개의 결합 성단 |
붕소 반응도
가장 낮은 보란, BH는3 일시적으로만 존재하며, 즉시 희미해져 디보레인26, BH를 형성한다. 그것의 인덕트는 BH3·이다.THF와 BH3·DMSO는 하이드로보관 반응에 사용하기에 충분히 안정적이다. 디보레인의 행동을 연상시키는 일부 하부 보레인은 매우 흥분적으로 심지어 폭발적으로 공기와 반응한다. 이와는 대조적으로, BH와12122− 같은 많은 폐쇄-보레인 클러스터는 공기와 반응하지 않는다.
붕소 하이드라이드 클러스터는 매우 다양해서 그들의 반응에 대한 일반화는 불가능하다.
루이스 산/베이스 동작
어떤 것은terminal B-H 그룹의 상대적인 기본 특성 때문에 전자 기증자로서의 기능을 한다. 붕소는 조정 화합물에서 리간드로 기능할 수 있다.[13] H 원자를 연결하거나 B-B 채권의 기증을 수반하는 전자 기증을 통해 η에서16 to까지의 촉감이 발견되었다. 예를 들어, 니도-BH는610 Zeise의 소금에 있는 ethene을 대체하여 Fe(η-BH2610)(CO)를 생산할 수 있다.4
그들은 또한 루이스 산으로 활동할 수 있으며, 그에 따라 성단이 개방된다. 트리메틸인산염과 관련된 예:
- BH59 + 2PMe3 → BH59(PMe3)2
브뢰네스트 산/베이스 거동
일부 더 높은 붕소들, 특히 수소 원자를 결합한 붕소들은 강한 베이스로 감압될 수 있다. 예:
- B5H9 + NaH → Na(B5H8) + H2
산성은 붕소의 크기에 따라 증가한다.[14] BH의1014 pK 값은 2.7이다.[15]
- BH59 < BH610 < BH1014 < BH1620 > BH < BH1822 >
아우프바우 반응
붕소 하이드라이드 화학자의 경우, 가장 중요한 반응 중 하나는 작은 붕소 하이드라이드 성단이 붕소를 추가하여 더 큰 성단을 만드는 과정이다.
하이드로보레이션
디보레인과 그 아덕트를 연상시키는 더 높은 보레인이 수력보조에 참여한다. 붕소 하이드라이드가 알키네를 추가하면 탄소가 집단에 통합되어 카보레인이 생성된다(예: CBH21012).[16]
적용들
디보레인 및 그 단층 유도체 보란-테트라하이드로푸란 또는 보란-디메틸설황화물은 유용한 시약이다. 그것들은 유기합성에 있어서 수력 증식에 종종 사용된다. 더 높은 붕소 하이드라이드 클러스터는 많은 응용 프로그램이나 어떤 응용 프로그램도 만들어내지 못했다. 카보레기의 일부 코발트 파생상품은 Cs를 방사성폐기물로부터 격리시키기 위해 상용화되었다.[17]
흡인 사용
붕소 하이드라이드 클러스터는 중성자를 쉽게 흡수하기 때문에 암의 중성자 포획 요법에서 그 유도체를 종종 연구해 왔다.[18] 선호되는 화합물 중 하나는 Na2[BH1211(SH)]이다. 그것은 B가 매우 높은 중성자 포획 단면을 가지고 있기 때문에 중성자 조사는 화합물이 있는 지역에 대해 매우 선택적이다.
- 10B + 1n → (11B*) → 4He + 7Li + γ (2.4 Mev)
붕소는 탄화수소에 비해 연소 에너지가 높아 연료로서 잠재적으로 매력적이다. 1950년대에 제트연료 첨가제로 사용하기 위해 강도 높은 연구가 진행되었지만, 그 노력이 실질적인 결과로 이어지지는 않았다.
참고 항목
참조
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8. 151-1950 페이지
- ^ Stock, Alfred (1933). The Hydrides of Boron and Silicon. New York: Cornell University Press.
- ^ Longuet-Higgins, H. C.; Bell, R. P. (1943). "64. The Structure of the Boron Hydrides". Journal of the Chemical Society (Resumed). 1943: 250–255. doi:10.1039/JR9430000250.
- ^ Fox, Mark A.; Wade, Ken (2003). "Evolving patterns in boron cluster chemistry" (PDF). Pure Appl. Chem. 75 (9): 1315–1323. doi:10.1351/pac200375091315. S2CID 98202127.
- ^ Boranes John Wiley & Sons, Inc.를 경유하는 Brown, H. C. Organic Synthes. 뉴욕: 1975. ISBN 0-471-11280-1.
- ^ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6th ed.), New York: Wiley-Interscience, ISBN 0-471-19957-5
- ^ 립스콤 W. N. 보론 하이드리데스. 벤자민, 뉴욕 (1963년).
- ^ Peymann, Toralf; Knobler, Carolyn B.; Khan, Saeed I.; Hawthorne, M. Frederick (2001). "Dodeca(benzyloxy)dodecaborane, B12(OCH2Ph)12: A Stable Derivative of hypercloso-B12H12". Angew. Chem. Int. Ed. 40 (9): 1664–1667. doi:10.1002/1521-3773(20010504)40:9<1664::AID-ANIE16640>3.0.CO;2-O.
- ^ Londesborough, Michael G. S.; Bould, Jonathan; Baše, Tomáš; Hnyk, Drahomír; Bakardjiev, Mario; Holub, Josef; Císařová, Ivana; Kennedy, John D. (2010). "An Experimental Solution to the "Missing Hydrogens" Question Surrounding the Macropolyhedral 19-Vertex Boron Hydride Monoanion [B19H22]−, a Simplification of its Synthesis, and its Use as an Intermediate in the First Example of syn-B18H22 to anti-B18H22 Isomer Conversion". Inorganic Chemistry. 49 (9): 4092–4098. doi:10.1021/ic901976y. PMID 20349936.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8. 페이지 162
- ^ Sneddon, L.G. (2009). "Transition metal promoted reactions of polyhedral boranes and carboranes". Pure and Applied Chemistry. 59 (7): 837–846. doi:10.1351/pac198759070837. S2CID 55817512.
- ^ Bould, Jonathan; Clegg, William; Teat, Simon J.; Barton, Lawrence; Rath, Nigam P.; Thornton-Pett, Mark; Kennedy, John D. (1999). "An approach to megalo-boranes. Mixed and multiple cluster fusions involving iridaborane and platinaborane cluster compounds. Crystal structure determinations by conventional and synchrotron methods". Inorganica Chimica Acta. 289 (1–2): 95–124. doi:10.1016/S0020-1693(99)00071-7.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.페이지 177, "보란드를 리간드로 하는 개념",
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8. 페이지 171
- ^ 미정온도
- ^ Jemmis, E. D. (1982). "Overlap control and stability of polyhedral molecules. Closo-Carboranes". Journal of the American Chemical Society. 104 (25): 7017–7020. doi:10.1021/ja00389a021.
- ^ Chaudhury, Sanhita; Bhattacharyya, Arunasis; Goswami, Asok (2014). "Electrodriven Selective Transport of Cs+ Using Chlorinated Cobalt Dicarbollide in Polymer Inclusion Membrane: A Novel Approach for Cesium Removal from Simulated Nuclear Waste Solution". Environmental Science & Technology. 48 (21): 12994–13000. Bibcode:2014EnST...4812994C. doi:10.1021/es503667j. PMID 25299942.
- ^ Sauerwein, Wolfgang; Wittig, Andrea; Moss, Raymond; Nakagawa, Yoshinobu (2012). Neutron Capture Therapy. Berlin: Springer. doi:10.1007/978-3-642-31334-9. ISBN 978-3-642-31333-2.