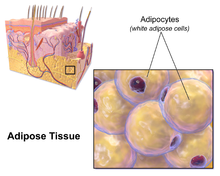
지방 조직
Adipose tissue| 지방 조직 | |
|---|---|
 지방조직은 결합조직의 주요 유형 중 하나이다. | |
 세 종류의 지방세포 형태학. | |
| 발음 | /ciscodpo/ ( |
| 식별자 | |
| 메쉬 | D000273 |
| FMA | 20110 |
| 해부학 용어 | |
지방 조직, 체지방 또는 단순 지방은 대부분 지방세포로 [1][2]구성된 느슨한 결합 조직이다.지방세포 외에 지방조직은 전지방세포, 섬유아세포, 혈관내피세포 및 지방조직 대식세포 등의 다양한 면역세포를 포함한 세포의 간질혈관분율(SVF)을 포함한다.지방조직은 전지방세포에서 유래한다.그것의 주된 역할은 에너지를 지질 형태로 저장하는 것이지만, 그것은 또한 몸을 완충시키고 단열시킨다.호르몬 불활성과는 거리가 멀지만, 지방 조직은 최근 몇 년 동안 주요 내분비 [3]기관으로 인식되어 왔다. 왜냐하면 그것은 렙틴, 에스트로겐, 레지스틴,[2] 그리고 사이토카인과 같은 호르몬을 생성하기 때문이다.비만에서 지방조직은 또한 대사증후군, 제2형 당뇨병, 심혈관 질환 및 아테롬성 동맥경화증을 [2][4]포함하지만 이에 한정되지 않는 일련의 질병의 발생을 일으키는 아디포킨으로 알려진 소염증 표지의 만성적인 방출에도 관여한다.두 종류의 지방조직은 에너지를 저장하는 백색지방조직과 체열을 발생시키는 갈색지방조직이다.지방조직의 형성은 부분적으로 지방유전자에 의해 조절되는 것으로 보인다.지방 조직, 특히 갈색 지방 조직은 1551년 [5]스위스 박물학자 콘라드 게스너에 의해 처음 확인되었습니다.
해부학적 특징
사람에게 지방 조직은 피부 아래, 내장 주변, 골수(황색 골수), 근육간(근육계), 유방(가슴 조직)에 위치한다.지방 조직은 특정 위치에서 발견되는데, 이것은 지방 디포라고 불린다.지방조직 내에서 세포의 가장 높은 비율을 구성하는 지방세포와는 별도로, 다른 유형의 세포들이 존재하며, 이를 총칭하여 세포의 간질혈관분율(SVF)이라고 한다.SVF는 전지방세포, 섬유아세포, 지방조직 대식세포 및 내피세포를 포함한다.
지방조직은 많은 작은 혈관을 포함하고 있다.피부를 포함한 피하층인 가장 깊은 곳에 축적되어 더위와 추위로부터 단열된다.장기 주변에는 보호 패딩을 제공합니다.그러나 탄수화물로부터 생성된 대부분의 지질 합성이 지방 조직 [6]자체에서 발생한다는 일부 증거가 있지만, 주요 기능은 몸의 에너지 요구를 충족시키기 위해 산화될 수 있고 간에서 생성된 트리글리세라이드를 당으로부터 저장함으로써 과도한 포도당으로부터 보호할 수 있는 지질 비축이다.몸의 다른 부분에 있는 지방 저장고는 다른 생화학적 프로파일을 가지고 있다.정상적인 조건에서, 그것은 배고픔과 식이요법에 대한 피드백을 뇌에 제공합니다.
마우스
쥐는 8개의 주요 지방 디포를 가지고 있으며, 그 중 4개는 복강 [1]안에 있다.한 쌍의 성선 디포는 여성의 경우 자궁과 난소에 부착되며, 남성의 경우 부고환과 고환에 부착됩니다. 한 쌍의 후복막 디포는 복부의 등쪽 벽을 따라 발견되며, 신장을 둘러싸고 있으며, 거대할 경우 골반으로 확장됩니다.장간막 창고는 장과 장내 창고를 지탱하는 접착제 같은 거미줄을 형성하고, 거대할 때는 복부까지 확장됩니다.장간막과 장내 디포는 각각 림프절과 유백색 반점으로 많은 림프조직을 통합한다.
두 개의 표면 디포는 뒷다리(피부 아래) 상부의 앞쪽에 있는 한 쌍의 사타구니 디포와 견갑골의 등쪽 볏 사이에서 발견되는 흰색 지방 조직 영역과 인접한 갈색 지방 조직의 한 쌍의 내측 혼합물이다.이 창고에 있는 갈색 지방 조직의 층은 종종 흰색 지방 조직의 "서리"로 덮여 있습니다; 때때로 이 두 종류의 지방은 구별하기 어렵습니다.사타구니 디포는 림프절의 사타구니 그룹을 둘러싸고 있다.작은 디포트는 심장을 둘러싸고 있는 심막과 무릎 뒤쪽의 주요 근육 사이에 있는 쌍으로 구성된 슬개골 디포를 포함하며, 각각은 하나의 큰 림프절을 [7]포함합니다.생쥐의 모든 디포 중에서 성선 디포는 가장 크고 가장 쉽게 [8]해부할 수 있으며,[9] 해부 가능한 지방의 약 30%를 포함한다.
비만
비만인 사람에게서 복부에서 아래로 늘어져 있는 여분의 지방 조직을 범니큘러스라고 한다.범니큘러스는 병적으로 비만인 사람의 수술을 복잡하게 만든다.심각한 비만인 사람이 많은 양의 지방을 잃으면 말 그대로 "피부의 사프론"으로 남을 수 있습니다.비만은 운동, 식이요법, 행동 요법을 통해 치료된다.재건수술은 [10]치료의 한 측면이다.
내장 지방
내장 지방 또는 복부[11] 지방은 복강 안에 위치하며, 기관(위, 간, 장, 신장 등) 사이에 채워져 있습니다.내장지방은 피부 밑의 피하지방이나 골격근에 삽입된 근육 내 지방과는 다르다.하체의 지방은 허벅지나 엉덩이와 마찬가지로 피하이며 일정한 간격의 조직이 아닌 반면, 복부의 지방은 대부분 내장이고 [12]반유체이다.내장지방은 장간막, 부고환백색아디포스조직(EWAT) 및 신장주위 디포를 포함한 몇 가지 지방 디포스로 구성되어 있다.내장지방은 종종 그 면적2(VFA, 내장지방)[13]으로 표현된다.
내장지방의 과잉은 복부비만, 즉 복부가 과도하게 튀어나오는 "복부지방"으로 알려져 있습니다.체적 지수(BVI)와 같은 새로운 개발은 복부 볼륨과 복부 지방을 측정하기 위해 특별히 고안되었습니다.과도한 내장 지방은 또한 제2형 당뇨병,[14] 인슐린 저항성,[15] 염증성 질환,[16] 그리고 다른 비만과 관련된 [17]질병과 관련이 있다.마찬가지로, 목 지방(또는 자궁경부 지방 조직)의 축적은 [18]사망률과 관련이 있는 것으로 나타났다.여러 연구에 따르면 내장지방은 간단한 인체측정학 [19]측정으로 예측할 수 있으며, 체질량 지수나 허리 [20]둘레보다 더 정확하게 사망률을 예측한다.
남성은 성호르몬 차이로 인해 복부에 지방이 축적될 가능성이 더 높다.에스트로겐은 여성의 [21][22]엉덩이, 허벅지, 엉덩이에 지방을 저장하게 한다.여성들이 폐경이 되고 난소에서 생성되는 에스트로겐이 감소하면, 지방은 엉덩이, 엉덩이, [23]허벅지에서 허리로 이동하고, 나중에는 [12]복부에 지방이 축적된다.
내장지방은 과도한 코티솔 [24]수치로 인해 발생할 수 있다.일주일에 최소 10시간의 유산소 운동은 대사 관련 [25]장애가 없는 사람들의 내장 지방 감소로 이어진다.저항력 훈련과 열량 제한은 또한 비록 그 효과가 [26]누적되지는 않을지라도 내장 지방을 감소시킨다.운동과 저칼로리 식단은 내장지방의 감소를 유발하지만, 운동은 전체 [27]지방보다 내장지방의 감소 효과가 더 크다.고강도 운동은 전체 복부 [28][29]지방을 효과적으로 줄이는 한 가지 방법이다.운동과 결합된 에너지 제한 식단은 전체 체지방과 내장지방조직 대 [30]피하지방조직 비율을 감소시켜 피하지방보다 내장지방이 선호된다는 것을 시사한다.
심외막 지방
심외막지방조직(EAT)은 심장 주위에 축적된 내장지방의 특정 형태이며 다양한 생체 활성 분자를 생성하는 대사 활성 기관으로, 심장 [31]기능에 상당한 영향을 미칠 수 있습니다.EAT와 피하지방을 비교한 결과 뚜렷한 성분 차이가 관찰되었으며, 이는 저장된 지방산이 지방세포 기능과 [32]신진대사에 미치는 위치 특이적 영향을 시사한다.
피하지방
남아있는 대부분의 비간장 지방은 [33]피하라고 불리는 부위의 피부 바로 아래에 있습니다.이 피하지방은 심장병, 암, 뇌졸중과 같은 전통적인 비만 관련 병리학과는 관련이 없으며, 심지어 어떤 증거들은 그것이 [34]보호적일 수도 있다는 것을 암시한다.엉덩이, 허벅지, 엉덩이 주변의 전형적인 여성(또는 여아) 지방 분포는 피하지방이며, 따라서 내장 [35][36]지방에 비해 건강상의 위험이 적다.
다른 모든 지방 기관과 마찬가지로 피하지방은 내분비계의 활성 부분으로 렙틴과 레지스틴 [33]호르몬을 분비합니다.
피하 지방층과 사람의 총 체지방 사이의 관계는 종종 회귀 방정식을 사용하여 모델링된다.이 공식들 중 가장 인기 있는 것은 Durnin과 Wormersley에 의해 형성되었고, 그들은 많은 종류의 피부 접힘을 엄격하게 테스트했고, 그 결과 남성과 여성 모두의 신체 밀도를 계산하기 위해 두 가지 공식을 만들었다.이러한 방정식은 피부 주름과 신체 밀도 사이의 역상관 관계를 나타냅니다. 피부 주름의 합이 증가하면 신체 밀도는 [37]감소합니다.
성별, 나이, 인구 크기 또는 기타 변수들은 방정식을 무효화하고 사용할 수 없게 만들 수 있으며, 2012년 현재[update] 더닌과 워머슬리의 방정식은 사람의 실제 비만 수준에 대한 추정치만 남아 있다.새로운 공식은 아직 [37]작성 중입니다.
골수 지방
골수지방조직(MAT)으로도 알려진 골수지방은 뼈에 상주하며 골격 요소뿐만 아니라 조혈세포가 섞여 있는 잘 알려지지 않은 지방분포체이다.이 저장소의 지방세포는 지방세포, 골세포 및 기타 세포 유형을 발생시킬 수 있는 중간엽 줄기세포(MSC)에서 파생됩니다.열량 제한/거식증 설정에서 MAT가 증가한다는 것은 다른 지방 [38][39][40]저장소와 구별되는 특징이다.운동은 MAT를 조절하여 MAT의 양을 줄이고 골수 지방세포의 [41][42][43]크기를 줄인다.골수지방의 운동 조절은 골수지방이 다른 백색 지방 저장소와 생리적으로 유사하다는 것을 암시한다.게다가, 비만의 증가된 MAT는 백색 지방 [41]축적물과의 유사성을 더욱 시사한다.
이소성 지방
이소성 지방은 지방 조직 이외의 조직에 트리글리세라이드를 저장하는 것으로, 간, 골격근, 심장, [1]췌장과 같은 적은 양의 지방만 함유하도록 되어 있습니다.이것은 세포 기능과 장기 기능을 방해할 수 있으며 제2형 [44]당뇨병의 인슐린 저항성과 관련이 있다.복강 기관 주변에 비교적 많은 양이 저장되지만 내장 지방과 혼동해서는 안 된다.
이소성 지방이 축적되는 구체적인 원인은 알려지지 않았다.원인은 과도한 에너지 섭취와 신체 활동 감소와 관련된 유전적, 환경적, 행동적 요인의 조합일 수 있습니다.상당한 체중 감소는 모든 장기에 있는 이소성 지방 저장을 줄일 수 있으며 이는 이러한 [44]장기의 기능 향상과 관련이 있다.
후자의 경우, 식이요법이나 운동과 같은 비침습적 체중 감량 개입은 과체중이거나 비만인 어린이와 [45][46]성인의 이소성 지방(특히 심장과 간)을 감소시킬 수 있다.
생리학
유리지방산(FFA)은 리포단백질(LPL)에 의해 리포단백질로부터 해방되어 지방세포로 들어가 글리세롤에 [2]에스테르화함으로써 트리글리세리드화된다.인간의 지방 조직에는 약 87%의 [47]지질이 포함되어 있다.
지방조직으로 [2]들어오고 나가는 FFA의 지속적인 플럭스가 있다.이 플럭스의 순방향은 인슐린과 렙틴에 의해 제어됩니다. 인슐린이 증가하면 FFA의 순내향 플럭스가 존재하며, 인슐린이 낮을 때만 FFA가 지방 조직을 떠날 수 있습니다.인슐린 분비는 탄수화물 [48]섭취로 인한 고혈당에 의해 촉진된다.
인간에서 지방분해(트리글리세라이드의 유리지방산 가수분해)는 지방분해성 B-아드레날린성 수용체와 a2A-아드레날린성 수용체 매개 안티리폴리시스를 균형 있게 제어함으로써 제어된다.
지방 세포는 인슐린 [2]저항성을 결정할 뿐만 아니라 트리글리세리드 및 유리 지방산 수치를 유지하는 데 중요한 생리학적 역할을 합니다.복부 지방은 다른 신진대사 프로파일을 가지고 있다. 인슐린 저항을 유도하기 더 쉽다.이것은 왜 중추성 비만이 포도당 내성 장애의 지표이고 심혈관 질환의 독립적인 위험 요소인지 상당 부분 설명한다(당뇨병과 고혈압이 [49]없는 경우에도).Wake Forest University(2009)의 암컷 원숭이들에 대한 연구는 스트레스를 더 많이 받는 사람들이 그들의 몸에 내장 지방 수치가 더 높다는 것을 발견했다.이것은 스트레스가 내장지방의 축적을 촉진하여 심장병과 다른 [50]건강 문제에 기여하는 호르몬과 신진대사의 변화를 일으키는 두 가지 사이의 가능한 인과관계를 암시한다.
최근 생명공학의 발전은 지방조직에서 성인줄기세포를 채취할 수 있게 해주어 환자 자신의 세포를 이용한 조직 재생을 자극할 수 있게 했다.또 사람과 동물의 지방 유래 줄기세포는 공급세포 [51]없이도 효율적으로 유도 다능성 줄기세포로 재프로그래밍할 수 있는 것으로 알려졌다.환자 자신의 세포를 사용하는 것은 조직 거부 반응을 줄이고 인간 배아 줄기세포 사용과 [52]관련된 윤리적 문제를 회피한다.또한 다양한 지방 축적물(즉, 복부, 장내, 심막)이 다른 특성을 [52][53]가진 지방 유래 줄기세포를 생산한다는 증거가 증가하고 있다.이러한 디포 의존적 특징에는 저산소 배양 [54]조건에 대한 민감성뿐만 아니라 증식 속도, 면역 표현형, 분화 잠재력, 유전자 발현 등이 포함됩니다.산소 수치는 신진대사와 일반적으로 지방 유래 줄기세포의 [55]기능에 중요한 역할을 하는 것으로 보인다.
지방조직은 남성과 여성 모두에서 방향족효소의 주요 말초 공급원으로 [56]에스트라디올 생산에 기여한다.
지방 유도 호르몬에는 다음이 포함됩니다.
지방 조직은 또한 비만과 관련된 합병증에 역할을 하는 아디포킨이라고 불리는 일종의 사이토카인을 분비합니다.혈관주변 지방조직은 아디포넥틴과 같은 아디포킨을 방출하는데,[1][57] 아디포넥틴은 아디포킨을 둘러싸고 있는 혈관의 수축기능에 영향을 미친다.
갈색 지방
갈색 지방 또는 갈색 지방 조직(BAT)은 인간과 다른 포유류의 적응 열 형성에 중요한 지방 조직의 특수 형태이다.BAT는 미토콘드리아 내의 산화적 인산화 호흡 사슬을 분리 단백질 1(UCP1)[58]의 조직 특이적 발현을 통해 "분리"함으로써 열을 발생시킬 수 있으며, BAT는 주로 목과 흉곽의 큰 혈관 주위에 위치하여 열 교환에 효과적으로 작용할 수 있다.BAT는 냉간 노출 시 교감 신경에서 카테콜아민이 방출되어 UCP1 활성화로 이어짐으로써 강력하게 활성화된다.BAT 활성화는 [59]과잉섭취에 대한 반응으로도 발생할 수 있다.UCP1 활성은 β-아드레날린 수용체 [58]활성화 이후에 생성되는 긴 사슬 지방산에 의해 자극된다.UCP1은 [60]아직 정확한 메커니즘이 설명되지 않았지만 지방산 양성자 심포터로서 기능하는 것이 제안되었다.반면 UCP1은 ATP, ADP 및 GTP에 [61]의해 억제된다.
이 과정을 약리학적으로 시뮬레이션하려는 시도는 지금까지 성공하지 못했습니다."갈색 지방"의 분화를 조작하는 기술은 미래에 체중 감량 치료의 메커니즘이 될 수 있으며, 다른 장기에서 유도하지 않고 이러한 특수 대사로 조직의 성장을 촉진할 수 있다.인간 비만을 치료하기 위한 갈색 지방의 궁극적인 치료 목표에 대한 리뷰는 Samuelson과 Vidal-Puig에 의해 [62]2020년에 발표되었다.
최근까지, 인간의 갈색 지방 조직은 주로 유아에게만 국한된다고 생각되었지만, 새로운 증거가 그러한 믿음을 뒤집었다.갈색 지방과 유사한 온도 반응을 보이는 대사 활성 조직은 2007년에 [63]일부 인간 성인의 목과 몸통에 처음 보고되었고, 인간 성인의 갈색 지방은 나중에 동일한 해부학적 [64][65][66]영역에서 조직학적으로 확인되었다.
베이지 지방과 WAT 브라운
"베이징"이라고도 하는 WAT의 브라우닝은 WAT 디포트의 지방세포가 BAT의 특징을 발달시킬 때 발생한다.베이지 지방세포는 (여러 개의 지질방울을 포함한) 다안형 외관을 가지며, 분리단백질1(UCP1)[67]의 발현을 증가시킨다.이렇게 함으로써 이들 통상적인 에너지 축적 지방세포는 에너지 방출 지방세포가 된다.
갈색과 베이지색 지방의 칼로리 연소 능력은 비만과 당뇨병을 치료하기 위한 치료법에 초점을 맞춘 연구 노력으로 광범위하게 연구되어 왔다.UCP1과 유사하게 화학적 분리기로도 작용하는 2,4-디니트로페놀 약물은 1930년대에 체중 감량에 사용되었다.그러나 과다 복용이 고열과 사망 [67]등 부작용을 일으키자 금세 중단됐다.CL316,243과 같은 β3 작용제도 개발되어 인체에서 테스트되었다.그러나 이러한 약물의 사용은 다양한 종 수용체 특이성과 낮은 경구 생체 이용률을 [68]포함한 여러 가지 도전으로 인해 대부분 성공하지 못한 것으로 입증되었다.
Cold는 BAT 프로세스의 주요 조절 장치로 WAT 갈색을 유도합니다.만성적인 한랭 노출에 대한 반응으로 갈변하는 것은 잘 문서화되어 있으며 되돌릴 수 있는 과정이다.쥐를 대상으로 한 연구에서는 냉기에 의한 갈색이 21일 만에 완전히 반전될 수 있으며 UCP1의 측정 가능한 감소는 24시간 [69]내에 확인된다는 것이 입증되었습니다.Rosenwald 등의 연구에 따르면 동물들이 추운 환경에 재노출될 때 동일한 지방세포가 베이지색 표현형을 채택하여 베이지색 지방세포가 [70]유지된다는 것이 밝혀졌다.
점점 더 많은 다른 요인들과 함께 전사 조절기는 베이지 지방의 유도를 조절합니다.WAT 갈변에는 4가지 전사 조절제가 중심이며,[71] 이 과정에 영향을 미치는 것으로 알려진 많은 분자의 표적 역할을 합니다.여기에는 퍼옥시좀 증식기 활성화 수용체 감마(PPAR),), PRDM16,[72] 퍼옥시좀 증식기 활성화 수용체 감마 코액티베이터 1 알파(PGC-1α), 조기 B세포 인자 2(EBF2)[73][74][75]가 포함된다.
갈색에 영향을 미치는 분자 목록은 이 토픽의 인기에 정비례하여 증가하였고 더 많은 지식을 습득함에 따라 지속적으로 진화하고 있다.이들 분자 중에는 이리신 및 섬유아세포증식인자21(FGF21)이 있으며, 이들은 잘 연구되어 갈변조절제로서 중요한 것으로 생각된다.이리신은 운동에 반응하여 근육에서 분비되며 베이지색 전지방세포에 [76]작용하여 갈색을 증가시키는 것으로 나타났다.간에서 주로 분비되는 호르몬인 FGF21은 PGC-1α에 [67]대한 영향을 통해 포도당 흡수의 강력한 자극제이자 갈변조절제로 확인돼 큰 관심을 끌고 있다.저온 노출 시 BAT에서 증가하며 다이어트 유도[77] 비만에 대한 저항성을 돕는 것으로 생각되지만 FGF21은 [78][79]운동과 저단백질 식단에 대한 반응으로 분비될 수 있다.이 연구들의 데이터는 식이요법과 운동과 같은 환경적인 요소들이 갈색을 유발하는 중요한 매개체일 수 있다는 것을 암시한다.생쥐에서는 인터류킨 [80]33에 대한 반응으로 타입 2의 선천성 림프세포에 의한 메티오닌-엔케팔린 펩타이드의 생성을 통해 베잉이 발생할 수 있음을 발견했다.
갈변 연구를 위한 유전체학 및 생물정보학 도구
지방조직의 복잡한 특성 및 갈변조절분자 목록이 증가함에 따라, 이 분야에서 연구를 개선하기 위해 생물정보학 도구를 사용할 수 있는 큰 가능성이 존재한다.WAT 브라우닝에 대한 연구는 이러한 기술의 진보로 인해 큰 이득을 얻었으며, 베이지 지방은 비만과 당뇨병의 치료 대상으로 빠르게 인기를 얻고 있다.
DNA 마이크로어레이는 다양한 유전자의 발현 수준을 동시에 정량화하기 위해 사용되는 생체정보학 도구이며 지방조직 연구에 광범위하게 사용되어 왔다.그러한 연구 중 하나는 생쥐가 28°[81]C와 6°C의 온도에 노출되었을 때 WAT 및 BAT 유전자 발현 변화를 조사하기 위해 Inneguity IPA 소프트웨어와 함께 마이크로 어레이 분석을 사용했다.그런 다음 가장 유의한 상향 조절 및 하향 조절 유전자를 식별하여 차등 발현 경로 분석에 사용했다.냉간 노출 후 WAT에서 상향 조절되는 경로의 상당수는 산화적 인산화, 지방산 대사, 피루브산 [81]대사 등 BAT에서도 고도로 발현되는 것으로 밝혀졌다.이는 일부 지방세포가 6°C에서 베이지 표현형으로 전환되었음을 시사한다.또한 Mössenböck 등은 미세 배열 분석을 사용하여 인슐린 결핍이 베이지색 지방세포의 분화를 억제하지만 [82]갈변 능력을 방해하지는 않는다는 것을 입증했다.이 두 가지 연구는 WAT 갈변 연구에서 마이크로 어레이의 사용 가능성을 보여준다.
RNA 배열 분석(RNA-Seq)은 샘플 내의 모든 유전자에 대한 RNA 발현을 정량화할 수 있는 강력한 계산 도구입니다.RNA-Seq를 갈변 연구에 통합하는 것은 다른 방법보다 더 나은 특이성, 민감성, 그리고 유전자 발현에 대한 보다 포괄적인 개요를 제공하기 때문에 큰 가치가 있다.RNA-Seq는 유전자 발현 프로파일에 따라 베이지 지방세포를 특성화하고 베이지 표현형을 유도할 수 있는 잠재적 치료 분자를 식별하기 위해 인간과 마우스 연구에서 모두 사용되어 왔다.그러한 연구 중 하나는 야생형(WT) 생쥐의 WAT 유전자 발현 프로파일과 과잉 발현하는 조기 B세포 인자-2(EBF2)를 비교하기 위해 RNA-Seq를 사용했다.트랜스제닉 동물의 WAT는 갈색 지방 유전자 프로그램을 보였으며 [83]WT 생쥐에 비해 WAT 특이 유전자 발현을 감소시켰다.따라서 EBF2는 베잉을 유도하는 잠재적 치료 분자로 확인되었다.
염기서열을 포함한 크로마틴 면역침강(ChIP-seq)은 DNA의 단백질 결합 부위를 식별하고 히스톤 변형을 평가하는 데 사용되는 방법이다.이 도구는 갈색의 후생유전학적 조절을 검사하고 단백질-DNA 상호작용이 베이지 지방세포의 분화를 자극하는 메커니즘을 설명하는 데 도움이 됩니다.베이지 지방세포의 염색질 환경을 관찰한 연구는 이러한 세포의 지방 형성이 전사 프로그램을 조절하고 궁극적으로 분화를 제어하는 세포 특이 염색질 환경의 형성에 기인한다는 것을 발견했다.ChIP-seq를 다른 도구와 함께 사용하여, 최근 연구는 베이지색 지방세포 [83]발달에 영향을 미치는 30개 이상의 전사 및 후생유전 인자를 확인했습니다.
유전학
알뜰 유전자 가설은 일부 인구에서 신체가 풍족할 때 지방을 유지하는 데 더 효율적일 것이고, 따라서 식량 부족 시 기아에 대한 더 큰 저항력을 갖게 될 것이라고 말한다.비록 그것의 사업자에 다른 맥락에서"도 가능할 것으로 때[그것은]처음 진출했다"여전히 따르면 이 가설, 원래 포도당 신진대사와 인슐린 저항성의 맥락에서 발전해, 자연 인류 학자들은, physiologists고, 그 컨텍스트에 관한 생각 자신의 원래 지지자에 의해, 불신되어 왔습니다.[84][85]
1995년, 제프리 프리드먼과 더글러스 콜먼 등은 록펠러 대학 레지던트 시절, 유전적으로 비만인 이 쥐에게 [86][87][88]부족한 단백질 렙틴을 발견했다.렙틴은 백색 지방조직에서 생성되어 시상하부에 신호를 보낸다.렙틴 수치가 떨어지면, 몸은 이것을 에너지 손실이라고 해석하고 배고픔은 증가한다.이 단백질이 부족한 쥐는 정상 크기의 4배가 될 때까지 먹습니다.
그러나 렙틴은 설치류와 인간의 식이요법에 의한 비만에는 다른 역할을 한다.지방세포는 렙틴을 생성하기 때문에 비만인 경우 렙틴 수치가 높아진다.그러나 배고픔은 여전하며 체중 감소로 렙틴 수치가 떨어지면 배고픔이 증가한다.렙틴의 강하는 포만감 [89]신호로 렙틴의 상승보다 기아 신호로 더 잘 보인다.그러나 비만에서 렙틴의 증가는 렙틴 저항성으로 알려져 있다.비만에서 렙틴 저항성을 초래하기 위해 시상하부에서 일어나는 변화는 현재 비만 연구의 [90]초점이다.
렙틴 유전자(ob)의 유전자 결함은 인간의 [91]비만에서 드물다.7월 2010[업데이트]의 5가족에서 14개인들에 시달리는 전 세계의 파키스탄 출신의 변종ob 유전자(유전적 비만이 인간의, 이것은 사상 최초로 확인된 원인)—two 가족들이 영국에서 사는, 한 가족은 터키, 이집트에서 살고 있고, 한 Austria[92][93][94][95][96]—and 다른 두 속에 가지고 다니로 밝혀졌다. 가족들은 그 발견되었다.변이된 [97][98]ob 수용체를 운반할 때요다른 사람들은 유전적으로 렙틴이 부분적으로 부족한 것으로 확인되었고, 이러한 개인들에게서, 정상 범위의 낮은 끝의 렙틴 수치는 [99]비만을 예측할 수 있습니다.
멜라노코르틴과 그들의 수용체와 관련된 몇몇 유전자 돌연변이들 또한 렙틴 [100]돌연변이들보다 더 많은 인구에서 비만을 유발하는 것으로 확인되었다.
물리 속성
지방조직의 밀도는 0.9g/[101]ml이다.따라서 근육조직의 밀도가 1.06g/[102]ml이기 때문에 지방조직이 많은 사람은 근육조직이 많은 같은 체중의 사람보다 더 쉽게 뜬다.
체지방계
체지방계는 인체에서 체중 대비 체지방 비율을 측정하기 위해 사용되는 도구입니다.미터마다 비율을 결정하기 위해 다양한 방법을 사용합니다.그들은 체지방 비율을 낮게 읽는 경향이 있다.
임상 도구와 대조적으로 비교적 저렴한 체지방 측정기는 개인의 체지방 비율을 결정하기 위해 생체 전기 임피던스 분석(BIA) 원리를 사용한다.이를 위해 미터는 몸에 무해한 작은 전류를 흘려 저항을 측정한 다음 체중, 키, 나이, 성별 정보를 사용하여 사람의 체지방률에 대한 대략적인 값을 계산합니다.이 계산은 체내 총 수분 부피를 측정하고(리간 조직과 근육은 지방보다 물의 비율이 높다) 이 정보를 바탕으로 지방 비율을 추정합니다.결과는 분석 전에 먹은 음식과 마신 물의 양에 따라 몇 % 포인트 변동할 수 있습니다.
생체전기 임피던스 분석기가 개발되기 전에는 캘리퍼를 이용한 피부접기법, 수중측정법, 전신공기변위 플레티스모그래피(ADP), DXA 등 신체조성을 분석하는 방법이 다양했다.
동물 연구
CCR2 결핍 생쥐의 지방(지방) 조직 내에는 호산구 증가, 대식세포 활성화 증가 및 2형 사이토카인 발현 경향이 있다.게다가, 이 효과는 쥐들이 고지방 식단으로 [103]비만이 되었을 때 과장되었다.
갤러리
「 」를 참조해 주세요.
- 지방분화관련단백질
- 지방 세포
- 아플린
- 생체전기 임피던스 분석 – 체지방률을 측정하는 방법.
- 블러버 – 일부 해양 포유류에서 발견되는 지방 조직의 매우 두꺼운 형태입니다.
- 체지방률
- 셀룰라이트
- 지방 분해
- 지방영양증
- 전통 의학에서 의약품으로 사용되는 인간의 지방
- 비만
- 기아
- 지방증(지방변화, 지방변화 또는 지방변화라고도 함)
- 줄기세포
- 피하지방
- 비만학
- 비만의 분류
- 소아비만 분류
- 세계 최대 비만 예방 네트워크인 EPODE International Network
- 미국 올림픽 위원회(USOC)와 미국 올림픽 장애인 협회(USOP)의 월드 피트 A 프로그램
- 비만과 보행
- 비만의 사회적 낙인
레퍼런스
- ^ a b c d Birbrair A, Zhang T, Wang ZM, Messi ML, Enikolopov GN, Mintz A, Delbono O (August 2013). "Role of pericytes in skeletal muscle regeneration and fat accumulation". Stem Cells and Development. 22 (16): 2298–2314. doi:10.1089/scd.2012.0647. PMC 3730538. PMID 23517218.
- ^ a b c d e f Ye RZ, Richard G, Gévry N, Tchernof A, Carpentier AC (January 2022). "Fat Cell Size: Measurement Methods, Pathophysiological Origins, and Relationships With Metabolic Dysregulations". Endocrine Reviews. 43 (1): 35–60. doi:10.1210/endrev/bnab018. PMC 8755996. PMID 34100954.
- ^ Kershaw EE, Flier JS (June 2004). "Adipose tissue as an endocrine organ". The Journal of Clinical Endocrinology and Metabolism. 89 (6): 2548–2556. doi:10.1210/jc.2004-0395. PMID 15181022.
- ^ Mancuso P (May 2016). "The role of adipokines in chronic inflammation". ImmunoTargets and Therapy. 5 (2016): 47–56. doi:10.2147/ITT.S73223. PMC 4970637. PMID 27529061.
- ^ Cannon B, Nedergaard J (August 2008). "Developmental biology: Neither fat nor flesh". Nature. 454 (7207): 947–948. Bibcode:2008Natur.454..947C. doi:10.1038/454947a. PMID 18719573. S2CID 205040511.
- ^ Aarsland A, Chinkes D, Wolfe RR (June 1997). "Hepatic and whole-body fat synthesis in humans during carbohydrate overfeeding". The American Journal of Clinical Nutrition. 65 (6): 1774–1782. doi:10.1093/ajcn/65.6.1774. PMID 9174472.
- ^ Pond CM (1998). The Fats of Life. Cambridge University Press. ISBN 978-0-521-63577-6.
- ^ Cinti S (July 2005). "The adipose organ". Prostaglandins, Leukotrienes, and Essential Fatty Acids. 73 (1): 9–15. doi:10.1016/j.plefa.2005.04.010. PMID 15936182. S2CID 24434046.
- ^ Bachmanov AA, Reed DR, Tordoff MG, Price RA, Beauchamp GK (March 2001). "Nutrient preference and diet-induced adiposity in C57BL/6ByJ and 129P3/J mice". Physiology & Behavior. 72 (4): 603–613. doi:10.1016/S0031-9384(01)00412-7. PMC 3341942. PMID 11282146.
- ^ Wirth A, Wabitsch M, Hauner H (October 2014). "The prevention and treatment of obesity". Deutsches Ärzteblatt International. 111 (42): 705–713. doi:10.3238/arztebl.2014.0705. PMC 4233761. PMID 25385482.
- ^ 안쪽 지방: 날씬해 보이는 것만으로는 충분치 않습니다.Fiona Haynes, About.com
- ^ a b "Abdominal fat and what to do about it". President & Fellows of Harvard College. September 2005.
Visceral fat more of a health concern than subcutaneous fat
- ^ Nagai M, Komiya H, Mori Y, Ohta T, Kasahara Y, Ikeda Y (May 2010). "Estimating visceral fat area by multifrequency bioelectrical impedance". Diabetes Care. 33 (5): 1077–1079. doi:10.2337/dc09-1099. PMC 2858179. PMID 20150289.
- ^ Montague CT, O'Rahilly S (June 2000). "The perils of portliness: causes and consequences of visceral adiposity". Diabetes. 49 (6): 883–888. doi:10.2337/diabetes.49.6.883. PMID 10866038.
- ^ Kern PA, Ranganathan S, Li C, Wood L, Ranganathan G (May 2001). "Adipose tissue tumor necrosis factor and interleukin-6 expression in human obesity and insulin resistance". American Journal of Physiology. Endocrinology and Metabolism. 280 (5): E745–E751. doi:10.1152/ajpendo.2001.280.5.e745. PMID 11287357. S2CID 24306481.
- ^ Marette A (December 2003). "Molecular mechanisms of inflammation in obesity-linked insulin resistance". International Journal of Obesity and Related Metabolic Disorders. 27 (Suppl 3): S46–S48. doi:10.1038/sj.ijo.0802500. PMID 14704744.
- ^ Mokdad AH, Ford ES, Bowman BA, Dietz WH, Vinicor F, Bales VS, Marks JS (January 2003). "Prevalence of obesity, diabetes, and obesity-related health risk factors, 2001". JAMA. 289 (1): 76–79. doi:10.1001/jama.289.1.76. PMID 12503980.
- ^ Maresky HS, Sharfman Z, Ziv-Baran T, Gomori JM, Copel L, Tal S (November 2015). "Anthropometric Assessment of Neck Adipose Tissue and Airway Volume Using Multidetector Computed Tomography: An Imaging Approach and Association With Overall Mortality". Medicine. 94 (45): e1991. doi:10.1097/MD.0000000000001991. PMC 4912280. PMID 26559286.
- ^ Brown JC, Harhay MO, Harhay MN (February 2018). "Anthropometrically predicted visceral adipose tissue and blood-based biomarkers: a cross-sectional analysis". European Journal of Nutrition. 57 (1): 191–198. doi:10.1007/s00394-016-1308-8. PMC 5513780. PMID 27614626.
- ^ Brown JC, Harhay MO, Harhay MN (January 2017). "Anthropometrically-predicted visceral adipose tissue and mortality among men and women in the third national health and nutrition examination survey (NHANES III)". American Journal of Human Biology. 29 (1): e22898. doi:10.1002/ajhb.22898. PMC 5241265. PMID 27427402.
- ^ "Reduce Abdominal Fat". Archived from the original on 2011-09-28. Retrieved 2009-04-10.
Estrogen causes fat to be stored around the pelvic region, hips, butt and thighs (pelvic region)
- ^ "Waistline Worries: Turning Apples Back Into Pears". healthywomen.org. Archived from the original on 2009-06-09.
- ^ 연구자들은 폐경기 때 에스트로겐의 부족이 우리의 지방을 북쪽으로 이동시키는 역할을 한다고 생각한다.참조:
- ^ Singh AK, Loscalzo J, eds. (2014). The Brigham Intensive Review of Internal Medicine (2nd ed.). New York, NY: Oxford University Press. p. 483. ISBN 978-0-19-935827-4. Retrieved August 3, 2021.
- ^ Ohkawara K, Tanaka S, Miyachi M, Ishikawa-Takata K, Tabata I (December 2007). "A dose-response relation between aerobic exercise and visceral fat reduction: systematic review of clinical trials". International Journal of Obesity. 31 (12): 1786–1797. doi:10.1038/sj.ijo.0803683. PMID 17637702.
- ^ Khalafi M, Malandish A, Rosenkranz SK, Ravasi AA (September 2021). "Effect of resistance training with and without caloric restriction on visceral fat: A systemic review and meta-analysis". Obesity Reviews. 22 (9): e13275. doi:10.1111/obr.13275. PMID 33998135. S2CID 234747534.
- ^ Verheggen RJ, Maessen MF, Green DJ, Hermus AR, Hopman MT, Thijssen DH (August 2016). "A systematic review and meta-analysis on the effects of exercise training versus hypocaloric diet: distinct effects on body weight and visceral adipose tissue" (PDF). Obesity Reviews. 17 (8): 664–690. doi:10.1111/obr.12406. PMID 27213481. S2CID 206228752.
- ^ Irving BA, Davis CK, Brock DW, Weltman JY, Swift D, Barrett EJ, et al. (November 2008). "Effect of exercise training intensity on abdominal visceral fat and body composition". Medicine and Science in Sports and Exercise. 40 (11): 1863–1872. doi:10.1249/MSS.0b013e3181801d40. PMC 2730190. PMID 18845966.
- ^ Coker RH, Williams RH, Kortebein PM, Sullivan DH, Evans WJ (August 2009). "Influence of exercise intensity on abdominal fat and adiponectin in elderly adults". Metabolic Syndrome and Related Disorders. 7 (4): 363–368. doi:10.1089/met.2008.0060. PMC 3135883. PMID 19196080.
- ^ Ross R, Rissanen J (November 1994). "Mobilization of visceral and subcutaneous adipose tissue in response to energy restriction and exercise". The American Journal of Clinical Nutrition. 60 (5): 695–703. doi:10.1093/ajcn/60.5.695. PMID 7942575.
- ^ Mazurek T, Zhang L, Zalewski A, Mannion JD, Diehl JT, Arafat H, et al. (November 2003). "Human epicardial adipose tissue is a source of inflammatory mediators". Circulation. 108 (20): 2460–2466. doi:10.1161/01.CIR.0000099542.57313.C5. PMID 14581396.
- ^ Pezeshkian M, Noori M, Najjarpour-Jabbari H, Abolfathi A, Darabi M, Darabi M, et al. (April 2009). "Fatty acid composition of epicardial and subcutaneous human adipose tissue". Metabolic Syndrome and Related Disorders. 7 (2): 125–131. doi:10.1089/met.2008.0056. PMID 19422139.
- ^ a b Hoehn K, Marieb EN (2008). Anatomy & Physiology (3rd ed.). San Francisco, Calif.: Pearson/Benjamin Cummings. ISBN 978-0-8053-0094-9.
- ^ Porter SA, Massaro JM, Hoffmann U, Vasan RS, O'Donnel CJ, Fox CS (June 2009). "Abdominal subcutaneous adipose tissue: a protective fat depot?". Diabetes Care. 32 (6): 1068–1075. doi:10.2337/dc08-2280. PMC 2681034. PMID 19244087.
- ^ "Belly fat in women: Taking – and keeping – it off". MayoClinic.com. 2013-06-08. Retrieved 2013-12-02.
- ^ Manolopoulos KN, Karpe F, Frayn KN (June 2010). "Gluteofemoral body fat as a determinant of metabolic health". International Journal of Obesity. 34 (6): 949–959. doi:10.1038/ijo.2009.286. PMID 20065965.
- ^ a b Brodie D, Moscrip V, Hutcheon R (March 1998). "Body composition measurement: a review of hydrodensitometry, anthropometry, and impedance methods". Nutrition. 14 (3): 296–310. doi:10.1016/S0899-9007(97)00474-7. PMID 9583375.
- ^ Devlin MJ, Cloutier AM, Thomas NA, Panus DA, Lotinun S, Pinz I, et al. (September 2010). "Caloric restriction leads to high marrow adiposity and low bone mass in growing mice". Journal of Bone and Mineral Research. 25 (9): 2078–2088. doi:10.1002/jbmr.82. PMC 3127399. PMID 20229598.
- ^ Cawthorn WP, Scheller EL, Parlee SD, Pham HA, Learman BS, Redshaw CM, et al. (February 2016). "Expansion of Bone Marrow Adipose Tissue During Caloric Restriction Is Associated With Increased Circulating Glucocorticoids and Not With Hypoleptinemia". Endocrinology. 157 (2): 508–521. doi:10.1210/en.2015-1477. PMC 4733126. PMID 26696121.
- ^ Bredella MA, Fazeli PK, Miller KK, Misra M, Torriani M, Thomas BJ, et al. (June 2009). "Increased bone marrow fat in anorexia nervosa". The Journal of Clinical Endocrinology and Metabolism. 94 (6): 2129–2136. doi:10.1210/jc.2008-2532. PMC 2690416. PMID 19318450.
- ^ a b Styner M, Pagnotti GM, McGrath C, Wu X, Sen B, Uzer G, et al. (August 2017). "Exercise Decreases Marrow Adipose Tissue Through ß-Oxidation in Obese Running Mice". Journal of Bone and Mineral Research. 32 (8): 1692–1702. doi:10.1002/jbmr.3159. PMC 5550355. PMID 28436105.
- ^ Styner M, Pagnotti GM, Galior K, Wu X, Thompson WR, Uzer G, et al. (August 2015). "Exercise Regulation of Marrow Fat in the Setting of PPARγ Agonist Treatment in Female C57BL/6 Mice". Endocrinology. 156 (8): 2753–2761. doi:10.1210/en.2015-1213. PMC 4511140. PMID 26052898.
- ^ Styner M, Thompson WR, Galior K, Uzer G, Wu X, Kadari S, et al. (July 2014). "Bone marrow fat accumulation accelerated by high fat diet is suppressed by exercise". Bone. 64: 39–46. doi:10.1016/j.bone.2014.03.044. PMC 4041820. PMID 24709686.
- ^ a b Snel M, Jonker JT, Schoones J, Lamb H, de Roos A, Pijl H, et al. (2012). "Ectopic fat and insulin resistance: pathophysiology and effect of diet and lifestyle interventions". International Journal of Endocrinology. 2012: 983814. doi:10.1155/2012/983814. PMC 3366269. PMID 22675355.
- ^ Hens W, Vissers D, Hansen D, Peeters S, Gielen J, Van Gaal L, Taeymans J (November 2017). "The effect of diet or exercise on ectopic adiposity in children and adolescents with obesity: a systematic review and meta-analysis". Obesity Reviews. 18 (11): 1310–1322. doi:10.1111/obr.12577. hdl:1942/24948. PMID 28913977. S2CID 10876113.
- ^ Hens W, Taeyman J, Cornelis J, Gielen J, Van Gaal L, Vissers D (June 2016). "The Effect of Lifestyle Interventions on Excess Ectopic Fat Deposition Measured by Noninvasive Techniques in Overweight and Obese Adults: A Systematic Review and Meta-Analysis". Journal of Physical Activity and Health. 13 (6): 671–694. doi:10.1123/jpah.2015-0560. hdl:10067/1321600151162165141. PMID 26694194.
- ^ Thomas LW (April 1962). "The chemical composition of adipose tissue of man and mice". Quarterly Journal of Experimental Physiology and Cognate Medical Sciences. 47 (2): 179–188. doi:10.1113/expphysiol.1962.sp001589. PMID 13920823.
- ^ Amitani M, Asakawa A, Amitani H, Inui A (2013). "The role of leptin in the control of insulin-glucose axis". Frontiers in Neuroscience. 7: 51. doi:10.3389/fnins.2013.00051. PMC 3619125. PMID 23579596.
- ^ Dhaliwal SS, Welborn TA (May 2009). "Central obesity and multivariable cardiovascular risk as assessed by the Framingham prediction scores". The American Journal of Cardiology. 103 (10): 1403–1407. doi:10.1016/j.amjcard.2008.12.048. PMID 19427436.
- ^ Park A (2009-08-08). "Fat-Bellied Monkeys Suggest Why Stress Sucks". Time. Archived from the original on December 20, 2013. Retrieved 2013-12-19.
- ^ Sugii S, Kida Y, Kawamura T, Suzuki J, Vassena R, Yin YQ, et al. (February 2010). "Human and mouse adipose-derived cells support feeder-independent induction of pluripotent stem cells". Proceedings of the National Academy of Sciences of the United States of America. 107 (8): 3558–3563. Bibcode:2010PNAS..107.3558S. doi:10.1073/pnas.0910172106. PMC 2840462. PMID 20133714.
- ^ a b Atzmon G, Yang XM, Muzumdar R, Ma XH, Gabriely I, Barzilai N (November 2002). "Differential gene expression between visceral and subcutaneous fat depots". Hormone and Metabolic Research. 34 (11–12): 622–628. doi:10.1055/s-2002-38250. PMID 12660871.
- ^ Baglioni S, Cantini G, Poli G, Francalanci M, Squecco R, Di Franco A, et al. (4 May 2012). "Functional differences in visceral and subcutaneous fat pads originate from differences in the adipose stem cell". PLOS ONE. 7 (5): e36569. Bibcode:2012PLoSO...736569B. doi:10.1371/journal.pone.0036569. PMC 3344924. PMID 22574183.
- ^ Russo V, Yu C, Belliveau P, Hamilton A, Flynn LE (February 2014). "Comparison of human adipose-derived stem cells isolated from subcutaneous, omental, and intrathoracic adipose tissue depots for regenerative applications". Stem Cells Translational Medicine. 3 (2): 206–217. doi:10.5966/sctm.2013-0125. PMC 3925056. PMID 24361924.
- ^ Lempesis IG, van Meijel RL, Manolopoulos KN, Goossens GH (January 2020). "Oxygenation of adipose tissue: A human perspective". Acta Physiologica. 228 (1): e13298. doi:10.1111/apha.13298. PMC 6916558. PMID 31077538.
- ^ Stocco C (January 2012). "Tissue physiology and pathology of aromatase". Steroids. 77 (1–2): 27–35. doi:10.1016/j.steroids.2011.10.013. PMC 3286233. PMID 22108547.
- ^ Löhn M, Dubrovska G, Lauterbach B, Luft FC, Gollasch M, Sharma AM (July 2002). "Periadventitial fat releases a vascular relaxing factor". FASEB Journal. 16 (9): 1057–1063. doi:10.1096/fj.02-0024com. PMID 12087067. S2CID 902537.
- ^ a b Cannon B, Nedergaard J (January 2004). "Brown adipose tissue: function and physiological significance". Physiological Reviews. 84 (1): 277–359. doi:10.1152/physrev.00015.2003. PMID 14715917. S2CID 14289041.
- ^ Busiello RA, Savarese S, Lombardi A (2015). "Mitochondrial uncoupling proteins and energy metabolism". Frontiers in Physiology. 6 (36): 36. doi:10.3389/fphys.2015.00036. PMC 4322621. PMID 25713540.
- ^ Fedorenko A, Lishko PV, Kirichok Y (October 2012). "Mechanism of fatty-acid-dependent UCP1 uncoupling in brown fat mitochondria". Cell. 151 (2): 400–413. doi:10.1016/j.cell.2012.09.010. PMC 3782081. PMID 23063128.
- ^ Azzu V, Brand MD (May 2010). "The on-off switches of the mitochondrial uncoupling proteins". Trends in Biochemical Sciences. 35 (5): 298–307. doi:10.1016/j.tibs.2009.11.001. PMC 3640847. PMID 20006514.
- ^ Samuelson I, Vidal-Puig A (2020). "Studying Brown Adipose Tissue in a Human in vitro Context". Frontiers in Endocrinology. 11: 629. doi:10.3389/fendo.2020.00629. PMC 7523498. PMID 33042008.
- ^ Nedergaard J, Bengtsson T, Cannon B (August 2007). "Unexpected evidence for active brown adipose tissue in adult humans". American Journal of Physiology. Endocrinology and Metabolism. 293 (2): E444–E452. doi:10.1152/ajpendo.00691.2006. PMID 17473055. S2CID 230947.
- ^ Virtanen KA, Lidell ME, Orava J, Heglind M, Westergren R, Niemi T, et al. (April 2009). "Functional brown adipose tissue in healthy adults". The New England Journal of Medicine. 360 (15): 1518–1525. doi:10.1056/NEJMoa0808949. PMID 19357407.
- ^ van Marken Lichtenbelt WD, Vanhommerig JW, Smulders NM, Drossaerts JM, Kemerink GJ, Bouvy ND, et al. (April 2009). "Cold-activated brown adipose tissue in healthy men" (PDF). The New England Journal of Medicine. 360 (15): 1500–1508. doi:10.1056/NEJMoa0808718. PMID 19357405. S2CID 477352.
- ^ Cypess AM, Lehman S, Williams G, Tal I, Rodman D, Goldfine AB, et al. (April 2009). "Identification and importance of brown adipose tissue in adult humans". The New England Journal of Medicine. 360 (15): 1509–1517. doi:10.1056/NEJMoa0810780. PMC 2859951. PMID 19357406.
- ^ a b c Harms M, Seale P (October 2013). "Brown and beige fat: development, function and therapeutic potential". Nature Medicine. 19 (10): 1252–1263. doi:10.1038/nm.3361. PMID 24100998.
- ^ Cypess AM, Kahn CR (April 2010). "Brown fat as a therapy for obesity and diabetes". Current Opinion in Endocrinology, Diabetes, and Obesity. 17 (2): 143–149. doi:10.1097/MED.0b013e328337a81f. PMC 3593105. PMID 20160646.
- ^ Gospodarska E, Nowialis P, Kozak LP (March 2015). "Mitochondrial turnover: a phenotype distinguishing brown adipocytes from interscapular brown adipose tissue and white adipose tissue". The Journal of Biological Chemistry. 290 (13): 8243–8255. doi:10.1074/jbc.M115.637785. PMC 4375480. PMID 25645913.
- ^ Rosenwald M, Perdikari A, Rülicke T, Wolfrum C (June 2013). "Bi-directional interconversion of brite and white adipocytes". Nature Cell Biology. 15 (6): 659–667. doi:10.1038/ncb2740. PMID 23624403. S2CID 2842953.
- ^ Lo KA, Sun L (September 2013). "Turning WAT into BAT: a review on regulators controlling the browning of white adipocytes". Bioscience Reports. 33 (5): 711–19. doi:10.1042/BSR20130046. PMC 3764508. PMID 23895241.
- ^ Harms MJ, Ishibashi J, Wang W, Lim HW, Goyama S, Sato T, et al. (April 2014). "Prdm16 is required for the maintenance of brown adipocyte identity and function in adult mice". Cell Metabolism. 19 (4): 593–604. doi:10.1016/j.cmet.2014.03.007. PMC 4012340. PMID 24703692.
- ^ Wang W, Kissig M, Rajakumari S, Huang L, Lim HW, Won KJ, Seale P (October 2014). "Ebf2 is a selective marker of brown and beige adipogenic precursor cells". Proceedings of the National Academy of Sciences of the United States of America. 111 (40): 14466–14471. Bibcode:2014PNAS..11114466W. doi:10.1073/pnas.1412685111. PMC 4209986. PMID 25197048.
- ^ Kissig M, Shapira SN, Seale P (June 2016). "SnapShot: Brown and Beige Adipose Thermogenesis". Cell. 166 (1): 258–258.e1. doi:10.1016/j.cell.2016.06.038. PMC 5478388. PMID 27368105.
- ^ Shapira SN, Lim HW, Rajakumari S, Sakers AP, Ishibashi J, Harms MJ, et al. (April 2017). "EBF2 transcriptionally regulates brown adipogenesis via the histone reader DPF3 and the BAF chromatin remodeling complex". Genes & Development. 31 (7): 660–673. doi:10.1101/gad.294405.116. PMC 5411707. PMID 28428261.
- ^ Boström P, Wu J, Jedrychowski MP, Korde A, Ye L, Lo JC, et al. (January 2012). "A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis". Nature. 481 (7382): 463–468. Bibcode:2012Natur.481..463B. doi:10.1038/nature10777. PMC 3522098. PMID 22237023.
- ^ Ohta H, Itoh N (2014). "Roles of FGFs as Adipokines in Adipose Tissue Development, Remodeling, and Metabolism". Frontiers in Endocrinology. 5 (18): 18. doi:10.3389/fendo.2014.00018. PMC 3932445. PMID 24605108.
- ^ Fenzl A, Kiefer FW (July 2014). "Brown adipose tissue and thermogenesis". Hormone Molecular Biology and Clinical Investigation. 19 (1): 25–37. doi:10.1515/hmbci-2014-0022. PMID 25390014. S2CID 35008082.
- ^ Laeger T, Henagan TM, Albarado DC, Redman LM, Bray GA, Noland RC, et al. (September 2014). "FGF21 is an endocrine signal of protein restriction". The Journal of Clinical Investigation. 124 (9): 3913–3922. doi:10.1172/JCI74915. PMC 4153701. PMID 25133427.
- ^ Brestoff JR, Kim BS, Saenz SA, Stine RR, Monticelli LA, Sonnenberg GF, et al. (March 2015). "Group 2 innate lymphoid cells promote beiging of white adipose tissue and limit obesity". Nature. 519 (7542): 242–246. Bibcode:2015Natur.519..242B. doi:10.1038/nature14115. PMC 4447235. PMID 25533952.
- ^ a b Rosell M, Kaforou M, Frontini A, Okolo A, Chan YW, Nikolopoulou E, et al. (April 2014). "Brown and white adipose tissues: intrinsic differences in gene expression and response to cold exposure in mice". American Journal of Physiology. Endocrinology and Metabolism. 306 (8): E945–E964. doi:10.1152/ajpendo.00473.2013. PMC 3989735. PMID 24549398.
- ^ Inagaki T, Sakai J, Kajimura S (August 2016). "Transcriptional and epigenetic control of brown and beige adipose cell fate and function". Nature Reviews. Molecular Cell Biology. 17 (8): 480–495. doi:10.1038/nrm.2016.62. PMC 4956538. PMID 27251423.
- ^ a b Stine RR, Shapira SN, Lim HW, Ishibashi J, Harms M, Won KJ, Seale P (January 2016). "EBF2 promotes the recruitment of beige adipocytes in white adipose tissue". Molecular Metabolism. 5 (1): 57–65. doi:10.1016/j.molmet.2015.11.001. PMC 4703852. PMID 26844207.
- ^ Speakerman JR (2007). "Genetics of Obesity: Five Fundamental Problems with the Famine Hypothesis". In Fantuzzi G, Mazzone T (eds.). Adipose Tissue and Adipokines in Health and Disease. Nutrition and Health. Humana Press. pp. 221–236. doi:10.1007/978-1-59745-370-7_17. ISBN 978-1-58829-721-1.
- ^ Neel JV (1989). "The study of natural selection in primitive and civilized human populations. 1958". Human Biology. 61 (5–6): 781–810, discussion 811–23. PMID 2699601.
- ^ Shell E (January 1, 2002). "Chapter 4: On the Cutting Edge". The Hungry Gene: The Inside Story of the Obesity Industry. Atlantic Monthly Press. ISBN 978-1-4223-5243-4.
- ^ Shell E (January 1, 2002). "Chapter 5: Hunger". The Hungry Gene: The Inside Story of the Obesity Industry. Atlantic Monthly Press. ISBN 978-1-4223-5243-4.
- ^ Pelleymounter MA, Cullen MJ, Baker MB, Hecht R, Winters D, Boone T, Collins F (July 1995). "Effects of the obese gene product on body weight regulation in ob/ob mice". Science. 269 (5223): 540–543. Bibcode:1995Sci...269..540P. doi:10.1126/science.7624776. PMID 7624776.
- ^ Ravussin E, Smith SR (2013). "Chapter 11: Role of the Adipocyte in Metabolism and Endocrine Function". In Weir GC, Jameson JL, De Groot LJ (eds.). Endocrinology Adult and Pediatric. Vol. Diabetes Mellitus and Obesity (6th ed.). Elsevier Health Sciences. ISBN 978-0-323-22154-2.[페이지 필요]
- ^ Morris DL, Rui L (December 2009). "Recent advances in understanding leptin signaling and leptin resistance". American Journal of Physiology. Endocrinology and Metabolism. 297 (6): E1247–E1259. doi:10.1152/ajpendo.00274.2009. PMC 2793049. PMID 19724019.
- ^ Carlsson B, Lindell K, Gabrielsson B, Karlsson C, Bjarnason R, Westphal O, et al. (January 1997). "Obese (ob) gene defects are rare in human obesity". Obesity Research. 5 (1): 30–35. doi:10.1002/j.1550-8528.1997.tb00280.x. PMID 9061713.
- ^ Montague CT, Farooqi IS, Whitehead JP, Soos MA, Rau H, Wareham NJ, et al. (June 1997). "Congenital leptin deficiency is associated with severe early-onset obesity in humans". Nature. 387 (6636): 903–908. Bibcode:1997Natur.387..903M. doi:10.1038/43185. PMID 9202122. S2CID 205032762.
- ^ Strobel A, Issad T, Camoin L, Ozata M, Strosberg AD (March 1998). "A leptin missense mutation associated with hypogonadism and morbid obesity". Nature Genetics. 18 (3): 213–215. doi:10.1038/ng0398-213. PMID 9500540. S2CID 36920931.
- ^ Gibson WT, Farooqi IS, Moreau M, DePaoli AM, Lawrence E, O'Rahilly S, Trussell RA (October 2004). "Congenital leptin deficiency due to homozygosity for the Delta133G mutation: report of another case and evaluation of response to four years of leptin therapy". The Journal of Clinical Endocrinology and Metabolism. 89 (10): 4821–4826. doi:10.1210/jc.2004-0376. PMID 15472169.
- ^ Mazen I, El-Gammal M, Abdel-Hamid M, Amr K (August 2009). "A novel homozygous missense mutation of the leptin gene (N103K) in an obese Egyptian patient". Molecular Genetics and Metabolism. 97 (4): 305–308. doi:10.1016/j.ymgme.2009.04.002. PMID 19427251.
- ^ Fischer-Posovszky P, von Schnurbein J, Moepps B, Lahr G, Strauss G, Barth TF, et al. (June 2010). "A new missense mutation in the leptin gene causes mild obesity and hypogonadism without affecting T cell responsiveness". The Journal of Clinical Endocrinology and Metabolism. 95 (6): 2836–2840. doi:10.1210/jc.2009-2466. PMID 20382689.
- ^ Clément K, Vaisse C, Lahlou N, Cabrol S, Pelloux V, Cassuto D, et al. (March 1998). "A mutation in the human leptin receptor gene causes obesity and pituitary dysfunction". Nature. 392 (6674): 398–401. Bibcode:1998Natur.392..398C. doi:10.1038/32911. PMID 9537324. S2CID 4400661.
- ^ Pankov YA (June 1999). "Adipose tissue as an endocrine organ regulating growth, puberty, and other physiological functions". Biochemistry. Biokhimiia. 64 (6): 601–609. PMID 10395972.
- ^ Farooqi IS, Keogh JM, Kamath S, Jones S, Gibson WT, Trussell R, et al. (November 2001). "Partial leptin deficiency and human adiposity". Nature. 414 (6859): 34–35. Bibcode:2001Natur.414...34F. doi:10.1038/35102112. PMID 11689931. S2CID 4344492.
- ^ Farooqi IS, O'Rahilly S (October 2008). "Mutations in ligands and receptors of the leptin-melanocortin pathway that lead to obesity". Nature Clinical Practice. Endocrinology & Metabolism. 4 (10): 569–577. doi:10.1038/ncpendmet0966. PMID 18779842. S2CID 13946212.
- ^ Farvid MS, Ng TW, Chan DC, Barrett PH, Watts GF (July 2005). "Association of adiponectin and resistin with adipose tissue compartments, insulin resistance and dyslipidaemia". Diabetes, Obesity & Metabolism. 7 (4): 406–413. doi:10.1111/j.1463-1326.2004.00410.x. PMID 15955127. S2CID 46736884.(등록 필요)
- ^ Urbanchek MG, Picken EB, Kalliainen LK, Kuzon WM (May 2001). "Specific force deficit in skeletal muscles of old rats is partially explained by the existence of denervated muscle fibers". The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 56 (5): B191–B197. doi:10.1093/gerona/56.5.B191. PMID 11320099.
- ^ Bolus WR, Gutierrez DA, Kennedy AJ, Anderson-Baucum EK, Hasty AH (October 2015). "CCR2 deficiency leads to increased eosinophils, alternative macrophage activation, and type 2 cytokine expression in adipose tissue". Journal of Leukocyte Biology. 98 (4): 467–477. doi:10.1189/jlb.3HI0115-018R. PMC 4763864. PMID 25934927. Archived from the original on 2017-05-09. Retrieved 2016-09-08.
추가 정보
- Stock MJ, Cinti S (2003). "Adipose Tissue / Structure and Function of Brown Adipose Tissue". Encyclopedia of Food Sciences and Nutrition. pp. 29–34. doi:10.1016/B0-12-227055-X/00008-0. ISBN 978-0-12-227055-0.
- Vernon RG, Flint DJ (2003). "Adipose Tissue / Structure and Function of White Adipose Tissue". Encyclopedia of Food Sciences and Nutrition. pp. 23–29. doi:10.1016/B0-12-227055-X/00007-9. ISBN 978-0-12-227055-0.