아포시닌
Apocynin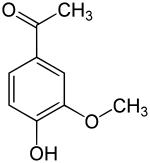 | |
 | |
 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 1-(4-히드록시-3-메톡시페닐)에탄-1-1-1 | |
| 기타 이름 1-(4-히드록시-3-메톡시페닐)에타논 4-히드록시-3-메톡시아세토페논 아세토바닐론 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐벨 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.007.141 |
| 케그 | |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C9H10O3 | |
| 어금질량 | 166.17 g/166 |
| 녹는점 | 115°C(239°F, 388K) |
| 비등점 | 295–300 °C(563–572 °F; 568–573 K) |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
아세토바닐론으로도 알려진 아포시닌은 구조적으로 바닐린과 관련된 천연 유기 화합물이다. 다양한 식물원으로부터 격리되어 있으며, 다양한 약리학적 성질로 연구되고 있다.
역사
아포시닌은 1883년 독일의 약리학자 오스왈드 슈미데베르크에 의해 처음 설명되었고, 1908년 [1]호레이스 피네모레에 의해 캐나다산 삼나무 뿌리(아포시넘 카나비눔)에서 처음으로 고립되었다.[2] 그 당시 이 식물은 부종과 심장 질환에 대한 알려진 효과로 이미 사용되었다. 1971년 아포시닌은 히말라야 서부의 높은 고도에서 자라는 작은 식물인 피크로히자 쿠로아로부터도 격리되었다. P. 쿠로아는 간 및 심장 질환, 황달, 천식 치료제로 오랫동안 사용되었다. 1990년에 Simons 등은 능동적으로 안내된 격리 절차를 사용하여 아포시닌을 약리학적으로 유용한 수준으로 격리시켰다. 아포시닌이 관찰한 항염증 능력은 체내에 활성산소, 산소 이온, 과산화물이 생기는 것을 선택적으로 예방할 수 있는 능력이 작용한 것으로 입증됐다. 아포시닌은 그 이후 질병 퇴치 능력과 용도를 결정하는 데 도움을 주기 위해 광범위하게 연구되어 왔다.[citation needed]
물리적 성질
아포시닌은 115 °C의 녹는점과 희미한 바닐라 냄새를 가진 고체다. 뜨거운 물, 알코올, 벤젠, 클로로포름, 에테르 등에 용해된다.[citation needed]
행동 방식
NADPH 산화효소는 O를2 효과적으로 과산화수소(O2–•)로 감소시키는 효소로 면역체계가 박테리아와 곰팡이를 죽이는 데 사용할 수 있다. 아포시닌은 NADPH 산화효소 활성을 억제하는 물질로, 인간 백혈구 또는 중성미자 그라눌로세포에서 과산화수소의 생성을 막는 데 효과적이다. 그러나 그것은 혈소판 또는 과립세포의 다른 방어 역할을 방해하지 않는다. 아포시닌의 억제 선택성 때문에, 아포시닌은 면역체계의 다른 측면에 간섭하지 않고 NADPH 산화효소의 억제제로 널리 사용될 수 있다.[citation needed]
아포시닌은 신간질세포의 막에 걸친 양성자 유동에 의한 이온 활성화가 과산화 NADPH 산화효소 생성과 결합되는지 여부를 결정하기 위해 사용되었다. 아포시닌은 세포에 도입되어 과산화수소의 생산을 완전히 차단하였으며, 양성자 유출이 NADPH 산화효소의 활성화에 원인이 있다고 판단하는데 핵심적인 성분이었다.[3]
아포시닌의 작용 메커니즘은 이해되지 않는다. 실험 연구에서 아포시닌은 디아포시닌을 약하게 하고 형성하는 것으로 나타났다.[4] 디아포시닌은 반응성 산소종과 항염증 성질을 감소시키는 데 유익한 효과가 있는 것으로 보이지만, 아직 생물학적으로 관련성이 있는 분자로 나타나지는 않고 있다.[5] 아포시닌의 바이오트랜스 형성은 주로 글리코실린 형태의 아포시닌으로 이어진다. 실험 조건에서 형성되는 또 다른 분자는 니트로아포시닌이다.[6]
리서치
아포시닌에 대한 소규모 초기 임상시험은 2011년[7] 만성폐쇄성폐질환(COPD), 2012년[8] 천식에 대해 실시됐지만 더 이상 진행되지 않았다.
다른 예비 임상 전 연구는 다음을 포함한다.
- 반관절성: 중성미자는 콜라겐 유도 관절염의 병원생성과 관절염의 염증을 유발하는 메커니즘의 주요 성분이다. 아포시닌의 작용은 염증이 시작되기 전에 그러한 세포의 존재를 감소시키지만 이미 존재하는 염증을 되돌릴 수는 없다.[9]
- 장 질환: 쥐의 아포시닌 치료는 염증과 관련된 골막록시디제의 효소 활성뿐만 아니라 결장의 손상을 줄이는 것으로 입증되었다. 또한 아포시닌은 대장의 대식세포와 다형핵 백혈구의 수를 감소시켰다.[10]
- 반독성: 아포시닌, 안드로신 등의 글루코사이드 성분이 기니피그의 기관지폐쇄를 예방하는 천식 치료를 위해 조사되고 있다. 아포시닌의 반독성 품질은 특정 염증 작용에 대한 간섭에서 나온다고 여겨진다.[11]
- 동맥경화증: 아포시닌은 NADPH 산화효소 활성의 활동을 막기 위해 아테롬성 동맥경화증의 치료에 사용되어 활성 산소종의 생성을 중단시킨다. 사실상, 이러한 억제는 내피세포에서 질병의 시작을 멈추게 한다.[11]
- 패밀리아 ALS: 아포시닌은 돌연변이 생쥐의 수명을 연장시켰고, 유전성 근위축성 측경화증(ALS, 또는 루게릭병)을 앓고 있는 일부 사람들에게서 발견된 유전적 결함인 과산화질소 분해효소 1(SOD1) 유전자로 배양된 세포 라인의 글리알 세포 독성을 감소시켰다. 연구자들은 이러한 이점이 SOD1에 대해 NADPH 산화효소 유래 O2• 생산을 위한 자체 조절 리독스 센서로서 새롭게 발견된 역할에서 기인한다고 믿는다. 쥐의 발견은 유전성 ALS에 대한 새로운 약물 목표를 가리킬 수 있다.[12]
- 피부 줄기세포: 아포시닌은 콜라겐 17의 합성을 촉진하고 이를 통해 줄기세포에서 파생된 모세포의 생존을 증가시킨다.[13]
참조
- ^ Paech, K, 트레이시, M.V(2012-12-06).Acetovanillone.를 대신하여 서명함. 410–1.아이 에스비엔 9783642649585. 드 스티븐스, 조지의;면적 5,773㎢, F.F(1955년)."자연 Phenylpropane 상품".Paech, K, 트레이시, M.V(eds.)에서.Moderne Methoden Pflanzenanalyse/근대 콘텐츠 발전소 분석이다.Springer-Verlag 베를린 하이델베르크.를 대신하여 서명함. 392–427. doi:10.1007/978-3-642-64958-5_10.아이 에스비엔 978-3-642-64958-5.
- ^ Horace, Finnemore (1908). "The Constituents of Canadian Hemp. Part I. Apocynin". Journal of the Chemical Society. 93 (2): 1513–9. doi:10.1039/ct9089301513. Retrieved 10 April 2014.
- ^ Li N, Zhang G, Yi FX, Zou AP, Li PL (2005). "Activation of NAD(P)H oxidase by outward movements of H+ ions in renal medullary thick ascending limb of Henle". American Journal of Physiology. Renal Physiology. 289 (5): F1048–56. doi:10.1152/ajprenal.00416.2004. PMID 15972387.
- ^ Luchtefeld, Ron; Dasari, Mina S.; Richards, Kristy M.; Alt, Mikaela L.; Crawford, Clark F. P.; Schleiden, Amanda; Ingram, Jai; Hamidou, Abdel Aziz Amadou; Williams, Angela; Chernovitz, Patricia A.; Sun, Grace Y.; Luo, Rensheng; Smith, Robert E. (2008). "Synthesis of Diapocynin". Journal of Chemical Education. 85 (3): 411. Bibcode:2008JChEd..85..411D. doi:10.1021/ed085p411.
- ^ Chandasana H, Chhonker YS, Bala V, Prasad YD, Chaitanya TK, Sharma VL, Bhatta RS (2015). "Pharmacokinetic, bioavailability, metabolism and plasma protein binding evaluation of NADPH-oxidase inhibitor apocynin using LC-MS/MS". Journal of Chromatography B. 985: 180–8. doi:10.1016/j.jchromb.2015.01.025. PMID 25682338.
- ^ Babu S, Raghavamenon AC, Fronczek FR, Uppu RM (2009). "4-Hydr-oxy-3-meth-oxy-5-nitro-aceto-phenone (5-nitro-apocynin)". Acta Crystallographica E. 65 (Pt 9): o2292–3. doi:10.1107/S160053680903390X. PMC 2969931. PMID 21577684.
- ^ ClinicalTrials.gov의 "COPD 환자의 호기 호흡 응축수에서 과산화수소 및 질산염 감소" 임상시험 번호 NCT01402297
- ^ Stefanska J, Sarniak A, Wlodarczyk A, Sokolowska M, Pniewska E, Doniec Z, Nowak D, Pawliczak R (2012). "Apocynin reduces reactive oxygen species concentrations in exhaled breath condensate in asthmatics". Experimental Lung Research. 38 (2): 90–9. doi:10.3109/01902148.2011.649823. PMID 22296407. S2CID 207441506.
- ^ 'T Hart BA, Simons JM, Knaan-Shanzer S, Bakker NP, Labadie RP (1990). "Antiarthritic activity of the newly developed neutrophil oxidative burst antagonist apocynin". Free Radical Biology & Medicine. 9 (2): 127–31. doi:10.1016/0891-5849(90)90115-Y. PMID 2172098. INIST:19326251.
- ^ Palmen, M.J.H.J.; Beukelman, C.J.; Mooij, R.G.M.; Pena A.S.; van Rees, E.P. (1995). "Anti-inflammatory effect of apocynin, a plant-derived NADPH oxidase antagonist, in acute experimental colitis". The Netherlands Journal of Medicine. 47 (2): 41. doi:10.1016/0300-2977(95)97051-P.
- ^ a b Van den Worm E, Beukelman CJ, Van den Berg AJ, Kroes BH, Labadie RP, Van Dijk H (2001). "Effects of methoxylation of apocynin and analogs on the inhibition of reactive oxygen species production by stimulated human neutrophils". European Journal of Pharmacology. 433 (2–3): 225–30. doi:10.1016/S0014-2999(01)01516-3. PMID 11755156.
- ^ Harraz MM, Marden JJ, Zhou W, Zhang Y, Williams A, Sharov VS, Nelson K, Luo M, Paulson H, Schöneich C, Engelhardt JF (2008). "SOD1 mutations disrupt redox-sensitive Rac regulation of NADPH oxidase in a familial ALS model". The Journal of Clinical Investigation. 118 (2): 659–70. doi:10.1172/JCI34060. PMC 2213375. PMID 18219391.
- ^ Liu N, Matsumura H, Kato T, Ichinose S, Takada A, Namiki T, Asakawa K, Morinaga H, Mohri Y, De Arcangelis A, Geroges-Labouesse E, Daisuke Nanba D, Nishimura EK (2019). "Stem cell competition orchestrates skin homeostasis and ageing". Nature. 568 (7752): 344–350. doi:10.1038/s41586-019-1085-7. PMID 30944469. S2CID 92997308.


