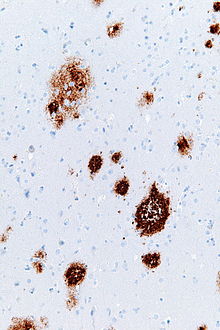
아밀로이드 플라크
Amyloid plaques아밀로이드 플라크(신경성 플라크, Aβ 플라크 또는 노인성 플라크라고도 함)는 [1][2][3][4]주로 뇌의 회백질에서 아밀로이드 베타(Aβ) 단백질의 세포외 퇴적물이다.퇴행성 신경 요소 및 풍부한 미세글리아와 성세포는 아밀로이드 플라크와 연관될 수 있다.노화(노화)의 결과로 뇌에 생기는 플라크도 있지만, 많은 플라크와 신경섬유 엉킴은 알츠하이머병의 [5]특징입니다.아밀로이드 플라크의 비정상적인 신경산염은 종종 부풀어 오른 축삭과 수상돌기이다.신경계에는 다양한 세포와 세포 부스러기가 포함되어 있으며, 그들 중 다수는 신경섬유 [3]엉킴의 초미세 구조 요소인 특징적인 쌍 나선형 필라멘트를 포함합니다.플라크는 형태와 크기가 매우 다양하며, Aβ에 대해 면역이 유지되는 조직 부분에서 평균 플라크 면적이 400-450 평방 마이크로미터(μm²)인 로그 정규 크기 분포 곡선을 구성한다.종종 Aβ의 [4]확산 퇴적물로 구성되는 가장 작은 플라크(200µm² 미만)[6]는 특히 많다.플라크의 겉보기 크기는 플라크 검출에 사용되는 얼룩의 종류와 현미경으로 [4]분석하기 위해 플라크가 통과하는 평면에 의해 영향을 받습니다.플라크는 Aβ가 올리고머와 더 긴 중합체로 잘못 접혀 집적될 때 형성되며, 후자는 아밀로이드의 [7]특징이다.잘못 접히고 응집된 Aβ는 특히 올리고머 [8]상태에서 신경독성으로 생각된다.
역사
1892년, Paul Blockq와 Gheorghe Marinescu는 [9][10]회백질에서 플라크의 존재를 처음으로 묘사했다.그들은 이 명판을 '신경교 경화증의 결절'이라고 불렀다.1898년, 에밀 레들리치는 세 명의 환자에게서 명판을 보고했는데, 그 중 두 명은 임상적으로 [11]치매가 확인된 상태였다.레들릭은 플라크가 밀레 씨앗과 비슷하다고 생각했기 때문에 플라크를 묘사하기 위해 '유두경화증'이라는 용어를 사용했고, 그는 처음으로 그 병변을 '플라크'[4]라고 불렀다.20세기 초, 오스카 피셔는 악티노마이세스 '드루젠'과의 유사성에 주목하여 퇴행성 과정을 '드루시게 네크로세'[12]라고 부르도록 만들었다.알로이스 알츠하이머는 1906년 [13]발표에서 치매와 플라크의 연관성을 최초로 설명한 것으로 종종 알려져 있지만, 이 짧은 보고서는 주로 신경섬유 엉킴에 초점을 맞췄고 플라크는 짧게만 [4]언급되었다.알츠하이머의 플라그에 대한 최초의 실질적인 설명은 [12]1911년에 나타났다.반대로, Oscar Fischer는 1907년, 1910년,[12] 1912년에 플라크와 치매에 대한 일련의 포괄적인 조사를 발표했다.1911년까지 맥스 빌쇼스키는 플라그 퇴적물의 아밀로이드 성질을 제안했다.이것은 나중에 폴 디브리에 의해 확인되었는데, 그는 콩고 레드 색소로 얼룩진 플라크가 [15]일반적으로 아밀로이드의 특징인 복굴절의 [14]광학적 특성을 나타낸다는 것을 보여주었다.1911년, Teofil Simchowicz는 나이든 [16][17][18]사람들의 뇌에 자주 존재하는 것을 나타내기 위해 '노인 플라크'라는 용어를 도입했다.1968년 게리 블레드, 버나드 톰린슨, 마틴 로스의 정량적 분석 결과 노인성 플라크와 [19]치매의 연관성이 확인되었다.Henryk Wisniewski와 Robert Terry는 1973년에 비정상적인 신경 과정을 포함하는 플라크(neuritic prakes)를 지정하기 위해 '뉴라이트([20]neurites)'1984년과 1985년의 중요한 발전은 플라크의 [21][22][23]코어를 형성하는 단백질로 Aβ를 식별한 것이다.이 발견은 플라크, 특히 Aβ에 대한 항체를 연구하기 위한 새로운 도구의 생성으로 이어졌고, 알츠하이머병에 [4]대한 잠재적 치료법의 개발을 위한 분자 목표를 제시했습니다.Aβ의 아미노산 배열에 대한 지식은 또한 과학자들이 상염색체 우성 알츠하이머병을 일으키는 유전자 돌연변이를 발견할 수 있게 해주었고, 이 모든 것은 Aβ가 [24][25][26]뇌에서 응집될 가능성을 증가시켰다.
아밀로이드 베타 생성
아밀로이드 베타(Aβ)는 [27]Aβ-프리서 단백질이라고 불리는 더 긴 부모 단백질로부터 방출되는 작은 단백질로, 대부분 40 또는 42개의 아미노산 길이이다.APP는 체내 여러 종류의 세포에 의해 생성되지만, 특히 뉴런에 풍부하다.이것은 단일 패스 막 통과 단백질, 즉 세포막을 [28]한 번 통과합니다.APP의 Aβ 세그먼트는 일부는 막 안에 있고 일부는 막 밖에 있다.Aβ를 해방시키기 위해 APP는 두 가지 효소에 의해 순차적으로 분해된다. 첫째, 막 밖에서 베타 시크리테아제(또는 β-아밀로이드 시크리테아제(BACE)), 둘째, [28]막 내에서 효소 복합체인 감마 시크리테아제(γ-시크리테아제)이다.이러한 분비효소의 순차적 작용은 세포외[29][28] 공간으로 방출되는 Aβ 단백질 파편을 발생시킨다. Aβ의 방출은 시냅스의 [25]활성에 의해 증가한다.길이 40 또는 42의 아미노산인 Aβ펩타이드와 더불어 몇 가지 덜 풍부한 Aβ 단편도 [30][31]생성된다.Aβ는 다양한 방법으로 화학적으로 변형될 수 있으며 단백질의 길이와 화학적 변형은 Aβ의 응집 경향과 [4]독성 모두에 영향을 미칠 수 있다.
신분증

아밀로이드 플라크는 은색 얼룩, 콩고 적색, 티오플라빈, 크레실 바이올렛, PAS 반응 및 발광 복합 올리고티오펜(LCOs)[32][4][33]을 포함한 다양한 염색 기술을 사용하여 광현미경으로 볼 수 있다.이러한 방법들은 종종 플라크의 다른 구성 요소들을 염색하고, 민감도에서[4][34] 다양하며, 또한 Aβ 또는 병변의 다른 구성 요소들에 대한 항체로 면역 조직 화학적으로 시각화 될 수 있다.면역 조직 화학적 얼룩은 민감하고 플라크와 관련된 항원에 특이적이기 때문에 특히 유용합니다.
구성.
아밀로이드 플라크로 구성된 Aβ 퇴적물은 크기와 [3][4]외관이 다양하다.광현미경 아래, 그것들은 지름이 몇 미크론인 작고 희박한 축적에서부터 훨씬 더 큰 밀도가거나 확산된 질량에 이르기까지 다양하다.이른바 '고전적 플라크'는 밀도가 다소 낮은 Aβ의 [4]코로나로 둘러싸인 콤팩트한 Aβ-아밀로이드 코어로 구성됩니다.고전적인 플라크는 또한 활성화된 성상세포와 미세글리아와 [3][4]함께 많은 다른 유형의 뉴런에서 파생된 비정상적이고 부풀어 오른 신경세포 과정(뉴라이트)을 포함한다.비정상적인 신경염과 활성화된 신경교세포는 대부분의 확산성 플라크의 전형적인 형태가 아니며, 확산성 침전물은 [35]플라크의 발달 초기 단계라고 제안되어 왔다.
해부학적 분포
디트마르 탈과 그의 동료들 1단계에서 알츠하이머 병 patients[36][37]의 두뇌 속에서 액자가 신피질에 표시되며, 2단계에서, 그들은 allocortex, 해마의 형성과 편도선에 신경체 표시되며, 단계는 3에서 기저 핵 및 간뇌 영향을 받는다;단계는 4에서 액자가에 나타나는 플라크 형성의 단계의 시퀀스 제안해 왔다. 중뇌5단계에서는 종아리 및 소뇌에 나타납니다.따라서 알츠하이머 말기 질환에서는 뇌의 대부분 부분에서 플라크가 발견될 수 있다.그것들은 [4]척수에서 흔치 않다.
형성 및 확산
Aβ의 정상적인 기능은 확실하지 않지만, 플라크는 단백질이 잘못 접혀서 분자 템플릿('씨뿌리기')[38] 과정에 의해 뇌에 축적되기 시작할 때 발생한다.Mathias Jucker와 Lary Walker는 이 과정을 해면상뇌병증 또는 프리온 [38][39]질환으로 알려진 질병에서 프리온의 형성과 확산에 비유했다.프리온 패러다임에 따르면, 특정 단백질은 베타 시트 2차 구조가 풍부한 모양으로 잘못 접힌다.이 상태에서, 그들은 같은 유형의 다른 단백질들이 동일한 비정상적인 베타 시트 풍부한 [40]구조를 채택하도록 한다.잘못 접힌 단백질은 서로 달라붙어 결국 서로 결합하는 올리고머를 형성하여 성숙한 [7][41]플라크의 전형적인 아밀로이드 섬유를 만듭니다.
질병에 대한 관여
풍부한 Aβ 플라크는 응집된 타우 단백질로 구성된 신경섬유 엉킴과 함께 알츠하이머병의 [25][42]신경병리학적 진단에 필요한 두 가지 병변이다.비록 신경섬유 엉킴의 수가 플라크의 수보다 치매의 정도와 더 강하게 상관하지만, 유전학적 및 [24]병리학적 발견은 Aβ가 알츠하이머병의 위험, 발병, 진행에 중심적인 역할을 한다는 것을 보여준다.특히 중요한 것은 Aβ42로 알려진 Aβ의 긴 (42개의 아미노산) 종이다.40-아미노산 형태(Aβ40)에 대한 Aβ42의 비율의 증가뿐만 아니라, Aβ의 높은 수치는 알츠하이머병의 [43]병인 형성에 있어 중요한 초기 사건이다.
최근까지 알츠하이머 진단을 위해서는 뇌조직의 플라크와 엉킴을 현미경으로 분석해야 했다.[44]하지만, Aβ 플라크 (뇌 Aβ-아밀로이드 혈관증과 함께)는 이제 살아있는 피험자의 뇌에서 검출될 수 있다.이것은 혈류에 [45]주입된 후 뇌의 Aβ 퇴적물에 선택적으로 결합하는 방사성 라벨제를 준비함으로써 이루어진다.리간드는 혈액-뇌 장벽을 통과하여 응집된 Aβ에 부착되며, 뇌 내에서의 리간드는 양전자 방출 단층촬영(PET)에 의해 평가된다.또한 뇌척수액 [46][47]중 Aβ 및 타우 단백질의 양을 측정함으로써 플라크 및 엉킴의 존재를 추정할 수 있다.
발생.
나이가 [48]들수록 뇌에 플라크가 생길 확률이 높아진다.60세(10%)부터 80세(60%)까지 노인성 플라크가 있는 사람의 비율은 선형적으로 증가한다.여성은 [49][48]남성보다 약간 더 플라크가 있을 가능성이 높다.또한 플라크와 알츠하이머병은 트리소미-21(다운증후군)[1][50]을 가진 노년층에서 더 흔하다.이는 APP 유전자가 [50]다운증후군에 3개의 복사본으로 존재하는 21번 염색체에 있기 때문에 Aβ의 과잉 생산으로 인해 발생하는 것으로 생각된다.
아밀로이드 플라크는 조류에서 [4]유인원에 이르는 비인간 종의 노화 뇌에서 자연적으로 발생한다.인간과 가장 가까운 생물학적 친척인 비인간 영장류에서 플라크는 지금까지 [51]조사된 모든 종에서 발견되었다.그러나 신경섬유 엉킴은 드물고 알츠하이머병의 [52]완전한 신경병리학과 함께 치매에 걸린 비인간종은 아직 발견되지 않았다.
조사.
연구는 플라크의 생화학적, 세포학적, 그리고 염증적 특성을 이해하도록 지시되어 왔다, 어떻게 플라크가 뇌에서 발생하고 증식하는지를 결정하고, 유전적이고 환경적인 위험 인자를 식별하며, 살아있는 뇌에서 그것들을 감지하는 방법을 발견하고, 예방하거나 기억하기 위한 치료 전략을 개발한다.그것들을 [4]제거한다.아밀로이드 플라크의 형성과 증식에 대한 연구는 유전자 변형 마우스 [53][54]모델의 개발로 가속화되었다.몇 가지 한계에도 불구하고, 이러한 모델들은 또한 새로운 치료 전략을 발견하는 데 기여했다.예를 들어, Aβ 수치와 뇌의 플라크 수를 감소시키는 점점 더 다양한 치료법이 트랜스제닉 설치류 모델의 도움을 받아 확인되었다.이러한 전략에는 면역요법 접근법과 [25]APP에서 Aβ를 방출하는 분비효소의 억제제가 포함된다.그러한 치료법은 현재 알츠하이머병의 [43][25]치료를 위해 임상적으로 평가되고 있다.지금까지의 연구 결과는 치매 환자의 플라크 제거가 거의 도움이 되지 않는다는 것을 보여주는데, 아마도 알츠하이머병의 징후와 증상이 처음 [25][24]나타날 때 뇌가 심각하게 손상되었기 때문일 것이다.Aβ를 고밀도 플라크 [55][7]코어에 캡슐화함으로써 실제로 마이크로글리아 매개 플라크 형성이 유리할 수 있다.미세글리아 수용체 TREM2에 대한 돌연변이는 플라크에 대한 미세글리아 반응을 감소시키는 것으로 밝혀졌으며, 플라크는 더 독성이 강한 [56]상태를 보이는 것으로 보인다.많은 연구자들은 타우파시와 알츠하이머병의 치매를 늦추거나 예방하기 위해서는 Aβ 응집과 플라크 형성의 초기 억제가 필요하다고 믿는다.다른 연구는 종종 플라크와[57] 관련된 염증을 이해하거나 플라크 형성과 알츠하이머 [58][59]질환의 환경, 생리학적, 유전적 위험 인자를 식별하기 위한 것이다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b Cras P; Kawai M; Lowery D; Gonzalez-DeWhitt P; Greenberg B; Perry G (September 1991). "Senile plaque neurites in Alzheimer disease accumulate amyloid precursor protein". Proceedings of the National Academy of Sciences of the United States of America. 88 (17): 7552–6. Bibcode:1991PNAS...88.7552C. doi:10.1073/pnas.88.17.7552. PMC 52339. PMID 1652752.
- ^ Purves, Dale; Augustine, George J.; Fitzpatrick, David; Hall, William C.; LaManita, Anthony-Samuel; White, Leonard E.; Mooney, Richard D.; Platt, Michael L. (2012). Neuroscience (5th ed.). Sunderland, MA: Sinauer Associates. p. 713. ISBN 978-0-87893-695-3.
- ^ a b c d Dickson DW (1997). "The pathogenesis of senile plaques". J Neuropathol Exp Neurol. 56 (4): 321–339. doi:10.1097/00005072-199704000-00001. PMID 9100663.
- ^ a b c d e f g h i j k l m n o Walker LC (2020). "Aβ plaques". Free Neuropathology. 1 (31): 31. doi:10.17879/freeneuropathology-2020-3025. PMC 7745791. PMID 33345256.
- ^ Ballard, C; Gauthier, S; Corbett, A; Brayne, C; Aarsland, D; Jones, E (19 March 2011). "Alzheimer's disease". Lancet. 377 (9770): 1019–31. doi:10.1016/S0140-6736(10)61349-9. PMID 21371747. S2CID 20893019.
- ^ Hyman BT; West HL; Rebeck GW; Buldyrev SV; Mantegna RN; Ukleja M; Havlin S; Stanley HE (1995). "Quantitative analysis of senile plaques in Alzheimer disease: observation of log-normal size distribution and molecular epidemiology of differences associated with apolipoprotein E genotype and trisomy 21 (Down syndrome)". Proceedings of the National Academy of Sciences of the United States of America. 92 (8): 3586–3590. Bibcode:1995PNAS...92.3586H. doi:10.1073/pnas.92.8.3586. PMC 42212. PMID 7724603.
- ^ a b c Röhr D, Boon BD, et al. (December 2020). "Label-free vibrational imaging of different Aβ plaque types in Alzheimer's disease reveals sequential events in plaque development". Acta Neuropathologica Communications. 8 (1): 222. doi:10.1186/s40478-020-01091-5. PMC 7733282. PMID 33308303.
- ^ Haass C; Selkoe DJ (2007). "Soluble protein oligomers in neurodegeneration: lessons from the Alzheimer's amyloid beta-peptide". Nat Rev Mol Cell Biol. 8 (2): 101–112. doi:10.1038/nrm2101. PMID 17245412. S2CID 32991755.
- ^ Blocq, Paul; Marinesco, Georges (1892). Sur les lesions et la pathogenie de l'epilepsie dite essentielle. pp. 445–6. OCLC 492619936.
- ^ Buda O; Arsene D; Ceausu M; Dermengiu D; Curca GC (January 2009). "Georges Marinesco and the early research in neuropathology". Neurology. 72 (1): 88–91. doi:10.1212/01.wnl.0000338626.93425.74. PMID 19122036. S2CID 45428057.
- ^ Redlich E (1898). "Ueber miliare Sklerose der Hirnrinde bei seniler Atrophie". Jahrbücher für Psychiatrie und Neurologie. 17: 208–216.
- ^ a b c Goedert M (2009). "Oskar Fischer and the study of dementia". Brain. 132 (4): 1102–1111. doi:10.1093/brain/awn256. PMC 2668940. PMID 18952676.
- ^ Alzheimer, A (1907). "Uber einen eigenartige Erkranung der Hirnrinde". Allgemeine Zeitschrift für Psychiatrie und Psychisch-Gerichtlich Medizin. 64: 146–8.
- ^ Divry P (1927). "Etude histo-chimique des plaques séniles". Journal Belge de Neurologie et de Psychiatrie. 9: 643–657.
- ^ Buxbaum JN; Linke RP (2012). "A molecular history of the amyloidoses". Journal of Molecular Biology. 421 (2–3): 142–159. doi:10.1016/j.jmb.2012.01.024. PMID 22321796.
- ^ 심초비치 T:Histologische Studien über die senile Demenz.위치: Nissl F., 알츠하이머 A. (Hrsg):Histologische und histopathologische Arbeiten die Groshirnrinde mit besonder Berüksichtigung der pathologischen Anatomie der Geisteskrankheiten.제나: G.피셔, 1911년, 페이지 267~444
- ^ Ohry A; Buda O (2015). "Teofil Simchowicz (1879-1957): the scientist who coined senile plaques in neuropathology". Romanian Journal of Morphology and Embryology. 56 (4): 1545–1548. PMID 26743308.
- ^ Grzybowski A; Pieta A; Pugaczewska M (2017). "Teofil Simchowicz (1879-1957)". Journal of Neurology. 264 (8): 1831–1832. doi:10.1007/s00415-017-8460-9. PMC 5533842. PMID 28315959.
- ^ Blessed G; Tomlinson BE; Roth M (1968). "The association between quantitative measures of dementia and of senile change in the cerebral grey matter of elderly subjects". British Journal of Psychiatry. 114 (512): 797–811. doi:10.1192/bjp.114.512.797. PMID 5662937.
- ^ Wisniewski, Henryk M.; Terry, Robert D. (1973). "Chapter 1: Reexamination of the pathogenesis of the senile plaque". In Zimmerman, H.M. (ed.). Progress in Neuropathology, Volume 2. Grune and Stratton. pp. 1–26. ISBN 978-0-808-90775-6.
- ^ Glenner GG; Wong CW (1984). "Alzheimer's disease: initial report of the purification and characterization of a novel cerebrovascular amyloid protein". Biochemical and Biophysical Research Communications. 120 (3): 885–890. doi:10.1016/s0006-291x(84)80190-4. PMID 6375662.
- ^ Glenner GG; Wong CW (1984). "Alzheimer's disease and Down's syndrome: sharing of a unique cerebrovascular amyloid fibril protein". Biochemical and Biophysical Research Communications. 122 (3): 1131–1135. doi:10.1016/0006-291x(84)91209-9. PMID 6236805.
- ^ Masters CL; Simms G; Weinman NA; Multhaup G; McDonald BL; Beyreuther K (1985). "Amyloid plaque core protein in Alzheimer disease and Down syndrome". Proceedings of the National Academy of Sciences USA. 82 (12): 4245–4249. Bibcode:1985PNAS...82.4245M. doi:10.1073/pnas.82.12.4245. PMC 397973. PMID 3159021.
- ^ a b c Walsh DM; Selkoe DJ (2020). "Amyloid beta-protein and beyond: the path forward in Alzheimer's disease". Current Opinion in Neurobiology. 61: 116–124. doi:10.1016/j.conb.2020.02.003. PMID 32197217. S2CID 214600892.
- ^ a b c d e f Long JM; Holtzman DM (2019). "Alzheimer Disease: An Update on Pathobiology and Treatment Strategies". Cell. 179 (2): 312–339. doi:10.1016/j.cell.2019.09.001. PMC 6778042. PMID 31564456.
- ^ Walker LC (2015). "Proteopathic Strains and the Heterogeneity of Neurodegenerative Diseases". Annual Review of Genetics. 50: 329–346. doi:10.1146/annurev-genet-120215-034943. PMC 6690197. PMID 27893962.
- ^ Selkoe, DJ (1999). "Chapter 19: Biology of β-amyloid precursor protein and the mechanism of Alzheimer disease". In Terry, RD; Katzman, R; Bick, KL; Sisodia, SS (eds.). Alzheimer Disease. Lippincott Williams and Wilkins. pp. 293–310. ISBN 0-7817-1503-2.
- ^ a b c Haass C; Kaether C; Thinakaran G; Sisodia S (2012). "Trafficking and proteolytic processing of APP". Cold Spring Harbor Perspectives in Medicine. 2 (5:a006270): a006270. doi:10.1101/cshperspect.a006270. PMC 3331683. PMID 22553493.
- ^ Suh YH; Checler F (September 2002). "Amyloid precursor protein, presenilins, and alpha-synuclein: molecular pathogenesis and pharmacological applications in Alzheimer's disease". Pharmacological Reviews. 54 (3): 469–525. doi:10.1124/pr.54.3.469. PMID 12223532. S2CID 86686003.
- ^ Dunys J; Valverde A; Checler F (2018). "Are N- and C-terminally truncated Aβ species key pathological triggers in Alzheimer's disease?". Journal of Biological Chemistry. 293 (40): 15419–15428. doi:10.1074/jbc.R118.003999. PMC 6177599. PMID 30143530.
- ^ Kummer MP; Heneka MT (2014). "Truncated and modified amyloid-beta species". Alzheimer's Research & Therapy. 6 (3): 28. doi:10.1186/alzrt258. PMC 4055046. PMID 25031638.
- ^ Lamy C, Duyckaerts C, Delaere P, et al. (1989). "Comparison of seven staining methods for senile plaques and neurofibrillary tangles in a prospective series of 15 elderly patients". Neuropathology and Applied Neurobiology. 15 (6): 563–78. doi:10.1111/j.1365-2990.1989.tb01255.x. PMID 2482455. S2CID 25220224.
- ^ Klingstedt T; Nilsson KPR (2012). "Luminescent conjugated poly- and oligo-thiophenes: optical ligands for spectral assignment of a plethora of protein aggregates". Biochemical Society Transactions. 40 (4): 704–710. doi:10.1042/BST20120009. PMID 22817720.
- ^ Mavrogiorgou P; Gertz HJ; Ferszt R; Wolf R; Bär KJ; Juckel G (December 2011). "Are routine methods good enough to stain senile plaques and neurofibrillary tangles in different brain regions of demented patients?" (PDF). Psychiatria Danubina. 23 (4): 334–9. PMID 22075733. Archived from the original (PDF) on 2017-08-11. Retrieved 2014-06-22.
- ^ Braak H; Thal DR; Ghebremedhin E; Del Tredici K (2011). "Stages of the pathologic process in Alzheimer disease: age categories from 1 to 100 years". Journal of Neuropathology and Experimental Neurology. 70 (11): 960–969. doi:10.1097/NEN.0b013e318232a379. PMID 22002422.
- ^ Thal DR; Rüb O; Orantes M; Braak H (2002). "Phases of Abeta-deposition in the human brain and its relevance for the development of AD". Neurology. 58 (12): 1791–1800. doi:10.1212/wnl.58.12.1791. PMID 12084879. S2CID 41133337.
- ^ Thal DR; Walter J; Saido TC; Fändrich M (2015). "Neuropathology and biochemistry of Aβ and its aggregates in Alzheimer's disease". Acta Neuropathologica. 129 (2): 167–182. doi:10.1007/s00401-014-1375-y. PMID 25534025. S2CID 19701015.
- ^ a b Jucker, M; Walker, LC (2013). "Self-propagation of pathogenic protein aggregates in neurodegenerative diseases". Nature. 501 (7465): 45–51. Bibcode:2013Natur.501...45J. doi:10.1038/nature12481. PMC 3963807. PMID 24005412.
- ^ Walker LC; Jucker M (2015). "Neurodegenerative diseases: Expanding the prion concept". Annual Review of Neuroscience. 38: 87–103. doi:10.1146/annurev-neuro-071714-033828. PMC 4803040. PMID 25840008.
- ^ Prusiner SB (1998). "Prions". Proceedings of the National Academy of Sciences USA. 95 (23): 13363–13383. Bibcode:1998PNAS...9513363P. doi:10.1073/pnas.95.23.13363. PMC 33918. PMID 9811807.
- ^ Eisenberg D; Jucker M (2015). "The amyloid state of proteins in human diseases". Cell. 148 (6): 1188–1203. doi:10.1016/j.cell.2012.02.022. PMC 3353745. PMID 22424229.
- ^ Nelson PT, Alafuzoff I, Bigio EH, et al. (2012). "Correlation of Alzheimer disease neuropathologic changes with cognitive status: a review of the literature". Journal of Neuropathology and Experimental Neurology. 71 (5): 362–381. doi:10.1097/NEN.0b013e31825018f7. PMC 3560290. PMID 22487856.
- ^ a b Findeis MA (November 2007). "The role of amyloid beta peptide 42 in Alzheimer's disease". Pharmacology & Therapeutics. 116 (2): 266–86. doi:10.1016/j.pharmthera.2007.06.006. PMID 17716740.
- ^ Thal DR, Ronisz A, Tousseyn T, et al. (2019). "Different aspects of Alzheimer's disease-related amyloid β-peptide pathology and their relationship to amyloid positron emission tomography imaging and dementia". Acta Neuropathologica Communications. 7 (1): 178. doi:10.1186/s40478-019-0837-9. PMC 6854805. PMID 31727169.
- ^ Mathis CA; Lopresti BJ; Ikonomovic MD; Klunk WE (2017). "Small-molecule PET tracers for imaging proteinopathies". Seminars in Nuclear Medicine. 47 (5): 553–575. doi:10.1053/j.semnuclmed.2017.06.003. PMC 5657567. PMID 28826526.
- ^ Ritchie C; Smailagic N; Noel-Storr AH; Ukoumunne O; Ladds EC; Martin S (2017). "CSF tau and the CSF tau/ABeta ratio for the diagnosis of Alzheimer's disease dementia and other dementias in people with mild cognitive impairment (MCI)". Cochrane Database of Systematic Reviews. 2017 (3): CD010803. doi:10.1002/14651858.CD010803.pub2. PMC 6464349. PMID 28328043.
- ^ Hansson O; Lehmann S; Otto M; Zetterberg H; Lewczuk P (2019). "Advantages and disadvantages of the use of the CSF Amyloid beta (Abeta) 42/40 ratio in the diagnosis of Alzheimer's Disease". Alzheimer's Research & Therapy. 11 (1): 34. doi:10.1186/s13195-019-0485-0. PMC 6477717. PMID 31010420.
- ^ a b Stam FC; Wigboldus JM; Smeulders AW (1986). "Age incidence of senile brain amyloidosis" (PDF). Pathology - Research and Practice. 181 (5): 558–562. doi:10.1016/S0344-0338(86)80149-2. PMID 3786248.
- ^ Franke, M (1976). "Statistische Untersuchungen über die senilen Drusen im menschlichen Gehirn / Thesen". Berlin, Germany: Neuropathologische Abteilung. Archived from the original on 2011-07-19.
- ^ a b Head E; Powell D; Gold BT; Schmitt FA (2012). "Alzheimer's Disease in Down Syndrome". European Journal of Neurodegenerative Disease. 1 (3): 353–364. PMC 4184282. PMID 25285303.
- ^ Heuer E; Rosen RF; Cintron A; Walker LC (2012). "Nonhuman primate models of Alzheimer-like cerebral proteopathy". Current Pharmaceutical Design. 18 (8): 1159–1169. doi:10.2174/138161212799315885. PMC 3381739. PMID 22288403.
- ^ Walker LC; Jucker M (2017). "The exceptional vulnerability of humans to Alzheimer's disease". Trends in Molecular Medicine. 23 (6): 534–545. doi:10.1016/j.molmed.2017.04.001. PMC 5521004. PMID 28483344.
- ^ Jucker M (2010). "The benefits and limitations of animal models for translational research in neurodegenerative diseases". Nature Medicine. 16 (11): 1210–1214. doi:10.1038/nm.2224. PMID 21052075. S2CID 30167302.
- ^ Myers A; McGonigle P (2010). "Overview of transgenic mouse models for Alzheimer's disease". Current Protocols in Neuroscience. 89 (1:e81): 1210–1214. doi:10.1002/cpns.81. PMID 31532917. S2CID 202024310.
- ^ Huang Y, Happonen KE (April 2021). "Microglia use TAM receptors to detect and engulf amyloid β plaques". Nature Immunology. 8 (1): 222. doi:10.1186/s40478-020-01091-5. PMC 7733282. PMID 33308303.
- ^ Shi, Yang; Holtzman, David M. (2018). "Interplay between innate immunity and Alzheimer's disease: APOE and TREM2 in the spotlight". Nature Reviews. Immunology. 18 (12): 759–772. doi:10.1038/s41577-018-0051-1. ISSN 1474-1733. PMC 6425488. PMID 30140051.
- ^ Heppner FL; Ransohoff RM; Becher B (2015). "Immune attack: the role of inflammation in Alzheimer disease". Nature Reviews Neuroscience. 16 (6): 358–372. doi:10.1038/nrn3880. PMID 25991443. S2CID 6116253.
- ^ De Strooper B; Karran E (2016). "The Cellular Phase of Alzheimer's Disease". Cell. 164 (4): 603–615. doi:10.1016/j.cell.2015.12.056. PMID 26871627.
- ^ Killin LOJ; Starr JM; Shiue IJ; Russ TC (2016). "Environmental risk factors for dementia: a systematic review". BMC Geriatrics. 16 (1): 175. doi:10.1186/s12877-016-0342-y. PMC 5059894. PMID 27729011.
추가 정보
- Jellinger KA (2005). "Neurodegenerative Erkrankungen (ZNS) - Eine aktuelle Übersicht" (PDF). Journal für Neurologie, Neurochirurgie und Psychiatrie. 6 (1): 9–18.
- Cruz L, Urbanc B, Buldyrev SV, et al. (July 1997). "Aggregation and disaggregation of senile plaques in Alzheimer disease". Proceedings of the National Academy of Sciences of the United States of America. 94 (14): 7612–6. Bibcode:1997PNAS...94.7612C. doi:10.1073/pnas.94.14.7612. PMC 23870. PMID 9207140.