알로스테릭 모듈레이터
Allosteric modulator약리학과 생화학에서, 알로스테릭 변조기는 자극에 대한 수용체의 반응을 바꾸기 위해 수용체에 결합하는 물질의 그룹이다. 벤조디아제핀 같은 것도 마약이다.[1] 알로스테릭 모듈레이터가 결합하는 부위(즉, 알로스테릭 부위)는 수용체의 내생 작용제가 결합하는 부위(즉, 정형외과적 부위)와 같지 않다. 조절기와 작용제는 둘 다 수용체 리간드라고 할 수 있다.[2]
알로스테릭 변조기는 양, 음 또는 중립의 세 가지 유형 중 하나일 수 있다. 양성형은 작용제가 수용체에 결합할 확률(즉, 친화력)을 증가시켜 수용체 반응을 증가시키거나, 수용체 활성화 능력(즉, 효능) 또는 둘 다 증가시켜 수용체 반응을 증가시킨다. 부정적인 유형은 작용제 친화력 및/또는 효능을 감소시킨다. 중립 형식은 작용제 활동에 영향을 미치지 않지만 다른 조절기가 고환 부지에 결합하는 것을 막을 수 있다. 어떤 조절기는 또한 신경작용제로서 작용한다.[2]
"알로스테릭"이라는 용어는 그리스어에서 유래되었다. 알로스는 "기타"를 의미하고 스테레오, "고체" 또는 "모양"을 의미한다. 이것은 "기타형"으로 번역될 수 있는데, 이것은 조절기가 수용체 기능에 영향을 미치는 조절기에 의해 발생하는 수용체 내의 순응적 변화를 나타낸다.[3]
소개
알로스테릭 조절기는 수용체에 작용하는 다른 물질의 친화력과 효능을 변화시킬 수 있다. 또한 조절기는 친화력을 증가시키거나 효능을 낮출 수도 있고 그 반대의 경우도 있다.[4] 친화력은 물질이 수용체에 결합하는 능력이다. 유효성은 수용체의 내생 작용제에 비해 수용체를 활성화하는 물질의 능력의 백분율로 주어지는 수용체를 활성화시키는 물질의 능력이다. 효능이 0이면 그 물질은 적수로 간주된다.[1]
내생적 작용제들이 결합하는 부위는 정관절개 부위로 명명된다. 변조기는 이 사이트에 바인딩되지 않는다. 그들은 다른 적절한 사이트에 바인딩되어 있고, 이 사이트들은 알로스테릭 사이트로 명명된다.[2] 결합 시 변조기는 일반적으로 수용체의 3차원 구조(즉, 순응)를 변화시킨다. 이것은 종종 정관 부위의 변화를 유발할 것이며, 이것은 작용제 결합의 효과를 바꿀 수 있다.[4] 또한 알로스테릭 조절기는 수용기의 정상적인 구성 중 하나를 안정화할 수 있다.[5]
실제로 변조는 복잡할 수 있다. 조절기는 부분적인 작용제로서 기능할 수 있는데, 이는 작용제 효과를 내기 위해 조절하는 작용제가 필요하지 않다는 것을 의미한다.[6] 또한 변조는 서로 다른 작용제들의 친화력이나 효과에 균등하게 영향을 미치지 않을 수 있다. 동일한 작용을 가져야 하는 서로 다른 작용제 집단이 동일한 수용체에 결합한다면, 그 작용제들은 일부 조절제들에 의해 똑같이 변형되지 않을 수도 있다.[4]
반
모듈레이터는 수용체 내에서 3가지 효과를 가질 수 있다. 하나는 수용기를 활성화할 수 있는 능력이나 무능력(2가지 가능성)이다. 나머지 두 가지는 작용제 친화력과 효능이 있다. 증가, 감소 또는 영향을 받지 않은 채로 둘 수 있다(3 및 3 가능성). 이것은 17개의 가능한 모듈레이터 조합을 산출한다.[4] 중립 모듈레이터 유형도 포함되는 경우 18(=2*3*3)이 있다.
모든 실무적 고려사항에서 이러한 조합은 5개[4] 등급과 1개 중립으로 일반화할 수 있다.
- 양성 알로스테릭 변조기(PAM)는 작용제 친화력 및/또는 유효성을 증가시킨다.[4] 임상적 예로는 GABA 수용체를A 변조하는 디아제팜, 알프라졸람, 클로르디아제폭사이드 등 벤조디아제핀과 칼슘 감지 수용체를 변조하는 시나칼세트 등이 있다.[7]
- 음의 알로스테릭 변조기(NAM) 저작용제 친화성 및/또는 유효성.[4]마라비록은 CCR5를 변조하는 약이다. 페노밤, 라세글루란트, 쌍끌이란트는 실험용 GRM5 조절기다.[7]
- NAM-agonist들은 NAMs처럼 일하지만, 또한 그들이 만드는 고통과 고통 없는 고통의 존재로서도 일한다.[4]
- 중성 알로스테릭 변조기는 작용제 활성에는 영향을 주지 않지만 수용체에 결합하고 PAM과 다른 조절기가 동일한 수용체에 결합하는 것을 방지하여 변조를 억제한다.[4] 중성 조절기는 무성 알로스테릭 조절기(SAM)[6] 또는 중성 알로스테릭 리간드(NAL)라고도 한다. 그 예로 GRM5에 결합하는 연구용 화학물질인 5메틸-6-(페닐시닐)-피리딘(5MPEP)이 있다.[8]
메커니즘
알로스테리 변조의 현장이 될 수 있는 수용체 상의 다양한 위치와 그들을 둘러싼 규제 현장이 부족하기 때문에 알로스테리 변조기는 매우 다양한 메커니즘에서 작동할 수 있다.[citation needed]
변조 바인딩
일부 알로스테릭 변조기는 대상 수용체에 순응적인 변화를 유도하여 수용체 작용제의 결합 친화력 및/또는 유효성을 증가시킨다.[2] 그러한 조절기의 예로는 GABAA 수용체 양성 알로스테리릭 조절기인 벤조디아제핀과 바비투라테스가 있다. 디아제팜과 같은 벤조디아제핀은 GABAA 수용체 이온 채널의 α와 α 서브유닛 사이에 결합하여 채널 개방 주파수를 증가시키지만 각 개방의 지속시간은 증가시키지 않는다. 페노바르비탈과 같은 바비투레이트는 β 도메인을 결합하고 각 개구부의 지속시간을 증가시키지만 빈도는 증가시키지 않는다.[9]
변조 언바인딩
일부 조절기는 작용제 결합 상태와 관련된 순응적 변화를 안정화시키기 위해 작용한다. 이는 수용체가 활성 순응 상태에 있을 확률을 증가시키지만, 수용체가 다시 비활성 상태로 전환되는 것을 막지는 못한다. 활성 상태로 남을 확률이 높아지면 수용체는 작용제를 더 오래 결합하게 된다. 아니라세탐과 CX614에 의해 변조된 AMPA 수용체는 더 느리게 비활성화되고 더 많은 전체 양이온 이송을 촉진한다. 이는 글루탐산염 결합 부위를 포함하는 "클램 쉘"의 뒷면에 아나세탐 또는 CX614를 결합하여 AMPA 수용체 활성화와 관련된 폐쇄적 순응을 안정화함으로써 달성될 가능성이 높다.[5][9]
감쇠화 방지
수용기의 감소를 방지함으로써 전체적인 신호를 증가시킬 수 있다. 감응화는 작용제의 존재에도 불구하고 수용체가 활성화되는 것을 막는다. 이것은 종종 반복적이거나 강한 작용제 노출에 의해 발생한다. 이러한 현상을 제거하거나 감소시키면 수용체의 전반적인 활성화가 증가한다. AMPA 수용체는 리간드 결합 영역 조광기 인터페이스의 붕괴를 통해 감응화에 취약하다. 사이클로티아지드(Cyclothiazide)는 이 인터페이스를 안정화하고 느리게 감쇠하는 것으로 나타났으며, 따라서 양성 알로스테릭 모듈레이터로 간주된다.[5]
활성/비활성 정합성 안정화
조절기는 작용제의 결합에 영향을 주기보다는 수용기를 직접 조절할 수 있다. 수용체의 결합 순응을 안정화하는 것과 마찬가지로, 이 메커니즘에서 작용하는 변조기는 활성 또는 비활성 상태와 관련된 순응을 안정화한다. 이는 수용체가 안정화된 상태에 부합할 확률을 증가시키고, 그에 따라 수용체의 활동을 조절한다. 칼슘 감지 수용체는 pH를 조절해 이런 식으로 조절할 수 있다. pH가 낮을수록 비활성 상태의 안정성이 높아져 수용체의 민감도가 낮아진다. pH 조정과 관련된 전하의 변화는 불활성화를 선호하는 수용체에 순응적 변화를 야기하는 것으로 추측된다.[10]
작용제와의 상호작용
부분 및 전체 작용제의 친화력만 증가시키는 조절기는 낮은 작용제 농도(즉, 용량-반응 곡선의 기울기와 고원이 낮은 농도로 이동)에서 최대 유효성에 더 빨리 도달할 수 있다.[4]
효능이 증가하는 조절기는 부분작용제들의 효능을 극대화시킨다. 완전작용제는 이미 수용체를 완전히 활성화시켜 조절기가 최대 효능에 영향을 주지 않고 반응 곡선을 다소 낮은 작용제 농도로 이동시킨다.[4]
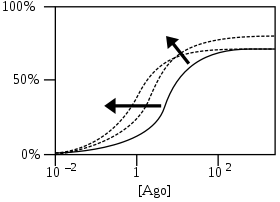
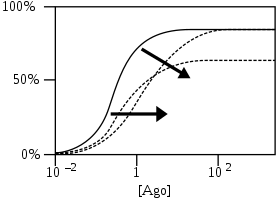
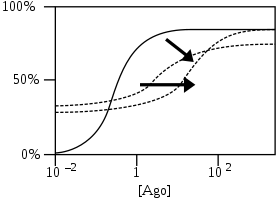
- 로그 작용제 농도의 함수로서 수용체 반응 % [Ago]
PAM은 친화력을 증가시켜 초기 작용제 반응 곡선(솔리드 곡선)을 작용제 농도를 낮추거나 효능을 증가시켜 최대 반응을 증가시킨다. 파선 곡선은 PAM 추가 후 가능한 많은 곡선 중 두 가지 예다. 화살표는 곡선에서의 이동의 대략적인 방향을 보여준다.[4]
PAM-agonist들은 PAMs처럼 일하지만 그들 스스로 고민한다. 따라서 그들은 자신이 조절하는 작용제들의 최소 농도에서도 반응을 유도한다.[4]
PAM-antagonist는 작용제 친화력을 높이고 곡선을 낮은 농도로 전환하지만, 적대제로서 활동하면서 최대 반응도 낮아진다.[4]
NAM은 친화력을 감소시킴으로써 곡선을 더 높은 농도로 이동시키거나 효율성을 감소시킴으로써 최대 반응을 감소시킨다. PAMs와 비교하면 NAMs의 효과는 반비례한다.[4]
NAM-agonist들은 NAMs처럼 일하지만 그들 스스로 고민한다. 따라서 그들은 자신이 조절하는 작용제들의 최소 농도에서도 반응을 유도한다.[4]
의학적 중요성
혜택들
관련 수용체는 구조상 매우 유사한 정관 부위가 있는데, 이 부위 내의 돌연변이가 특히 수용체 기능을 저하시킬 수 있기 때문이다. 이것은 유기체에 해로울 수 있기 때문에 진화는 종종 그러한 변화를 선호하지 않는다. 알로스테릭 부위는 수용체 기능에 덜 중요하기 때문에 관련 수용체 간에 큰 변동을 보이는 경우가 많다. 이것이 정맥주사 약물에 비해 알로스테리 약물이 매우 구체적일 수 있는 이유, 즉 매우 제한된 수용체 유형에 대해서만 그 효과를 목표로 삼을 수 있는 이유다. 그러나, 그러한 불가촉천적인 부위의 변동성은 종들 사이에 또한 발생하기 때문에 불가촉천적인 약물의 효과는 종들마다 크게 다르다.[11]
조절기 작용은 인체 내에서 생산을 제한하고 통제하는 신경전달물질과 같은 내생성 리간드에 의존하기 때문에 조절기는 수용기를 완전히 켜거나 끌 수 없다. 이것은 유사하게 작용하는 정맥주사 약물에 비해 과다복용 위험을 낮출 수 있다. 또한 수용체를 포화시킬 수 있을 만큼 충분히 큰 선량을 투여하여 약물 효과를 연장할 수 있는 전략을 허용할 수 있다.[4] 이는 또한 수용체가 시기나 목적에 관계없이 작용제에 의해 지속적으로 활성화되는 대신 규정된 시간(즉, 자극에 반응하여)에 활성할 수 있도록 한다.[12]
조절기는 조직 내의 기존 반응에 영향을 미치며 조직 특정 약물 표적을 허용할 수 있다. 이것은 그들이 결합할 수 있는 모든 수용체에 대하여 신체 내에서 덜 목표적인 효과를 내는 경향이 있는 정관성 약물과 다르다.[4]
일부 조절기도 일부 고민자들이 갖고 있는 위축 효과가 부족한 것으로 나타났다. 예를 들어 니코틴 아세틸콜린 수용체는 작용제 약물이 있을 때는 빠르게 감쇠되지만 PAM이 있을 때는 정상적인 기능을 유지한다.[13]
적용들
알로스테릭 변조는 이전에는 다른 의약품으로 제어하기 어려웠던 많은 조건에 이로운 것으로 입증되었다. 여기에는 다음이 포함된다.
- 4-니트로-N-(1,3-디페닐-1H-피라졸-5-yl)벤자미드(VU-29)와 같은 실험용 mGluR5 양성 조절기를 사용하여 조현병과 관련된 음성 증상(피치)을 줄인다.[14]
- GABA 수용체를 긍정적으로 변조하여 불안감을 줄인다.[9]
- GABA 수용체를 긍정적으로 조절하여 수면 장애의 강도를 감소시킨다.[9]
- 도파민 수용체를 양성적으로 조절함으로써 주요 우울 장애와 정신분열증의 우울 증상을 감소시킨다. 실험용1 DETQ, DPTQ, LY3154207 등이 그 예다.[15]
참고 항목
참조
- ^ a b Rang HP, Ritter JM, Flower RJ, Henderson G (2016). Rang and Dale's pharmacology (8th ed.). Elsevier. pp. 6–20. ISBN 978-0-7020-5362-7.
- ^ a b c d Neubig RR, Spedding M, Kenakin T, Christopoulos A (December 2003). "International Union of Pharmacology Committee on Receptor Nomenclature and Drug Classification. XXXVIII. Update on terms and symbols in quantitative pharmacology" (PDF). Pharmacological Reviews. 55 (4): 597–606. doi:10.1124/pr.55.4.4. PMID 14657418.
- ^ Nelson DL, Cox MM (2008). Lehninger Principles of Biochemistry (5th ed.). W.H. Freeman. pp. 162. ISBN 978-0-7167-7108-1.
- ^ a b c d e f g h i j k l m n o p q r s t Kenakin TP (2017). Pharmacology in drug discovery and development: understanding drug response (2nd ed.). Academic Press. pp. 102–119. doi:10.1016/B978-0-12-803752-2.00005-3. ISBN 978-0-12-803752-2.
- ^ a b c Jin R, et al. (2005-09-28). "Mechanism of Positive Allosteric Modulators Acting on AMPA Receptors". Journal of Neuroscience. 25 (39): 9027–9036. doi:10.1523/JNEUROSCI.2567-05.2005. ISSN 0270-6474. PMC 6725607. PMID 16192394.
- ^ a b Stephens B, Handel TM (2013). Chemokine receptor oligomerization and allostery. Progress in Molecular Biology and Translational Science. Vol. 115. Academic Press. pp. 4–5. doi:10.1016/B978-0-12-394587-7.00009-9. ISBN 978-0-12-394587-7. PMC 4072031. PMID 23415099.
- ^ a b Melancon BJ, Hopkins CR, Wood MR, Emmitte KA, Niswender CM, Christopoulos A, et al. (February 2012). "Allosteric modulation of 7 transmembrane spanning receptors: theory, practice, and opportunities for CNS drug discovery". Journal of Medicinal Chemistry. 55 (4): 1445–64. doi:10.1021/jm201139r. PMC 3349997. PMID 22148748.
- ^ Hellyer SD, Albold S, Wang T, Chen AN, May LT, Leach K, Gregory KJ (May 2018). "5 Allosteric Ligands". Molecular Pharmacology. 93 (5): 504–514. doi:10.1124/mol.117.111518. PMID 29514854.
- ^ a b c d Arey BJ, et al. (2014). Biased signaling in physiology, pharmacology and therapeutics. Elsevier. pp. 187–189. doi:10.1016/B978-0-12-411460-9.00006-9. ISBN 9780124114609.
- ^ Bilezikian JP, et al. (2019). Principles of bone biology (4th ed.). Elsevier. p. 542. doi:10.1016/B978-0-12-814841-9.00023-3. ISBN 9780128148419.
- ^ Lu S, He X, Ni D, Zhang J (July 2019). "Allosteric Modulator Discovery: From Serendipity to Structure-Based Design". Journal of Medicinal Chemistry. 62 (14): 6405–6421. doi:10.1021/acs.jmedchem.8b01749. PMID 30817889. S2CID 73515780.
- ^ Li Y, et al. (2019-01-10). "Design and Synthesis of Novel Positive Allosteric Modulators of α7 Nicotinic Acetylcholine Receptors with the Ability To Rescue Auditory Gating Deficit in Mice". Journal of Medicinal Chemistry. 62 (1): 159–173. doi:10.1021/acs.jmedchem.7b01492. ISSN 1520-4804. PMID 29587480.
- ^ Williams DK, Wang J, Papke RL (2011-10-15). "Positive allosteric modulators as an approach to nicotinic acetylcholine receptor-targeted therapeutics: Advantages and limitations". Biochemical Pharmacology. Nicotinic Acetylcholine Receptors as Therapeutic Targets: Emerging Frontiers in Basic Research and Clinical Science (Satellite to the 2011 Meeting of the Society for Neuroscience). 82 (8): 915–930. doi:10.1016/j.bcp.2011.05.001. ISSN 0006-2952. PMC 3162128. PMID 21575610.
- ^ Ayala JE, et al. (2009). "mGluR5 Positive Allosteric Modulators Facilitate both Hippocampal LTP and LTD and Enhance Spatial Learning". Neuropsychopharmacology. 34 (9): 2057–2071. doi:10.1038/npp.2009.30. ISSN 1740-634X. PMC 2884290. PMID 19295507.
- ^ Svensson KA, et al. (2019). "Positive allosteric modulators of the dopamine D1 receptor: A new mechanism for the treatment of neuropsychiatric disorders". Neuropsychotherapeutics. Advances in Pharmacology. Vol. 86. pp. 273–305. doi:10.1016/bs.apha.2019.06.001. ISBN 9780128166680. ISSN 1557-8925. PMID 31378255.