불가지론적 상호작용
Agostic interaction불가지론적 상호작용은 C-H 결합과 코디네이터 불포화 전이 금속의 상호작용을 위한 유기물 화학의 용어로서, C-H 결합에 관여하는 두 전자가 전환 금속의 빈 d-오르비탈에 들어가 3중 2 전자 결합을 초래한다.[1] 산화 첨가 및 환원 제거와 같은 많은 촉매변환들은 불가지론적 상호작용을 특징으로 하는 매개체를 통해 진행되도록 제안된다. 알킬, 알킬리덴, 폴리에닐 리간드의 유기물 화학 전체에서 불가지론적 상호작용이 관찰된다.
역사
'자신에게 가까이하라'는 고대 그리스어에서 유래된 불가지론이라는 용어는 고전주의자인 재스퍼 그리핀의 제안으로 모리스 브룩하트와 말콤 그린이 이를 비롯한 전환 금속과 C-H 결합 사이의 많은 상호작용을 설명하기 위해 만들었다. 종종 그러한 불가지론적 상호작용은 추가적인 b-본드를 통해 금속 중심 가까이에 있는 알킬 또는 아릴 그룹을 포함한다.[2][3]
탄화수소 대체물과 조정적으로 불포화 금속 복합체 사이의 짧은 상호작용은 1960년대 이후로 주목되어 왔다. 예를 들어 트리스(트리페닐인산) 루테늄 디클로로이드에서는 루테늄(Ruthenium) 간에 짧은 교호작용이 관찰된다.II) 9개의 페닐 링 중 한 개의 정형 위치에 수소 원자를 배치한다.[4] 붕수화합물의 복합체는 3-중앙 2-전자 본딩 모델을 사용하는 것으로 설명된다.
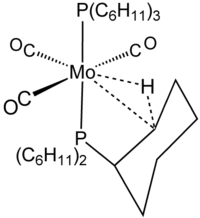
상호작용의 특성은 트리메틸알루미늄의 구조 화학에서 주요 그룹 화학에서 예시되었다.
불가지론적 채권의 특성
불가지론적 상호작용은 결정론적으로 가장 잘 나타난다. 중성자 회절 데이터는 C-H와 M andH 결합 거리가 분리된 금속 하이드라이드와 탄화수소의 경우 예상보다 5-20% 길다는 것을 보여주었다. 금속과 수소 사이의 거리는 일반적으로 1.8–2.3 å이며, M┄H-C 각도는 90°–140°의 범위에 있다. 일반 아릴 또는 알칸의 그것으로부터 위로 이동되는 H NMR 신호의 존재, 종종 일반적으로 하이드라이드 리간드에 할당되는 영역. 연결 상수 J는CH 일반적으로 정상적인 sp3 탄소-수소 결합에 대해 예상되는 125Hz 대비 70–100Hz로 낮아진다.
채권의 강도
실험 및 계산 연구에 기초하여, 불가지론적 상호작용에서 발생하는 안정성은 10–15 kcal/mol로 추정한다. 적합성 상수를 사용한 최근의 계산은 더 약한 안정화(<10 kcal/mol)를 가리킨다.[6] 따라서, 불가지론적 상호작용은 대부분의 수소 결합보다 강하다. 불가지론적 결합은 때때로 전환 상태에서 '강경성'을 증가시킴으로써 촉매제도에 역할을 한다. 예를 들어 지글러-나타 촉매에서 고도로 전기생성 금속 중심은 성장하는 폴리머 체인과 불가지론적인 상호작용을 가진다. 이러한 강성의 증가는 중합 공정의 입체성에 영향을 미친다.
관련 접합 상호 작용
불가지론이라는 용어는 탄소, 수소 및 금속 사이의 2-전자, 3-중심 결합 상호작용을 설명하기 위해 사용된다. 그림에서 보이는 불가지론적 콤플렉스와 밀접하게 관련되는, 예를 들어 W(CO)(3PCY3)2H의22 복합화에 2-전자 3-중심 결합이 분명히 관련되어 있다.[8] 실레인은 불가지론적, 3중심의 Si┄H-M 상호작용을 통해 금속 중심부에 결합되는 경우가 많다. 그러나 이러한 상호작용은 탄소를 포함하지 않기 때문에 불가지론자로 분류되지 않는다.
불가지론적 결합
특정 MH-C 상호작용은 불연속적인 것으로 분류되지 않고 불연속적인 용어로 설명된다. 불가지론적 상호작용은 성격상 더 정전기적이다. 불가지역 상호작용 구조 측면에서, M mH 거리와 M┄H-C 각도는 각각 2.3–2.9 9과 110°–170°의 범위에 포함된다.[2][9]
함수
불가지론적 상호작용은 철새 삽입뿐만 아니라 알켄 중합과 입체화학에서 중요한 기능을 한다.
참조
- ^ IUPAC, 화학용어 종합편찬, 제2편. ("금책")(1997년). 온라인 수정 버전: (2006–) "무관론적 상호 작용". doi:10.1351/골드북.AT06984
- ^ a b Brookhart, Maurice; Green, Malcolm L. H. (1983). "Carbon-hydrogen-transition metal bonds". J. Organomet. Chem. 250: 395–408. doi:10.1016/0022-328X(83)85065-7..
- ^ Brookhart, Maurice; Green, Malcolm L. H.; Parkin, Gerard (2007). "Agostic interactions in transition metal compounds". Proc. Natl. Acad. Sci. 104 (17): 6908–14. Bibcode:2007PNAS..104.6908B. doi:10.1073/pnas.0610747104. PMC 1855361. PMID 17442749.

- ^ La Placa, Sam J.; Ibers, James A. (1965). "A Five-Coordinated d6 Complex: Structure of Dichlorotris(triphenylphosphine)ruthenium(II)". Inorg. Chem. 4 (6): 778–783. doi:10.1021/ic50028a002.
- ^ Z. Dawoodi; M. L. H. Green; V. S. B. Mtetwa; K. Prout; A. J. Schultz; J. M. Williams; T. F. Koetzle (1986). "Evidence for Carbon–Hydrogen–Titanium Interactions: Synthesis and Crystal Structures of the Agostic alkyls [TiCl3(Me2PCH2CH2PMe2)R] (R = Et or Me)". J. Chem. Soc., Dalton Trans. (8): 1629. doi:10.1039/dt9860001629.
- ^ Von Frantzius, Gerd; Streubel, Rainer; Brandhorst, Kai; Grunenberg, Jörg (2006). "How Strong is an Agostic Bond? Direct Assessment of Agostic Interactions Using the Generalized Compliance Matrix". Organometallics. 25 (1): 118–121. doi:10.1021/om050489a.
- ^ Nikonov, G. I. (2005). "Recent Advances in Nonclassical Interligand SiH Interactions". Adv. Organomet. Chem. Advances in Organometallic Chemistry. 53: 217–309. doi:10.1016/s0065-3055(05)53006-5. ISBN 9780120311538.
- ^ Kubas, G. J. (2001). Metal Dihydrogen and σ-Bond Complexes. New York: Kluwer Academic. ISBN 978-0-306-46465-2.
- ^ Braga, D.; Grepioni, F.; Tedesco, E.; Biradha, K.; Desiraju, G. R. (1997). "Hydrogen Bonding in Organometallic Crystals. 6. X−H┄M Hydrogen Bonds and M┄(H−X) Pseudo-Agostic Bonds". Organometallics. 16 (9): 1846–1856. doi:10.1021/om9608364.







