2,4,6-트리-테르트-부틸페놀
2,4,6-Tri-tert-butylphenol | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 2,4,6-트리-테르트-부틸페놀 | |
| 기타 이름 2,4,6-TBP | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐벨 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.010.900 |
| EC 번호 |
|
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| 특성. | |
| C18H30O | |
| 중량 몰 | 262.437 g·190−1 |
| 재해 | |
| GHS 픽토그램 |   |
| GHS 신호 단어 | 경고 |
| H302, H315, H319, H400, H410 | |
| P264, P270, P273, P280, P301+312, P302+352, P305+351+338, P321, P330, P332+313, P337+313, P362, P391, P501 | |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
2,4,6-트리-테르트-부틸페놀(2,4-6-TTBP)은 3개의 테르트-부틸 그룹으로 대칭적으로 대체되는 페놀로, 따라서 강직적으로 방해를 강하게 받는다. 2,4,6-TBP는 쉽게 산화할 수 있는 방향족 화합물이며 약한 산이다. 딥블루 2,4,6-트리-부틸페녹시(deep-flue-tri-tert-butylpenoxy) 급진성을 부여하기 위해 산화하며,[1] 2,4,6-TTBP는 2,6-di-tert-butylpenol과 관련이 있어 산업용에서 항산화제로 널리 사용되고 있다. 이 화합물들은 무색의 고체들이다.[2]
준비
2,4,6-트리-테르트-부틸페놀의 준비는 광범위하게 연구되어 왔다. 1890년 초에 빌헬름 코에니그스는 이소부틸렌과 페놀의 산성화 반응을 설명했다.[3] 그 밖에 많은 보도가 나왔다.[4] 최대 90%의 수확량이 보고되었다. 불완전한 알킬화의 전형적인 면 제품들이 그 결과:4-tert-butylphenol(4-TBP), 2,4-di-tert-butylphenol(2,4-DTBP), 2,6-di-tert-butylphenol(2,6-DTBP). 2,5-Di-tert-butylphenol(2,5-DTB)발견되었다.[5]2,4,6-tri-tert-butylphenol 또한 부산물로 disubstitution 제품 2,4-DTBP과 2,6-DTBP는의 합성에서 발견된다. 더 널리 사용되는 산화 방지제들이다.[2]
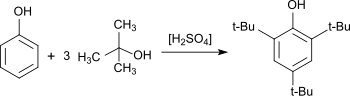
2,4,6-트리-테르트-부틸페놀의 합성이 기술되었는데, 이는 교수 실험으로도 적합하다. 알킬링제로는 메틸테르트부틸에테르를, 촉매로는 황산을 사용하며, 69%의 수율에서 2,4,6-TTBP를 얻고 있다.[6]
특성.
2,4,6-트리-테르트-부틸페놀은 많은 유기 용매에서 용해되지만 수성 용액이나 알칼리성 용액에서는 용해되지 않는다. 페놀의 특징인 철분(III)염소화물이 함유된 녹색-파란색소는 2,4,6-TTBP에서는 발생하지 않는다. 그 화합물은 공기에서는 산화할 수 있지만 사실상 생체 분해는 불가능하다.[7]
전자가 풍부한 방향제로서 2,4,6-트리-테르트-부틸페놀도 전기화학적으로 쉽게 산화될 수 있다.[8] 알칼리성에서는 형성된 페놀레이트 음이온이 페녹시 래디컬에 대한 가역반응으로 먼저 산화된다. 안정적 급진성은 페녹소늄 양이온에 대한 추가적인 전자 철수에 의해 산화되는데, 이 양이 물에 반응하여 2,4,6-트리-테르트-부틸-4-히드록시-2,5-사이클로헥사디엔온을 투여한다.
산성 매체에서 히드록시디엔은 테르트부틸 그룹의 갈라진 틈으로 데알킬화하여 2,6-디-테르트-부틸-1,4-벤조퀴논으로 산화시킨다.
알칼리성의 2,4,6-트리-테르트-부틸페놀을 강렬한 청색의 페녹시 래디컬에 산화시키는 것도 페리시아니드 칼륨과 함께 발생할 수 있다.[1][9][6] 2,4,6-트리-테르트-부틸페녹시(butylpenoxy)급은 -70°C까지 냉각할 때 청결정을 형성하는데, 이는 상온에서 몇 주 동안 안정되어 서서히 노란색으로 변하기만 한다.[9] 페녹시 래디컬은 산소와 일리라디칼로서 반응하여 황색 결정을 형성하는 4,4' 연계 과산화수소를 형성한다.[10]
적용들
전자가 풍부한 2,4,6-트리-테르트-부틸페놀은 페녹시 래디칼로 쉽게 산화될 수 있으며, 4-위치에 페놀은 [11][12]물론 해당 사이클로헥사디논에 알코올과 티올이[13] 첨가된다. 문헌에서 치놀레스로도 언급되는 사이클록사디엔온은 산성 조건에서 가열할 때 4-위치 테르트 부틸 그룹을 가르고 대체 페놀로 되돌아간다.
이 반응은 항산화제로 자주 쓰이는 2,6-di-tert-butyl-4-methoxypenol의 합성에 사용할 수 있다.
2,4,6-TTBP는 연료, 유압유 및 윤활유와 같은 기술적 용도에서 안정제, 프리라디칼 스캐빈저 및 산화방지제로 사용되며 탄성 및 열가소성 중합체에서도 사용된다. 그것의 두드러진 지속성 때문에, 2,4,6-TTBP의 높은 생물 축적과 수생 독성 경향 때문에, 2,4,6-TBP는 낮은 산업용일 뿐이며, 예를 들어, 일본에서는 금지된다.
2,4,6-TTBP의 페녹시 래디메틸은 또한 3차 아민을 형성하기 위한 핵소피성 디메틸아미노메틸군[(CH3)-2N-CH-2]의 전달을 위한 시약에서 강직적으로 요구하는 보호군으로 설명된다.[14]
참조
- ^ Jump up to: a b Warren, J. J.; Tronic, T. A.; Mayer, J. M. (2010). "Thermochemistry of Proton-Coupled Electron Transfer Reagents and Its Implications". Chemical Reviews. 110: 6961–7001. doi:10.1021/cr100085k. PMC 3006073.
- ^ Jump up to: a b Peter P. Klemchuk (2005). "Antioxidants". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a03_091.
- ^ „ch in diesem Palle[findet] scheinbar eine directe Addition eines ungesétigten Khlenwasserssterstof aine aromatische Substantanz statt". W. Koenigs (1890), "Ueber Condensationen ungesättigter Kohlenwasserstoffe mit Phenolen" (PDF), Chem. Ber. (in German), 23 (2), pp. 3144–3146, doi:10.1002/cber.189002302257
- ^ A.R. Hajipour; Y. Ghayeb; N. Sheikhan; A.E. Ruoho (2009), "Brønsted acidic ionic liquid as an efficient and reusable catalyst for one-pot synthesis of 1-amidoalkyl 2-naphthols under solvent-free conditions", Tetrahedron Lett., 50, pp. 5649–5651, doi:10.1016/j.tetlet.2009.07.116
- ^ G.H. Stillson; D.W. Sawyer; C.K. Hunt (1945), "The hindered phenols", J. Am. Chem. Soc., 67 (2), pp. 303–307, doi:10.1021/ja01218a045
- ^ Jump up to: a b B.G. Somers; C.D. Cook (1955), "The preparation of 2,4,6-tri-tert-butylphenol", J. Chem. Educ., 32 (6), p. 312, doi:10.1021/ed032p312
- ^ "Screening Assessment for the Challenge, Phenol, 2,4,6-tris(1,1-dimethylethyl)-(2,4,6-tri-tert-butylphenol), CAS Registry Number 732-26-3" (PDF). Environment Canada, Health Canada. November 2008. Retrieved 2017-01-11.
- ^ J.A. Richards; P.E. Whitson; D.H. Evans (1975), "Electrochemical oxidation of 2,4,6-tri-tert-butylphenol", J. Electroanal. Chem. (in German), 63 (3), pp. 311–327, doi:10.1016/s0022-0728(75)80303-2
- ^ Jump up to: a b C.D. Cook; D.A. Kuhn; P. Fianu (1956), "Oxidation of hindered phenols. IV. Stable phenoxy radicals", J. Am. Chem. Soc., 78 (9), pp. 2002–2005, doi:10.1021/ja01590a067
- ^ C.D. Cook; R.C. Woodworth (1953), "Oxidation of hindered phenols. II. The 2,4,6-Tri-t-butylphenoxy radical", J. Am. Chem. Soc., 75 (24), pp. 6242–6244, doi:10.1021/ja01120a040
- ^ US 3410878, H.D. 베커, "퀴놀 에테르 준비" 1968년 11월 12일 발행
- ^ E. Müller; K. Ley; G. Schlechte (1957), "Über Sauerstoffradikale, VIII. Über Dehydrierung von Phenolen", Chem. Ber. (in German), 90 (11), pp. 2660–2672, doi:10.1002/cber.19570901136
- ^ US 3895069, J.H. 앳킨슨, D. 클라크, 1975-7-15 "2,4,6-트리알킬-4-알킬시오 또는 4-alkoxycylohexadi-2,5-ene-1-one 준비 과정"
- ^ D. Seebach; T. Hassel (1978), "2,4,6-Tri-tert-butylphenoxy (TBPO) als sterisch wirksame Carbonylschutzgruppe — Ein neues nucleophiles Dimethylaminomethylierungsmittel", Angew. Chem. (in German), 90 (4), pp. 296–297, doi:10.1002/ange.19780900422